分散固相萃取结合超高效液相色谱-串联质谱法同时测定柑橘中春雷霉素与噻霉酮残留
安 姣,康霞丽,杨 秦,赵其阳,张耀海,王成秋,焦必宁
(中国农业科学院/西南大学柑桔研究所,农业农村部柑桔产品质量安全风险评估实验室(重庆), 农业农村部柑桔及苗木质量监督检验测试中心,重庆 400712)
柑橘属作为世界第一大水果,深受人们的喜爱,但其在种植中易受到黄龙病、疮痴病、溃疡病等病害的侵染,虽可使用杀菌剂进行防治,但同时也会产生农药残留问题。春雷霉素(Kasugamycin,结构式见图1)属于氨基糖苷类抗生素,易溶于水,是一种环境友好的内吸性杀菌剂[1]。噻霉酮(Benziothiazolinone)属有机杂环类杀菌剂(异噻唑啉酮类衍生物),对细菌、真菌均有较强的抑制毒杀作用。这两种农药均可有效防治柑橘溃疡病、水稻稻瘟病、黄瓜细菌性角斑病、烟草野火病等,且田间药效试验表明,二者混剂对番茄斑疹病的防治效果显著高于单剂[2]。因连续使用抗生素易产生抗药性[3],春雷霉素宜与其它不同作用机制的杀菌剂交替或混合使用[1]。美国[4]、日本[5]和欧盟[6]规定春雷霉素的最大残留限量(MRL)为0.01~0.6 mg/kg;我国GB 2763-2019[7]规定春雷霉素在柑、橘、橙上的 MRL为0.1 mg/kg,而噻霉酮在柑橘上暂无限量标准(其他作物上的MRL为0.05~1 mg/kg)。
目前,国内外春雷霉素的残留检测方法主要有高效液相色谱法(HPLC)[8]、反向离子对液相色谱法(IP-HPLC)[9-11]、液相色谱串联质谱法(LC-MS/MS)[12-18]和高效毛细管电泳法[19]、胶束液相色谱法[20]、生物测定法[21]等,样品多为水、土壤、蔬菜、谷物等。春雷霉素极性大且无发色基团,在反向色谱柱上难保留,分析检测难度较大。虽然可通过衍生化操作引进发色基团进行紫外检测,但该过程操作繁琐且易引入未知杂质[22]。Sheu等[8]利用高效液相色谱(HPLC/UV)检测了水中的春雷霉素含量,但灵敏度较低(定量下限为2.2 mg/L)。牛长群、吴国旭等[11]建立了春雷霉素的反相离子对高效液相色谱检测方法,通过加入离子对试剂改变保留时间;但该法对于试剂、浓度、室温有较高要求,且保留时间过长(14.5 min),不适合大量样品快速检测。液相色谱串联质谱法选择性好,定性定量能力强,但净化方式基本以固相萃取(SPE)为主,迄今尚未见分散固相萃取(DSPE)净化春雷霉素的相关文献报道。噻霉酮残留的检测方法较少,且主要集中在材料、化妆品、涂料等工业领域,其在食品中的残留检测主要以液相色谱法[23-24]为主,粟有志等[25]采用QuEChERS前处理方法结合 HPLC-MS/MS测定了果蔬中的噻霉酮。由于上述两种农药均无国家及行业标准的检测方法,也未见到柑橘中相关检测方法报道,因此建立柑橘中春雷霉素和噻霉酮的检测方法具有重要意义。
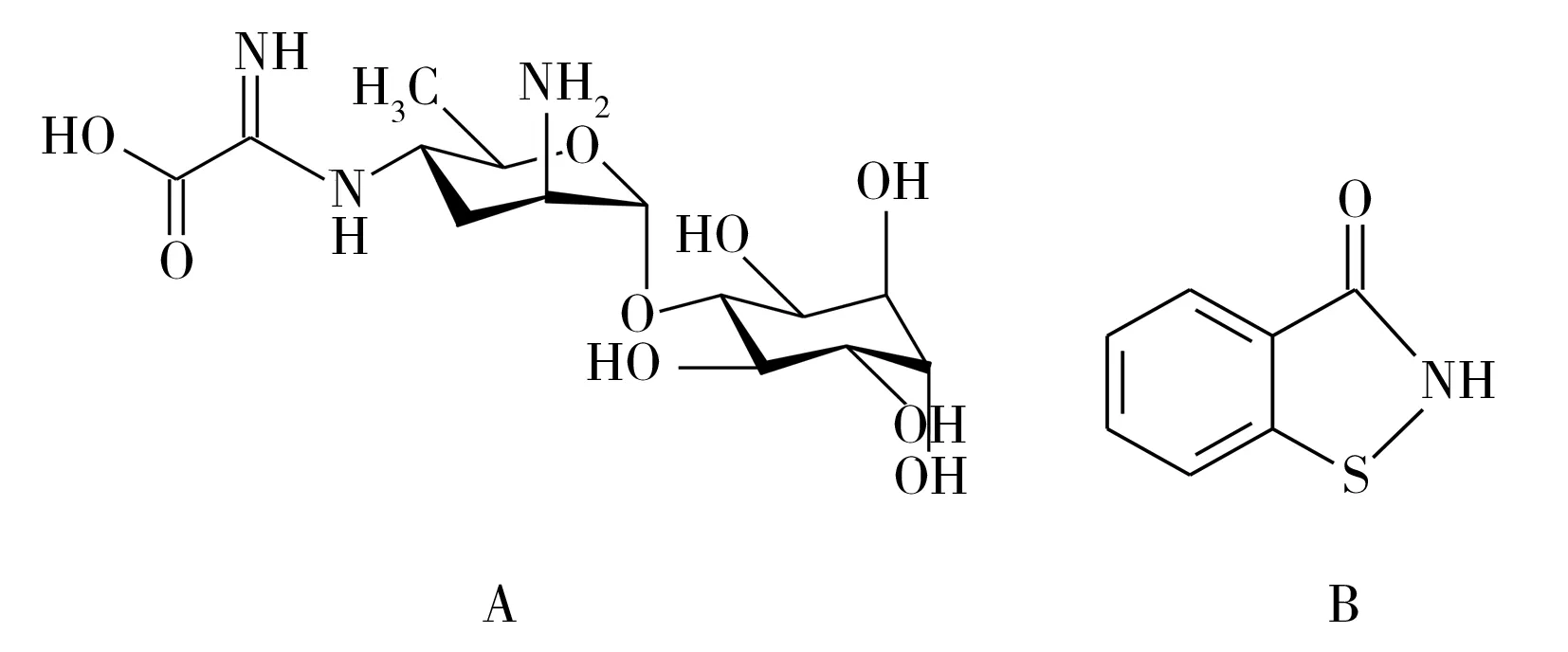
图1 春雷霉素(A)和噻霉酮(B)结构式Fig.1 Structural formula of kasugamycin (A) and benziothiazolinone (B)
本研究采用分散固相萃取法净化样品,结合超高效液相色谱-串联质谱法(UPLC-MS/MS),建立了同时测定柑橘中春雷霉素和噻霉酮残留的分析方法,该方法灵敏度高,准确度好,方便快捷,能够满足分析检测要求,填补了柑橘中春雷霉素和噻霉酮同时检测的空白,并为噻霉酮在柑橘上的限量标准制订提供了数据支持,为食品中农药残留安全性评价提供了科学依据。
1 实验部分
1.1 仪器与试剂
Nexera X2 超高效液相色谱仪(日本Shimadzu公司),QTRAP®6500三重四极杆/复合线性离子阱质谱(美国AB公司),IonDriveTMTurbo V 离子源,Analyst®1.6.3工作站;CL31/CL31R 多用途离心机(美国Thermo Fisher公司);Milli-Q A10超纯水仪(美国Millipore公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);CK2000型高通量组织研磨仪(北京Thmorgan生物科技有限公司)。
春雷霉素(89.0%)、噻霉酮(99.6%)(德国 Dr.Ehrenstorfer公司);乙腈、甲醇(色谱纯,德国 CNW公司);N-丙基乙二胺(PSA)、超纯反相C18填料(加拿大 SiliCycle公司);石墨化炭黑(GCB,德国 CNW公司)。
1.2 标准溶液配制与标准曲线的绘制
用甲醇分别配制质量浓度1 000 mg/L的春雷霉素和噻霉酮单标储备液,分别移取适量标准储备液用甲醇稀释成100 mg/L的标准混合液,-50 ℃保存。
分别用溶剂和空白基质提取液稀释标准溶液,配制成质量浓度为0.5、1、2、5、10、50、100、200 μg/L的溶剂标准工作液和基质匹配标准工作液,按照“1.4”仪器条件进行测定,以目标物的质量浓度(μg/L)为横坐标(x),对应峰面积值为纵坐标(y)绘制标准曲线。
1.3 前处理方法
准确称取匀浆后的柑橘样品2.00 g(精确至0.01 g)于50 mL聚四氟乙烯离心管中,全果样品中加入含0.5%甲酸的乙腈-水(7∶3,体积比,下同)溶液,果肉样品中加入含0.5%氨水的乙腈-水(7∶3)溶液,定容至20 mL,涡旋混匀,垂直振荡30 min后,10 000 r/min 离心5 min。移取2 mL上清液置于装有50 mg C18的离心管中,涡旋1 min,3 000 r/min 离心5 min,取上清液经0.22 μm 有机滤膜过滤,待测。
1.4 仪器条件
1.4.1 色谱条件Waters ACQUITY UPLC®HSS T3 色谱柱(150 mm×2.1 mm,1.8 μm);流动相:A为0.2%甲酸水溶液,B为甲醇。梯度洗脱程序:0~2 min,2% B,2~4 min,2%~98% B,4~8 min,98% B,8~8.1 min,98%~2% B,8.1~9 min,2% B。柱温40 ℃;进样量5 μL;流速0.2 mL/min。
1.4.2 质谱条件电喷雾离子源正离子模式(ESI+);多反应离子监测(MRM);气帘气(CUR):20 psi;离子化电压(IS):4 500 V;电喷雾离子源温度(TEM):500 ℃;喷雾气:50 psi;辅助加热气:50 psi;碰撞室入口电压(EP):10 V;碰撞室出口电压(CXP):10.5 V。其余质谱参数见表1。

表1 春雷霉素和噻霉酮的质谱参数Table 1 MS/MS parameters for kasugamycin and benziothiazolinone
*quantification ion
2 结果与讨论
2.1 仪器条件的优化
配制0.5 mg/L 的标准溶液,以针泵恒流进样分别在ESI+模式和ESI-模式下进行扫描,选择效果较好的正离子模式,得到母离子为[M+H]+,进行子离子扫描,找到合适的子离子后建立MRM离子对通道,进一步优化获得最佳去簇电压(DP)和碰撞能量(CE)。
针对高极性农药,有文献使用不同色谱柱包括反向柱[26]、阴离子交换柱[27]、反相和弱阴离子交换混合模式柱[28]、亲水相互作用柱等进行分析。春雷霉素是高亲水化合物,其结构中含有氨基,在反向柱(如C18柱)上难保留[15],常选择反相离子对液相色谱法(IP-HPLC)或亲水相互作用(HILIC)柱进行分析,但离子对试剂会影响质谱的灵敏度,而HILIC柱更宜与ESI-MS结合使用[22]。T3色谱柱以C18键合相为固定相,可用纯水作流动相,对极性化合物保留效果较好。本文比较了ACQUITY UPLC®HSS T3 色谱柱(150 mm×2.1 mm,1.8 μm),ACQUITY UPLC®HSS T3 色谱柱(50 mm×2.1 mm,1.8 μm)和ACQUITY UPLC®BEH HILIC色谱柱(50 mm×2.1 mm,1.7 μm)的分析效果,,发现HILIC柱上春雷霉素和噻霉酮出峰时间较为接近,两峰有重叠;50 mm的T3柱上春雷霉素保留时间较短,无法与杂质较好分离,150 mm的T3柱上可获得良好的峰形和分离度。故选择150 mm 的ACQUITY UPLC®HSS T3柱。
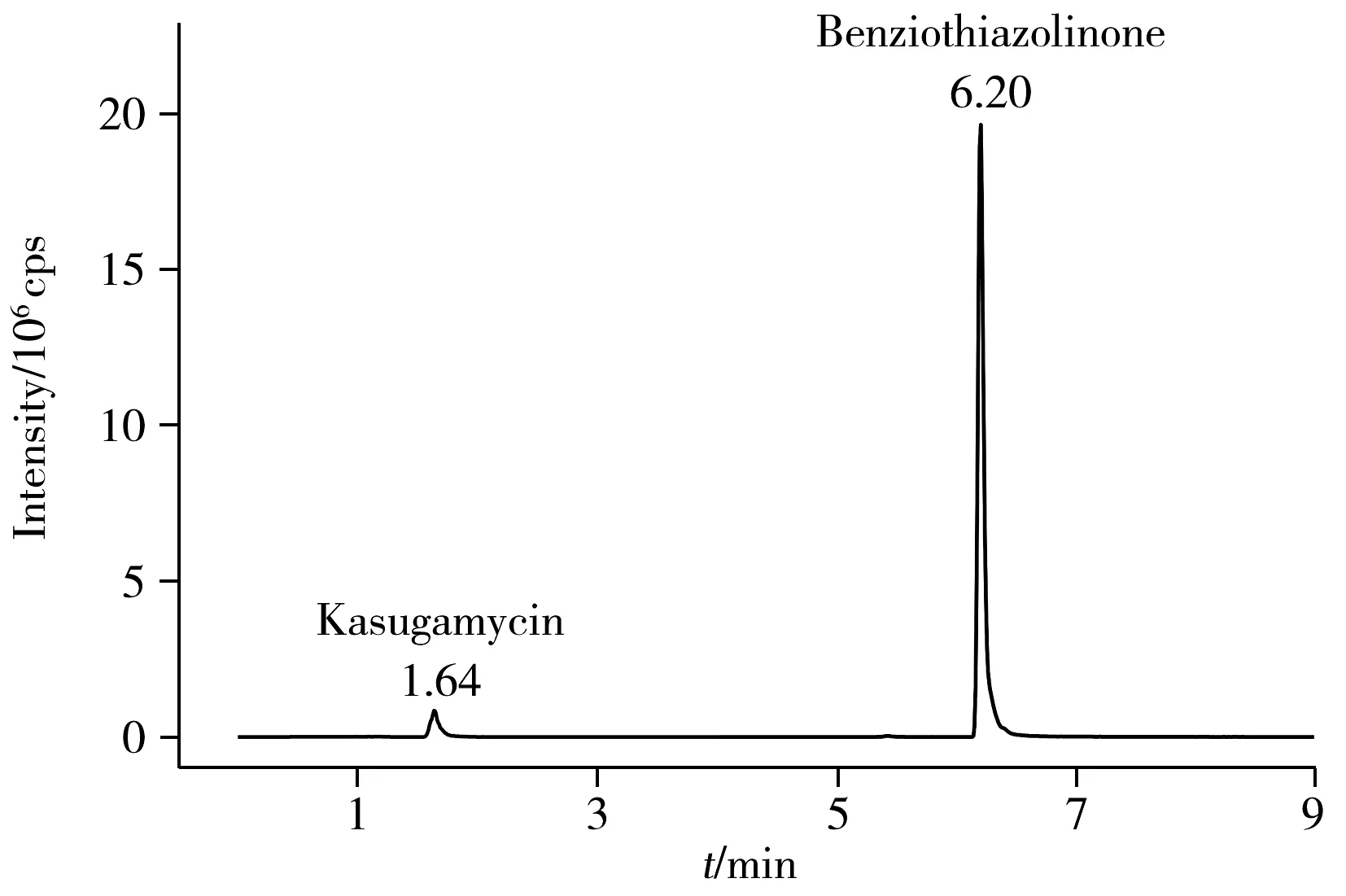
图2 0.2 mg/L春雷霉素和噻霉酮标准溶液色谱图Fig.2 0.2 mg/L kasugamycin and benziothiazolinone standard solution chromatogram
此外,分别比较了有机相为甲醇或乙腈,水相中加入不同含量甲酸(0.1%、0.2%)及乙酸铵时对峰形和响应值的影响。当有机相为乙腈时,噻霉酮有拖尾小峰出现。水相中加入甲酸可提高离子化效率,使响应值增加,峰形对称,0.2%甲酸较0.1%甲酸效果好;乙酸铵可促进离子化,调节pH值,改善峰形,但加入乙酸铵会使噪音值变大。综上所述,选择0.2%甲酸水-甲醇体系作为流动相。在该仪器条件下的标准溶液色谱图如图2所示。
2.2 前处理条件的优化
2.2.1 提取剂以柑橘样品为研究对象,考察了不同提取剂对两种农药的提取效果。春雷霉素和噻霉酮的提取剂多为甲醇或乙腈等极性溶剂,但试验过程中,当提取剂为甲醇或乙腈时,春雷霉素的回收率均无法满足要求(低于50%),而以乙腈提取噻霉酮时回收率较甲醇高,使用相同比例的甲醇-水和乙腈-水时,乙腈-水的回收率较好,故比较了不同比例的乙腈-水对全果基质的提取效果(加标水平0.1 mg/kg)。结果表明,随着乙腈含量的增加,噻霉酮的回收率增加,但春雷霉素在乙腈体积分数为80%时回收率骤降,当乙腈-水的体积比为7∶3时,两种目标物的回收率最好。
由于pH值对目标物的提取效率影响很大,故考察了酸碱度对回收率的影响(图3):对于全果基质,加入0.5%甲酸时,提取效果较好;而对于果肉基质,选择加入0.5%氨水时,目标物均满足回收率要求。最终选择含0.5%甲酸的乙腈-水溶液(7∶3)为柑橘全果提取剂,含0.5%氨水的乙腈-水溶液(7∶3)为柑橘果肉提取剂。
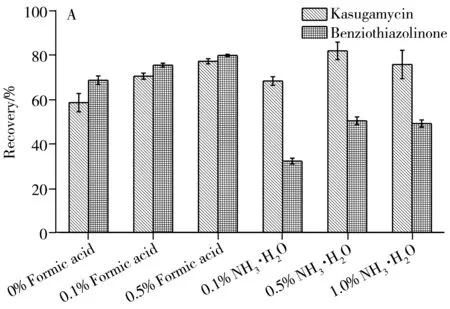
2.2.2 提取剂体积以柑橘全果为研究对象,比较了不同体积(10、20、30、40 mL)的提取剂对两种目标物的提取效果。结果显示,提取剂为20 mL和30 mL时,均能满足回收率要求,考虑到检测灵敏度和溶剂消耗,选择20 mL作为提取剂体积。
2.2.3 提取方式以全果基质为研究对象,比较了超声提取和振荡提取对提取率的影响。当提取时间为30 min时,振荡提取的提取效果较好,噻霉酮回收率较高,春雷霉素无太大变化。这可能是由于噻霉酮在水中的溶解度随温度上升而增大,而超声过程产热,噻霉酮进入乙腈层的比例减小,导致回收率较低。因此选用振荡提取方式。
2.2.4 净化剂在分散固相萃取(DSPE)中,目前使用最多的净化材料是N-丙基乙二胺(PSA)、超纯反相C18填料和石墨化炭黑(GCB)。PSA是一种弱阴离子交换剂,可有效去除有机酸、色素及一些糖类物质;C18可去除基质中的脂肪和脂类等非极性有机物;GCB能很好地去除色素和固醇类化合物[29]。
因此,比较了50 mg C18、PSA、GCB对于柑橘全果基质的净化效果,净化后,提取液颜色由浅到深依次为GCB>C18>PSA,证明GCB对色素具有良好吸附作用。当净化剂为GCB时,噻霉酮的回收率偏低,可能由于GCB对极性分子具有强亲和力,可与具有苯环等平面结构的噻霉酮发生疏水相互作用,导致净化过程中分析物损失[30],回收率下降。当净化剂为C18和PSA时,两种目标物回收率均可满足要求,其中C18略优,因此选用C18作为净化剂。进一步考察了25、50、75、100 mg C18对回收率的影响,结果表明:C18用量为25~75 mg时,春雷霉素回收率逐步上升,噻霉酮则在用量为50 mg时回收率较好,故最终选择50 mg C18作为净化剂。
2.3 标准曲线与检出限
样品本身的内源性组分和前处理引入的外源性组分产生的基质效应影响方法的线性、灵敏度、精密度等[32],本法采用基质匹配标准曲线校正基质效应(ME=基质匹配标准曲线斜率/溶剂标准曲线斜率)。结果如表2所示,基质对两种目标物均存在抑制作用,且对春雷霉素抑制作用强烈。以3倍信噪比(S/N)对应的检测浓度确定检出限(LOD),以最小加标浓度确定定量下限(LOQ)。在0.5~200 μg/L质量浓度范围内,春雷霉素和噻霉酮线性良好(r2>0.999),检出限(LODs)为0.006~0.04 μg/kg,定量下限(LOQs)为5~10 μg/kg。

表2 春雷霉素和噻霉酮的线性范围、线性方程、相关系数、基质效应、方法检出限和定量下限Table 2 Linear ranges,regression equations,correlation coefficients(r2),matrix effects,limits of detection(LODs) and limits of quantification(LOQs) for kasugamycin and benziothiazolinone
2.4 准确度与精密度
在柑橘全果和果肉空白基质中添加不同浓度的标准溶液,按照“1.3”方法处理,每个加标水平做6个平行。由表3可知,在5~1 000 μg/kg加标水平下,春雷霉素的回收率为79.7%~104%,相对标准偏差(RSD)为5.6%~9.6%;噻霉酮的回收率为73.4%~88.5%,RSD为1.6%~8.0%。结果表明该方法具有良好的准确度和精密度,可满足农残检测分析要求。
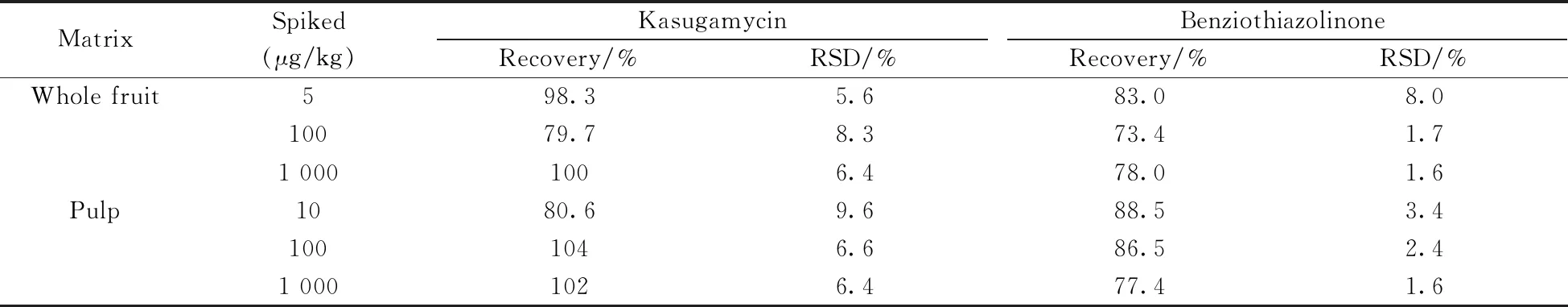
表3 不同基质中春雷霉素和噻霉酮的加标回收率和相对标准偏差(n=6)Table 3 Recoveries and relative standard deviations(RSDs) of kasugamycin and benziothiazolinone in different matrixes(n=6)
2.5 方法对比
本方法使用C18进行分散固相萃取净化,与固相萃取小柱相比,成本低,耗时少,摒弃了丙酮等不适合液质的提取剂,简化了前处理步骤,且回收率较好,适合大量样品的快速检测(表4)。

表4 春雷霉素和噻霉酮在食品中的检测方法对比Table 4 Comparison of detection methods of kasugamycin and benziothiazolinon in food
2.6 实际样品检测
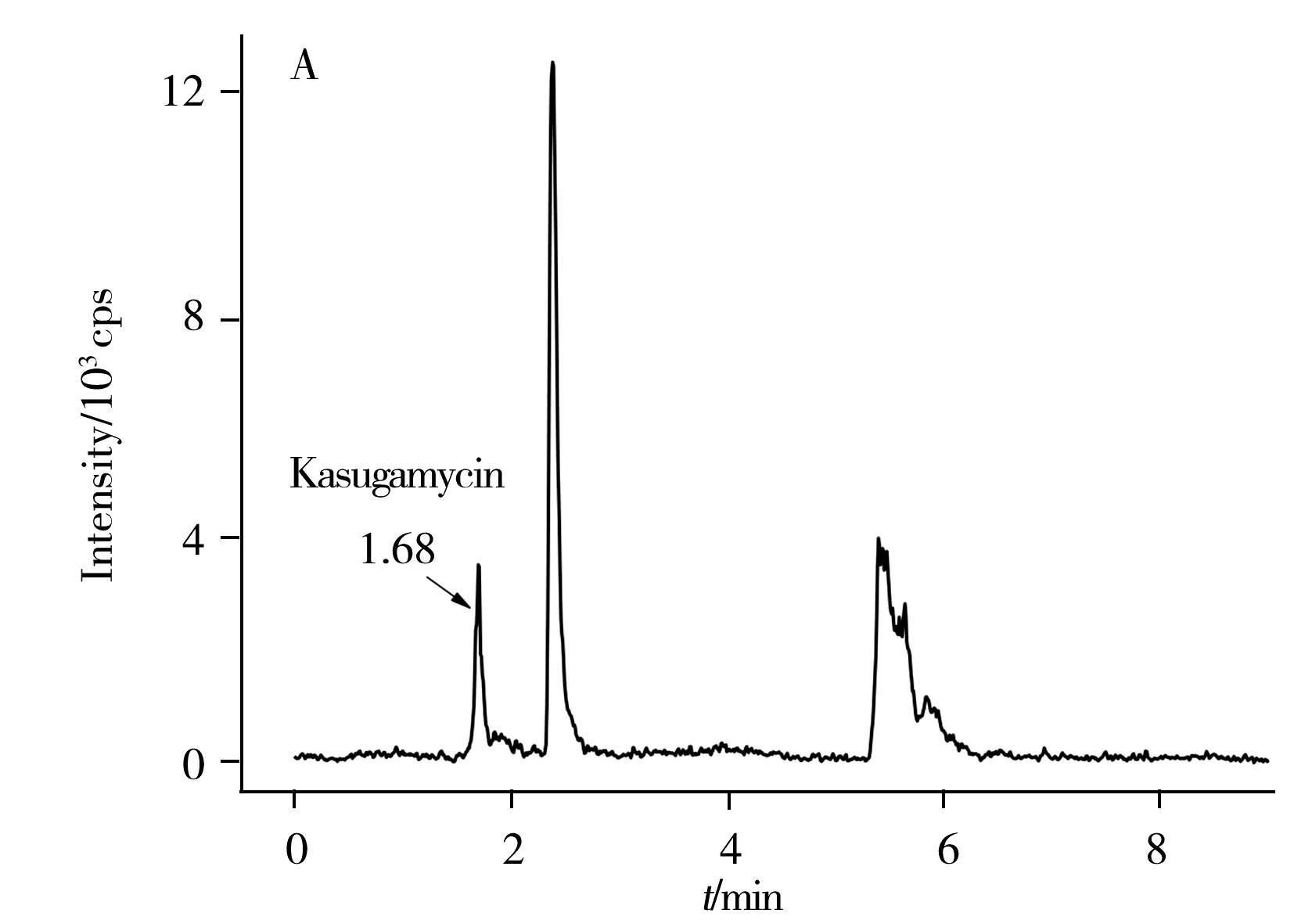
于2018~2019年在重庆市北碚区开展田间试验,供试药剂为8%春雷霉素·噻霉酮水分散粒剂,供试作物为温州蜜柑,分别按照400 mg a.i./kg(5倍推荐剂量)的有效剂量施药1次(末次施药后0、1、2、3、4、5、7、14、21、28 d采集田间样品),80 mg a.i./kg有效剂量施药2次,施药间隔期7 d(末次施药后21、28 d采集田间样品),使用本方法进行测定。根据测定结果得到:春雷霉素在温州蜜柑中的消解符合一级动力学方程,残留量随时间延长逐渐减小,降解方程为y=0.601 7e-0.052x(r2=0.748 1),y=0.401 7e-0.055x(r2=0.733 3),y=0.365 6e-0.049x(r2=0.634 0),半衰期T1/2=12.60~14.15 d;噻霉酮的消解不遵循一级动力学方程,呈上升下降连续波动趋势。由于只在单一品种和地区进行实验,数据仅供参考,后期仍需佐证。结果显示,全果中春雷霉素的消解残留量为0.096 1~0.752 8 mg/kg(图4A),噻霉酮为0.005 4~0.016 9 mg/kg(图4B)。全果和果肉中的最终残留量均为未检出。
3 结 论
本文建立了DSPE/UPLC-MS/MS同时测定柑橘中水溶性春雷霉素和脂溶性噻霉酮的分析方法。使用T3色谱柱得到了良好的峰形及分离度,通过分散固相萃取法净化,简化了步骤并保证了良好的回收率。该方法灵敏度高,方便快捷,精密度好,能满足柑橘水果中春雷霉素和噻霉酮残留的检测要求,可为制定春雷霉素和噻霉酮复配农药的安全使用规则和在柑橘上的产品登记提供技术支撑。

