绒山羊宰后成熟过程中羊肉品质和风味的变化分析
王柏辉,韩利伟,王德宝,杜 瑞,刘 畅,要 铎,任 军,靳 烨,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.鄂尔多斯市食品检验检测中心,内蒙古鄂尔多斯 017000;3.乌拉特中旗草原恒通食品有限公司,内蒙古巴彦淖尔 015300)
宰后成熟肉又称排酸肉、冷却肉,是目前市场上较常见的一种鲜肉,其通过过低温排酸降低了羊肉的膻味,进而改善了羊肉风味和营养品质。排酸是指动物被屠宰后,机体内部进行无氧呼吸,通过糖原降解产生大量乳酸。在排酸成熟过程中,肉能够充分完成解僵成熟,质地变得柔软有弹性,肉质鲜美,有利于人体消化吸收。排酸是改善羊肉生产品质和风味品质的重要工艺,排酸过程主要涉及细胞凋亡与内源性蛋白酶对结构蛋白的降解,对肉类风味前体物产生一定的影响[1-2]。因此,适宜的排酸时间除了能使羊肉具有较好的嫩度外,还能提高羊肉的风味品质。
二狼山白绒山羊是一种绒肉兼用的山羊品种,肉质细嫩,脂肪分布均匀,无臊味。国内外学者关于冷却成熟过程中肉品质和风味变化的研究较多。Cho等[3]研究表明随着冷却过程的延长,牛肉的红度值、持水能力和嫩度都增加。陈槟颖[4]研究表明不同冷却时间下呼伦贝尔羊肉的pH、蒸煮损失率、剪切力值具有显著差异。Bruce等[5]研究发现与未经宰后成熟的牛肉相比,宰后成熟的牛肉具备特殊的咸味或烧烤香味。目前,较多研究集中对宰后成熟过程中牛肉和绵羊肉品质的变化分析,而对成年绒山羊这方面研究较少,缺乏对绒山羊羊肉加工的科学指导依据。
本论文主要通过研究宰后成熟过程中绒山羊羊肉品质和风味品质的变化规律,获得绒山羊羊肉的最佳宰后成熟时间,旨在为内蒙古绒山羊羊肉加工行业的科学化与规范化生产提供理论参考。
1 材料与方法
1.1 材料与仪器
二狼山绒山羊 6只3岁健康无病的内蒙古乌拉特中旗放牧条件下饲养;硫酸(分析纯)、氢氧化钾(分析纯)、甲醇(色谱纯)、正己烷(色谱纯)、37种脂肪酸甲酯的混合标准品 美国Sigma公司。
Trace1300-ISQ气相色谱-质谱联用仪 美国赛默飞世尔科技公司;HH-4水浴锅 上海福玛实验设备有限公司;GRX-9053A型热空气干燥箱 上海一恒科技有限公司;TC-P2A全自动测色色差计 上海生物化学实验仪器公司;pH-STAR型胴体pH计 德国MATTHAUS公司;C-LM3B型数显式肌肉嫩度仪 秦皇岛市谢利科技开发有限公司;L-8800氨基酸全自动分析仪 日本日立公司。
1.2 试验方法
1.2.1 样品采集 屠宰后,胴体在排酸间(室内温度4 ℃,湿度40%,风速3 m/s)吊挂成熟4 d。分别测定成熟0、1、2、3、4 d的肉品质指标,并采集背最长肌样品贮存于冷库(-20 ℃),试验结束后,统一带回实验室用于营养物质和风味分析。
1.2.2 肉色的测定 使用TC-P2A全自动色差计测定肌肉色差,记录宰后成熟期间每天的色差变化。L*值表示肌肉的亮度;a*值表示肌肉的红度;b*表示肌肉的黄度值。
1.2.3 肉pH的测定 使用胴体直插式pH计直接测定肌肉的pH,记录宰后成熟期间每天的pH的变化。
1.2.4 剪切力的测定 取沿着肌纤维方向肉样,密封蒸煮(中心温度为75 ℃)45 min,冷却至室温,吸取表面水分后沿肌纤维方向切成3 cm×1 cm×1 cm的肉条,用嫩度仪测定其剪切力,记录宰后成熟期间的剪切力值(N)。
1.2.5 蒸煮损失率的测定 取背最长肌约 50 g肉样并记录其煮前质量(m1),然后75 ℃水浴煮制 45 min,晾至室温后,擦干表面水分,记录其煮后质量(m2)。按照下式计算蒸煮损失率:

1.2.6 脂肪酸的测定
1.2.6.1 脂肪酸提取 称取0.5 g均质的肌肉组织于15 mL的离心管中,加入0.7 mL 10 mol/L氢氧化钾和5.3 mL甲醇混合液,并在55 ℃下水浴1.5 h,且每10 min剧烈摇晃一次,水浴结束后,冷却至室温。然后再加0.58 mL 12 mol/L硫酸,混匀,并在55 ℃下水浴1.5 h,每15 min剧烈摇晃一次。然后再加入3 mL正己烷,1500 r/min离心5 min,吸取出1 mL正己烷层于进样瓶中,用0.22 μm有机滤膜过滤后,进行气相色谱分析。
1.2.6.2 色谱条件 气相色谱条件:色谱柱:反式色谱柱(100 m×0.25 mm,0.20 μm),载气为氦气,载气流速为1 mL/min;进样口温度:240 ℃,进样量为1 μL,分流比为100∶1。采用程序升温,初始温度为60 ℃,保持1 min,然后以20 ℃/min的速率升至120 ℃,保持1 min;然后以5 ℃/min的速率升至240 ℃,保持15 min。
质谱条件:离子源温度为300 ℃,传输线温度240 ℃,质量扫描范围50~500(m/z),溶剂延迟时间:4 min。
1.2.7 风味物质的测定
1.2.7.1 风味物质的提取 在20 mL样品瓶中加入5 g粉碎肉样,置于水浴锅中,将老化的萃取头插入样品瓶使石英纤维头暴露于样品上部空间,在60 ℃条件下吸附45 min后拔出,萃取头在气相色谱进样口(250 ℃)下解吸附3 min。
1.2.7.2 色谱条件 气相色谱条件:色谱柱:TR-5毛细色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气,载气流速为1 mL/min,传输线温度250 ℃,不分流进样,进样时间1 min。采用程序升温:初始温度为40 ℃,保持3 min,然后以4 ℃/min的速度升至150 ℃,保持1 min;再以5 ℃/min的速度升至200 ℃,最后以20 ℃/min升至230 ℃,保持5 min。
MS条件:离子源温度为250 ℃,进样口温度250 ℃,质量扫描范围30~400(m/z),溶剂延迟时间:1 min。
1.3 数据处理
羊肉中脂肪酸数据通过37种脂肪酸甲酯的混合标准品来定性,面积归一化法来定量;风味物质通过NIST数据库来定性,用峰面积来定量。试验数据用SPSS 19.0统计软件进行单因素方差分析,并用Origin Pro 8.5软件进行作图。
2 结果与分析
2.1 宰后成熟时间对绒山羊羊肉pH的影响
由图1可知,宰后成熟过程中羊肉pH的变化规律呈现先降低后趋于平衡的过程。成熟前(0 d)羊肉pH显著高于宰后成熟后(P<0.05),且宰后成熟第2 d羊肉pH达到最低点。这可能是因为宰后动物肌肉主要通过糖酵解利用糖原来维持能量代谢,其终产物为乳酸,随着成熟时间的增加,肌肉中乳酸沉积也会增加[6]。随着僵直的解除,pH在5.8~6.0时趋于平稳,此时肌肉完成了整个成熟过程[6-7]。本研究宰后成熟过程中pH变化与陈槟颖[4]的研究结果不一致,分析其原因可能是品种和月龄导致宰后成熟的进度不同。

图1 宰后成熟时间对绒山羊羊肉pH的影响(n=6)
2.2 宰后成熟时间对绒山羊羊肉色差的影响
由表1可知,在宰后成熟过程羊肉的亮度值基本保持不变(P>0.05),红度值呈现逐渐增加趋势(P<0.05)。分析其原因主要是肌肉中水的位置逐渐被氧气替代,肌红蛋白与氧气结合形成氧合肌红蛋白,呈现出鲜红的颜色[8]。同时发现,宰后成熟前羊肉的黄度值显著低于宰后成熟后(P<0.05)。黄度值高的原因可能是由于肌红蛋白和氧合肌红蛋白含量在宰后初期相对较高,氧合肌红蛋白与肌红蛋白的比值较高,高的比值就会有高的黄度值[9]。
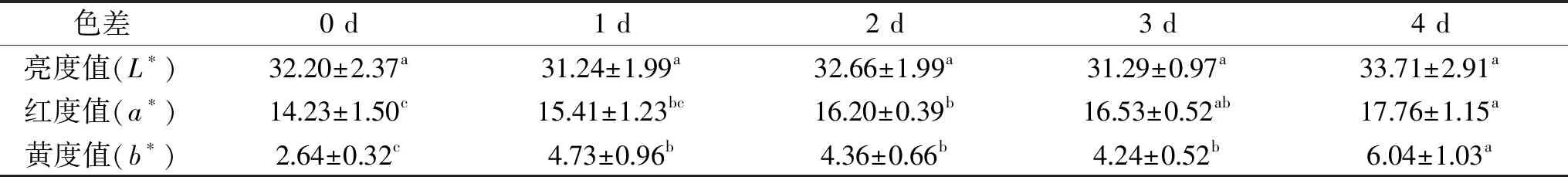
表1 宰后成熟时间对绒山羊羊肉色泽的影响(n=6)
2.3 宰后成熟时间对绒山羊羊肉嫩度和蒸煮损失率的影响
由图2可知,宰后成熟过程中羊肉蒸煮损失率呈现先升高再降低再升高,逐渐趋于平衡,这与Mungure[10]对牛肉宰后成熟过程中蒸煮损失的变化趋势一致。第1 d羊肉的蒸煮损失率显著高于第2 d(P<0.05),且宰后成熟过程中第1 d蒸煮损失率最大,第2 d羊肉的蒸煮损失率最小,猜测其原因可能与成熟过程中肉的保水性能的变化密切相关。
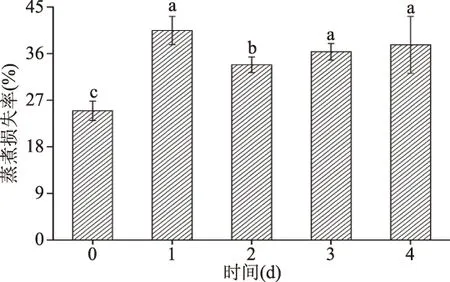
图2 宰后成熟时间对绒山羊羊肉蒸煮损失率的影响(n=6)
肉的嫩度是由结缔组织的数量、溶解性和成熟过程中肌节缩短和肌纤维蛋白的水解程度等不同因素作用的结果[11]。肉的嫩度由剪切力值来表示,剪切力值越小,肉越嫩;反之亦然。由图3可知,宰后成熟过程中羊肉的剪切力值呈现先增加后降低的趋势,第2 d羊肉的剪切力值显著高于第3 d(P<0.05),且成熟第3 d的剪切力值最小,嫩度最好,这与Karami等[12]的研究结果类似。Kannan等[13]指出山羊肉的最大嫩化发生在宰后成熟第4 d,但即使在成熟8 d后,由于肌纤维自身结构的降解,肌原纤维小片化程度也在逐渐增加。
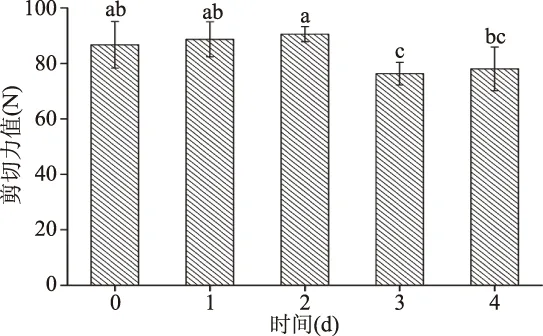
图3 宰后成熟时间对绒山羊羊肉嫩度的影响(n=6)
2.5 宰后成熟时间对绒山羊羊肉中脂肪酸的影响
由表2所知,绒山羊肉中脂肪酸主要以棕榈酸、硬脂酸和油酸为主,约占总脂肪酸的60%~78%。在宰后成熟过程中,MUFA和PUFA的相对含量变化呈现相同的规律。同时发现,成熟1 d后羊肉中SFA、MUFA和PUFA的相对含量显著高于成熟前(P<0.05),这与王旭东的研究结果一致[14]。

表2 宰后成熟时间对宰后绒山羊羊肉中脂肪酸的影响(n=6,%)
宰后成熟过程中绒山羊肉中饱和脂肪酸主要以棕榈酸和硬脂酸为主。随着宰后成熟时间的延长,棕榈酸的相对含量呈现先升高后降低的趋势(P<0.05),成熟第2 d含量最低;在成熟0 d至3 d间,硬脂酸的相对含量呈现逐渐增加(P<0.05),这与牛珺等[15]的研究结果一致。宰后成熟第1 d开始,油酸的相对含量逐渐降低,且差异显著(P<0.05)。
PUFA是羊肉风味形成的重要前体物质,成熟过程中PUFA的氧化有利于提高绒山羊肉风味品质[16]。亚油酸和花生四烯酸是醛类和酮类形成的重要风味前体物。宰后成熟过程(1~3 d)中亚油酸的比例逐渐增加,而花生四烯酸的比例逐渐降低,且发现成熟第1 d其比例要高于成熟前0 d(P<0.05)。α-亚麻酸和共轭亚油酸是功能性长链脂肪酸,具有抗肿瘤、抗衰老和抗动脉粥样硬化等重要的生理功能[17]。在宰后成熟过程中,其比例变化不大(P>0.05),在成熟第3 d其相对含量达到最大。另外,在宰后成熟过程中,n-6/n-3比例接近欧美等国家推荐的4∶1,营养专家认为合理的 n-6/n-3 比例有利于降低血压、抑制不规律心脏跳动、维持能量平衡和糖代谢,抑制其他慢性疾病的发生以及促进正常的生长发育[18]。
2.6 宰后成熟时间对宰后绒山羊羊肉中风味物质的影响
羊肉中风味物质是前体物(如脂肪酸、氨基酸等)经过一系列变化(脂肪酸氧化、Maillard反应和Strecker降解反应),产生的多种化合物共同作用组成的[19-20]。由脂肪酸氧化与Strecker降解产生的化合物主要包括醛类、醇类、酮类和烃类化合物,而由 Maillard反应所产生的化合物主要包括含硫、含氮及杂环化合物[5]。由表4可知,在宰后成熟过程中,绒山羊背最长肌中共检测到23 种挥发性风味物质,主要包括醛类、醇类和酮类等化合物。
绒山羊肉中检出醛类化合物共有7种(表4)。决定羊肉风味浓郁的因素包括香气物质的阈值和含量,本研究中检出的醛类物质阈值较低,同时发现绒山羊肉中己醛、壬醛、庚醛和辛醛的含量较高,是绒山羊羊肉中主要的挥发性风味化合物。己醛有青草味和刺激的辛辣味,而庚醛、辛醛具有油脂氧化味[21-22]。壬醛具有柑橘、玫瑰等香气,油脂气味浓厚,可赋予羊肉浓郁的肉香味[23]。成熟1 d后羊肉中己醛和壬醛的含量显著高于成熟前0 d和成熟2~4 d(P<0.05),这与王恒鹏等[24]的研究结果一致。宰后成熟过程中己醛含量增加的原因主要是由于肌肉中亚油酸和花生四烯酸的氧化所产生,而辛醛、壬醛的含量高也可能与绒山羊羊肉中油酸含量高有关,油酸的氧化可产生辛醛、壬醛等[25-26]。

表4 宰后成熟时间对宰后绒山羊羊肉中挥发性风味物质的影响(n=6,106 AU/g)
醇类物质主要由脂肪氧化产生,其阈值较高,对肉品风味贡献度较低,对风味起协同作用[27]。由表4可知,绒山羊肉中检出9种醇类,辛醇、戊醇和1-辛烯-3-醇的含量较高,这与罗玉龙等[16]对绵羊羊肉中风味物质的测定结果类似。同时,也有研究发现戊醇具有油脂气味,而辛醇具有柑橘、玫瑰气味[28]。本研究中成熟1 d后戊醇和辛醇的含量显著大于成熟前0 d(P<0.05)。1-辛烯-3-醇是花生四烯酸经脂肪氧化酶作用形成的,具有蘑菇香味,对羊肉风味的贡献度较高[29-30]。在宰后成熟过程中1-辛烯-3-醇的含量呈现先增加后降低的趋势,且发现成熟1 d其含量显著大于0 d。另外,在宰后成熟过程中,苯甲醇的含量呈现先增加后降低的趋势,且第3 d达到最大。
酮类物质是脂质氧化的重要产物,也是绒山羊肉风味形成的重要组成。本研究中共检测到两种酮类,分别为2,3-辛二酮和环己酮。同时发现,成熟1 d后羊肉中2,3-辛二酮的含量要高于成熟2、3和4 d,而环己酮的含量要低于成熟2 d和成熟3 d。酯类物质也是重要的风味物质,其主要因游离脂肪酸与脂肪氧化产生的醇酯化反应形成,短链脂肪酸酯化产生的酯具有果香味,而长链脂肪酸酯化生成酯呈油脂味[31]。另外,本研究中绒山羊肉中油酸甲酯的含量随宰后成熟时间的增加而降低。
3 结论
宰后成熟过程中绒山羊羊肉的pH呈现先降低后升高,羊肉的剪切力值呈现先升高后降低的趋势,且pH和嫩度值在第3 d后趋于稳定。随着宰后成熟时间的延长,羊肉色泽越亮越鲜红,且持水能力越强。宰后成熟3 d,绒山羊羊肉中有益脂肪酸(亚麻酸和共轭亚油酸)的相对含量最大,且发现特征性挥发性风味物质主要包括了己醛、壬醛、戊醇、辛醇和1-辛烯-3-醇。综上所述,对于3岁绒山羊羊肉来说,宰后成熟3 d是其最佳成熟时间,此时对绒山羊羊肉进行产品的加工,更有利于保持羊肉的品质和风味。

