不同处理对新疆羊半腱肌嫩度的影响
张文++李芳++达迪拉·买买提++俞琴++王琳++张煜++孔令明
摘 要:目的:寻求一种成本低、安全健康、嫩化效果好的嫩化方法。方法:以剪切力、pH值、蒸煮损失、肌原纤维小片化指数(myofibrillar fraglllentation index,MFI)、胶原蛋白含量及其溶解度、羊半腱肌全骨架蛋白降解情况等为评价指标,研究腌制结合滚揉、真空滚揉及腌制结合真空滚揉对羊肉嫩度的影响。结果表明:3 种处理对羊肉的剪切力、pH值、蒸煮损失、肌原纤维小片化指数均影响显著。结论:采用真空滚揉对羊肉嫩化效果最佳。
关键词:腌制;真空;滚揉;羊肉;嫩度
羊肉味甘、性温,能补血益气,温中暖肾,含有丰富的蛋白质、脂肪、磷、铁、钙、VB1、VB2和烟酸、胆甾醇等成分[1]。羊肉的食用品质是指新鲜羊肉经加工处理之后,其制品的色泽和质构、嫩度以及营养成分等物化性质的总体映射[2]。其中嫩度是消费者评价羊肉食用品质的重要指标之一[3],而24 月龄以上的羊肉嫩度较差,其中后腿部半腱肌嫩度明显低于其他部位肌肉,需要对其采取嫩化处理,改善其食用品质。
目前肉品的物理嫩化方法包括自然熟化、机械嫩化、超声波、超高压和电刺激[4];化学嫩化方法主要是使用化学试剂达到嫩化的目的,这些化学试剂主要有多聚磷酸盐、碳酸盐及钙盐[5-8];生物学嫩化法则是通过添加蛋白酶的方法达到嫩化的效果,主要有木瓜蛋白酶嫩化法、菠萝蛋白酶嫩化法、中华猕猴桃蛋白酶嫩化法、无花果蛋白酶嫩化法、生姜蛋白酶嫩化法、真菌蛋白酶嫩化法等[9-17]。生物嫩化成本较高,化学嫩化法很难消除消费者对添加剂的担忧,因此,选择一种成本低、安全健康的嫩化方法尤为重要。
本实验采用NaCl腌制结合滚揉、真空滚揉、NaCl腌制结合真空滚揉3 种方法对羊肉半腱肌进行嫩化,研究了不同处理后羊肉的剪切力、pH值、蒸煮损失、肌原纤维小片化指数(myofibrillar fraglllentation index,MFI)、胶原蛋白、十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)的变化,选取一种嫩化效果好、成本低、安全健康的处理方法,为羊肉产业中羊肉的处理及销售提供理论依据和技术保障,为羊肉嫩化方法的进一步研究提供理论参考。
1 材料与方法
1.1 材料
3~4 年龄新疆细毛羊(后腿部半腱肌) 新疆乌鲁木齐市沙依巴克区和田一街新朱兰清牛羊肉配送中心。
1.2 仪器与设备
便携式数显pH计 德图仪表(深圳)有限公司;电热恒温水浴锅 北京市永光明医疗仪器有限公司;
TA-XT2i型物性仪 英国Stable Micro System公司;
Tu-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;GR-20真空滚揉机 诸城市美邦机械有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;
DHG-9140A电热鼓风干燥箱 上海一恒科学仪器有限公司;DZ-260P台式真空包装机 上海青葩食品包装机械有限公司;FSH-2型可调高速匀浆机 金坛市城东新瑞仪器厂。
1.3 方法
1.3.1 原料预处理
将羊半腱肌从后腿分出,去除表面可见脂肪及结缔组织,分割成质量约(100±5)g的2.5 cm×5.0 cm×5.0 cm 大小的肉块若干,混合,随机取出4 组,每组6 块,分别称质量。第1组为空白组,直接真空包装;第2组在常压下,2% NaCl腌制液中滚揉1 h,取出后用滤纸吸取表面水分,真空包装;第3组在0.07 MPa真空度条件下,滚揉1 h,取出后用滤纸吸取表面水分,真空包装;第4组在0.07 MPa真空度、2 g/100 mL NaCl腌制液中滚揉1 h,取出后用滤纸吸取表面水分,真空包装。以上肉样与腌制液之比为1∶5(m/V),
真空滚揉转动速率11 r/min、温度0~4 ℃、每滚揉10 min间歇5 min的条件下真空滚揉腌制。将4 组样品放入0~4 ℃冰箱内,1 d后测各项指标。
1.3.2 指标测定
1.3.2.1 羊肉的剪切力
用自封袋装样品,80 ℃水浴加热至中心温度为70 ℃,30 min后取出冷却至室温,取样。使用TA-XT2i物性测试仪测定剪切力,用Texture Expert V1.0软件加以控制。剪切力测定参数:探头型号HDP/BSW;测试模式TPA;测试前速率:2.00 mm/s;测试中速率:2.00 mm/s;
测试后速率:10.00 mm/s;下压距离30.00 mm;负载类型Auto-20 g;数据获得率500 pps;样品规格10 cm×1 cm×1 cm。每个样品测定3 次,取平均值。
1.3.2.2 pH值的测定
用便携式数显pH计测量,每个样品选取3 个测量点,取平均值。
1.3.2.3 蒸煮损失
称取羊肉60 g,去除表面可见结缔组织和脂肪,自封袋包装,80 ℃水浴加热,待中心温度达70℃时,取出并冷却至室温,用滤纸去除表面水分,称质量。蒸煮损失计算按下式计算:
1.3.2.4 肌原纤维小片化指数(myofibrillar fraglllentation index,MFI)
MFI的测定参考Culler等[18]的方法,稍作修改。取1 g的羊肉(去除肉眼可见的结缔组织和脂肪),加入10 mL MFI缓冲液(100 mmo1/L KCl、11.2 mmo1/L K2HPO4、8.8 mmo1/L KH2PO4、l mmol/L乙二醇-双-(2-氨基乙醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、l mmol/L MgCl2、l mmol/L NaN3),匀浆,3 500 r/min离心20 min,弃去上清液。再加入10 mL缓冲液,混匀,3 500 r/min离心20 min,弃去上清液。加入7.5 mL的缓冲液,混匀,用20 目铜制筛网过滤。滤液的蛋白质含量参照Gornall等[19]双缩脲法测定。然后用MFI缓冲溶液将滤液蛋白质量浓度调为0.125 mg/mL,并于540 nm波长处测吸光度,所得吸光
度×200即为MFI值。
1.3.2.5 胶原蛋白含量及溶解度
用Ringers试剂溶解法分离总胶原蛋白与不溶性胶原蛋白,参考Hill[20]和Bergman[21]等的方法,并略加修改。
1.3.2.6 SDS-PAGE
参照Jin Han等[22]的方法。
1.4 数据处理
采用Minitab 16.0对实验数据进行统计分析,用Excel 2003做图,剪切力等采用Stable Micro System所带的Exponent处理分析。
2 结果与分析
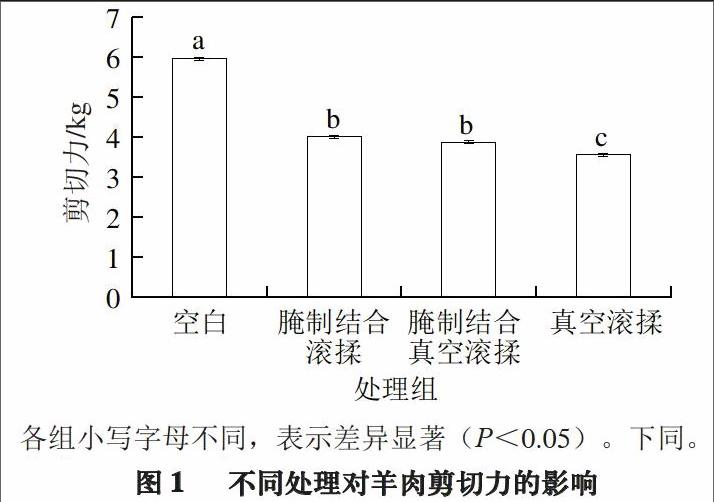
2.1 不同处理对羊半腱肌剪切力的影响
剪切力是表现羊肉嫩度最直接的方法,剪切力越小,羊肉越嫩[23]。不同处理对羊肉半腱肌剪切力的影响如图1所示。
各组小写字母不同,表示差异显著(P<0.05)。下同。
由图1可知,各处理组的剪切力综合表现为:空白组(5.96 kg)>腌制结合滚揉处理组(4.00 kg)>腌制结合真空滚揉处理组(3.87 kg)>真空滚揉处理组(3.56 kg)。可见3 种处理对羊肉半腱肌的嫩度均有所改善,真空滚揉的效果最优,腌制结合真空滚揉的效果次之,腌制结合滚揉的效果最差。腌制结合滚揉处理组与真空滚揉处理组均与腌制结合真空滚揉处理组差异显著(P<0.05)。可能是因为真空使滚揉机内产生负压,使肌纤维细胞壁破裂[24],从而导致肌肉的机械强度变弱,剪切力变小,加之腌制液的存在很可能影响真空发挥其负压的作用,液体对细胞产生一个外力,减弱了真空度的作用,所以,真空滚揉处理组的剪切力小于腌制结合真空滚揉处理组。
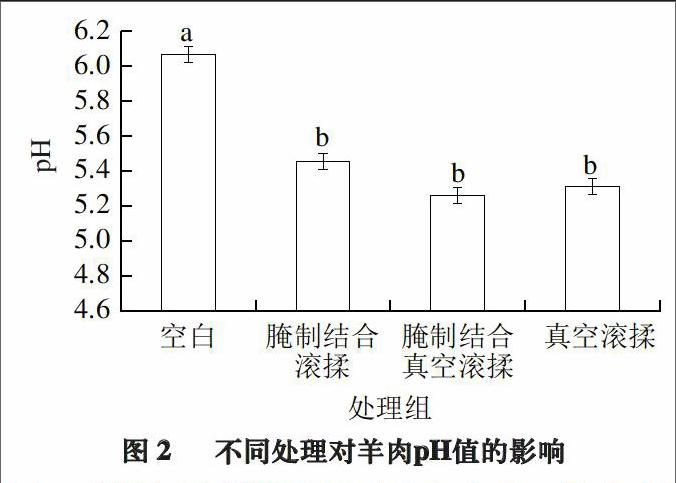
2.2 不同处理对羊半腱肌pH值的影响
宰后动物肌肉内因发生糖酵解作用而积累乳酸,使pH值下降,而其下降的速率及大小对肉的色泽、保水性、蛋白质的溶解度及细菌的产生与繁殖等都有影响[25]。肉的保水性和蛋白质的溶解度都与嫩度关系密切,所以pH值的下降程度及速率也能反应肉嫩度的变化。不同处理对羊半腱肌的影响如图2所示。
由图2可知,与空白组(pH 6.07)相比,3 种嫩化处理均使羊半腱肌的pH值下降显著(P<0.05),但3 种嫩化处理间差异不显著(P>0.05)。3 种处理间pH值下降程度的差异可能是因为:糖酵解途径是在缺氧条件下进行的,而3 种处理过程中样品与氧气接触的可能性大小为:腌制结合真空滚揉<真空滚揉<腌制结合滚揉<空白组,这与各处理间pH值大小顺序相吻合,腌制结合真空滚揉处理组(pH 5.26)<真空滚揉(pH 5.31)<腌制结合滚揉(pH 5.46)<空白组(pH 6.07)。
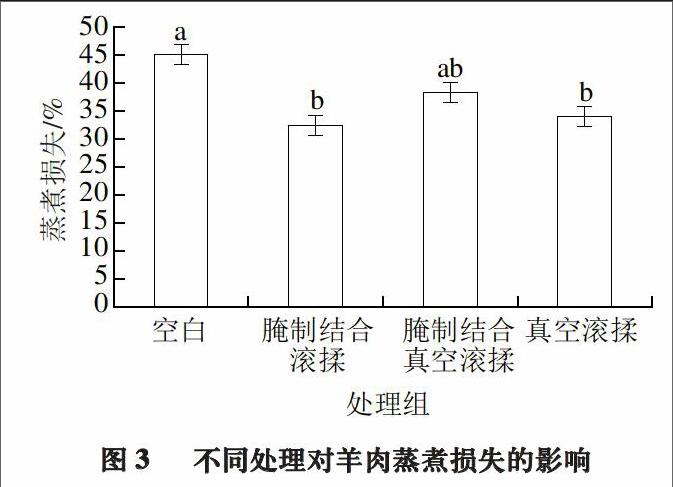
2.3 不同处理对羊半腱肌蒸煮损失的影响
蒸煮损失指宰后动物肌肉经蒸煮处理所失去的液体量,包括蛋白质、水分、游离氨基酸等物质[26]。蒸煮损失是反映肉品加工品质的重要因素,反映肉的持水性,与嫩度息息相关。不同处理对羊半腱肌蒸煮损失的影响如图3所示。
由图3可知,腌制结合滚揉(32.5%)<真空滚揉(34.1%)<腌制结合真空滚揉(38.4%)<空白组(45.1%)。3 种嫩化处理均显著降低了羊半腱肌的蒸煮损失,而3 种处理之间差异不显著(P>0.05)。真空处理组比非真空处理组蒸煮损失大,可能是因为真空所产生的负压导致肌肉细胞的破裂[25],增加了肌浆蛋白及其他内含物质的外流,蒸煮损失变大。
2.4 不同处理对羊半腱肌MFI值的影响
MFI是指1~4 个肌节长度的肌原纤维占总肌原纤维片断数的比例[27]。Culler等[18]报道,MFI对肉的嫩度指标的贡献率超过50%,并认为MFI可作为衡量肉品嫩度的方法,并根据实际情况进行分级:MFI≥60时,肉非常嫩;MFI在50左右时,肉嫩度适中;MFI远小于50时,肉则缺乏嫩度。不同处理对羊半腱肌MFI值的影响如图4所示。
由图4可知,空白组(44.3)<腌制结合滚揉处理组(57.8)<真空滚揉处理组(70.15)<腌制结合真空滚揉处理组(72.25)。3 种嫩化处理均能显著提高羊半腱肌的嫩度,真空滚揉与腌制结合真空滚揉两处理组之间差异不显著(P>0.05),但均与腌制结合滚揉处理组显著差异(P<0.05)。这可能是因为真空所产生的负压使肌肉的细胞壁破裂,大大增加了肌原纤维断裂的概率,使MFI增大。
2.5 不同处理对羊半腱肌胶原蛋白含量的影响
肉的嫩度和胶原蛋白含量密切相关,肉中结缔组织主要是由胶原蛋白构成的,胶原蛋白之间交联程度的大小是影响胶原纤维溶解性的主要因素,肌肉中不溶性胶原蛋白含量与肉的嫩度成反比。肉的嫩度与胶原蛋白的溶解性密切相关[28]。
由图5~6可知,3 种处理差异显著(P<0.05),腌制结合真空滚揉处理组总胶原蛋白含量及不溶性胶原蛋白含量均最低,羊肉嫩度最好。真空处理组的可溶性胶原蛋白含量比腌制结合滚揉处理组的多,可能是因为滚揉机内被抽成真空,处于负压状态,此时肌肉的细胞壁容易破裂,从而使肌浆蛋白外流,可溶性胶原蛋白增加。
2.6 不同处理对羊半腱肌全骨架蛋白的影响
骨架蛋白的降解,会使肌原纤维发生物理化学等一系列的本质变化,从而使肌原纤维小片化加剧,细胞结构完整性受损,最终使肉的嫩度提高[29-30]。出现28 kD和32 kD多肽片段是蛋白质发生水解的标志,是提高肉的嫩度的重要因素[31]。不同处理对羊半腱肌全骨架蛋白的影响如图7所示。
Marker. 标准蛋白;1. 空白组;2. 腌制结合滚揉;
3. 真空滚揉;4. 腌制结合真空滚揉。
由图7可知,空白组未出现28 kD和32 kD多肽片段,其他3 组均有出现,其中腌制结合真空滚揉处理组颜色最深,说明该组中28 kD和32 kD多肽片段最多,而真空滚揉处理组25 kD以下的多肽片段多于其他2 组,可能是由于真空产生的负压,使肌肉细胞壁破裂,肌浆蛋白外流,加剧了蛋白的水解。腌制结合真空滚揉处理组中由于腌制液的影响,负压作用小于真空滚揉处理组,因此25 kD以下的多肽片段较少。
3 结 论
3 种嫩化处理对羊半腱肌剪切力的影响显著,其中真空滚揉处理组剪切力最小,与空白组差异极显著;3 种嫩化处理对羊半腱肌的pH值的影响显著,腌制结合真空滚揉处理组的pH值降幅最大,但与其他两组差异不显著;3 种嫩化处理对羊半腱肌的蒸煮损失影响显著,腌制结合滚揉处理组的蒸煮损失最小,与其他两组差异不显著;3 种嫩化处理对羊半腱肌MFI影响显著,其中真空结合腌制滚揉MFI值最大,肉最嫩;3 种处理对羊肉半腱肌的胶原蛋白含量的影响显著,其中腌制结合真空滚揉处理组表现最优;3 种处理对羊肉骨架蛋白的影响显著,其中真空滚揉和腌制结合真空滚揉处理组表现优异。综上所述,3 种处理均能有效嫩化羊半腱肌,其中腌制结合真空滚揉与真空滚揉两处理组的差异不显著,但它们的嫩化程度明显优于腌制结合滚揉处理组。因此,实际生产中应选取真空滚揉嫩化处理,达到同等嫩化程度的同时大大减少生产成本。
参考文献:
[1]巴吐尔·阿不力克木, 帕提姑·阿布都克热, 肉孜阿吉, 等. 巴什拜羊肉不同部位的品质特性分析[J]. 新疆农业科学, 2012(9): 1734-1741.
[2]蒋小锋, 李芳, 任雯雯, 等. 木瓜蛋白酶结合滚揉处理对马肉嫩度的影响[J]. 食品与发酵工业, 2014(12): 230-234.
[3]LAWRIE R A. 肉品科学[M]. 北京: 中国农业大学出版社, 2009: 190.
[4]宋翠英, 翁航萍, 王盼盼. 肉类嫩化的理论、方法及前景[J]. 肉类研究, 2008, 22(2): 19-22.
[5]LYNG J G, ALLEN P, MCKENNA B M. The effect on aspects of beef tenderness of pre-and post-rigor exposure to a high intensity ultrasound probe[J]. Science of Food Agriculture, 1998, 78: 308-314. DOI:10.1002/(SICI)1097-0010(199811)78:3<308::AID-JSFA123>3.0.CO;2-F.
[6]陈阳楼, 朱学申, 杨姗姗, 等. 影响肉类嫩度的因素及其嫩化方法[J]. 肉类工业, 2012, 376(8): 48-50.
[7]罗欣, 黄明, 朱燕. 电刺激技术在牛肉快速成熟中的应用研究[J]. 农业工程学报, 2001(6): 127-131.
[8]刘鹭, 李洪军. 肉类嫩化方法及技术研究进展[J]. 肉类工业, 2001(11): 40-42.
[9]金惠玉, 张筠, 王欢欢. 木瓜蛋白酶对牛肉干嫩化的影响[J]. 中国调味品, 2013(8): 26-29.
[10]郑贤孟, 杨文鸽, 徐大伦. 木瓜蛋白酶嫩化秘鲁鱿鱼肉工艺条件的研究[J]. 食品工业科技, 2013, 34(16): 203-206.
[11]黄业传, 李洪军, 李凤. 菠萝汁对牛肉的嫩化效果[J]. 食品科学, 2009, 30(10): 65-68.
[12]王海丽, 金清, 杨震, 等. 软枣猕猴桃粗蛋白酶的提取研究[J]. 食品科技, 2013(4): 277-280.
[13]HAN J, MORTON J D, BEKHIT A E D, et al. Pre-rigor infusion with kiwifruit juice improves lamb tenderness[J]. Meat Science, 2009, 82(3): 324-330. DOI:10.1016/j.meatsci.2009.02.003.
[14]BEKHIT A E D, HAN J, MORTON J, et al. Effect of kiwifruit juice and water pre-rigor infusion on lamb quality[C]//Proceedings of the 53rd International Conference of Meat Science and Technology, Beijing: China General Chamber of Commerce, 2007, 377-378.
[15]李雨林, 周海英, 申琳, 等. 无花果蛋白酶与木瓜蛋白酶对牛肉嫩化的研究[J]. 肉类工业, 2006(11): 31-33.
[16]孙国梁, 孔凡, 刘涛, 等. 生姜蛋白酶嫩化牛肉效果的研究[J]. 食品工业科技, 2008, 29(3): 244-246.
[17]ASHIE I N A, SORENSEN T L, NIELSEN P M. Effects of papain and a microbial enzyme on meat proteins and beef tenderness[J]. Food Science, 2002, 67: 2138-2142.
[18]CULLER R D, PARRISH F C, SMISH G C. Relationship of myofibril fragmentation index to certain chemical, physical and sensory characteristics of bovine longissimus muscle[J]. Food Science, 1985, 50: 1370. DOI:10.1111/j.1365-2621.1978.tb15263.x.
[19]GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. Journal of Biological Chemistry, 1949, 177: 751-766.
[20]HILL F. The solubility of intramuscular collagen in meat animals of various ages[J].Journal of Food Science, 1966, 31(2): 161-166. DOI:10.1111/j.1365-2621.1966.tb00472.x.
[21]BERGMAN I, LOXLEY R. Two improved and simplified methods for spectrophotometric determination of hydroxyproline[J]. Analytical Chemistry, 1963, 35: 1961-1965. DOI: 10.1021/ac60205a053.
[22]JIN Han. The effect of pre-rigor infusion of lamb with kiwifruit juice on meat quality[D]. Lincoln University, 2008: 41-43.
[23]蒋小锋, 李芳, 达迪拉·买买提, 等. 木瓜蛋白酶结合滚揉处理对马肉食用品质的影响[J]. 中国食品添加剂, 2015(6): 161-166.
[24]张素君. 关于加工工艺对油炸鸡肉产品质量的影响研究[D]. 青岛: 中国海洋大学, 2008.
[25]周光宏. 肉品加工学[M]. 北京: 中国农业出版社, 2008: 76-77.
[26]宋玉. 不同品种鸡肉成熟过程中品质特性比较研究[D]. 南京: 南京农业大学, 2011.
[27]TAKAHASHI K, FUKAZAWA T, YASUI T, et al. Formation of myofbrillar fragments and reversible contraction of sarcomeres in chicken pectoral muscle[J]. Food Science, 1967, 32: 409-412. DOI: 10.1111/j.1365-2621.1967.tb09697.x.
[28]常海军, 王强, 徐幸莲, 等. 肌内胶原蛋白与肉品质关系研究进展[J]. 食品科学, 2011, 32(1): 286-290.
[29]HUFF-LONERGAN E, PARRISH F C, ROBSON R M. Effects of postmortem aging time, animal age, and sex on degradation of titin and nebulin in bovine longissimus muscle[J]. Animal Science, 1995, 73: 1064-1073.
[30]TAYLOR R G, GEESINK G H, THOMPSON V F, et al. Is Z-disk degradation responsible for postmortem tenderization[J]. Animal Science, 1995, 73: 1351-1367.
[31]McBRIDE M A, PARRISH J F. The 30 000-dalton component of tender bovine longissimus muscle[J]. Food Science, 1977, 42: 1627-1629.

