青藏高原有机牦牛背最长肌肌肉的差异蛋白质组学
贾建磊++张勤文++张红见++李莉++丁欣++李红征++赵静
摘 要:以青藏高原有机牦牛为研究对象,采用超声波破碎法提取生鲜和冷藏有机牦牛背最长肌肌肉蛋白, Bradford法进行蛋白质定量后,进行双向电泳,通过PD Quest凝胶图像分析软件筛选3 倍或3 倍以上的差异斑点进行基质辅助激光解析串联飞行时间质谱(matrix-assisted laser desorption/ionization time of flight to time of fight,MALDI-TOF-TOF),并用Mascot软件鉴定差异蛋白,以建立青藏高原有机牦牛生鲜肉和冷藏肉背最长肌差异蛋白质组学研究方法。结果表明:经双向电泳图谱分析所获得的青藏高原有机牦牛生鲜肉和冷鲜肉背最长肌肌肉蛋白斑点数分别为1 840±181和2 034±86,分布于pH 3.0~10.0之间,PD Quest软件筛选青藏高原有机牦牛生鲜肉和冷藏肉背最长肌差异3 倍或3 倍以上蛋白质斑点36 个,其中生鲜肉相比冷藏肉有机牦牛背最长肌肌肉蛋白上调的有12 个点,下调的有24 个点,质谱鉴定有意义的差异蛋白质点7 个(蛋白质得分>65)(P<0.05),其中2 种蛋白质表达量上调,5 种蛋白质表达量下调。
关键词:有机牦牛;背最长肌;冷藏肉;生鲜肉;蛋白质组学
肉类产品食用品质的大幅下降引发了人们对现代肉品品质及其评价标准的深入思考,寻找一种科学的肉品品质评价方法并对其品质进行控制已成为国内外研究的热点。肉品品质的形成机理与肉质性状高度相关,而几乎所有的肉质性状都受到复杂的基因和蛋白质调控。已有的研究主要集中在对猪肉等肉质进行感官、理化特性和组织学特性的评价,尚未见到应用差异蛋白质组学方法对青藏高原有机牦牛宰后生鲜肉及冷藏肉品质的形成机理、评价和控制进行研究的报道。
本研究以同一饲养环境和屠宰条件,宰后以不同贮藏温度(4、18 ℃)、不同贮藏时间(0、24 h)的生鲜和冷藏有机牦牛肉作为研究对象,以差异蛋白质组学技术为研究平台,筛选与分析生鲜和冷藏的有机牦牛背最长肌肌肉的差异蛋白质,为进一步探讨有机牦牛肌肉加工过程蛋白质的降解规律提供参考。
1 材料与方法
1.1 材料与试剂
青藏高原有机牦牛背最长肌肌肉组织取自青海省河南县有机牦牛背最长肌(第七根胸椎到最后一根胸椎),保存备用。
2D裂解液、蛋白质定量试剂盒、IPG缓冲液 美国Bio-Rad公司;尿素、硫脲、3-[(3-胆酰胺丙基)-二乙胺]-1-丙磺酸(3-(3-cholamidopropyl)dimethylammoniopropanesulfonic acid,CHAPS)、二硫苏糖醇(dithiothreitol,DTT)、Tris-HCl、甘油、碘乙酰胺、丙烯酰胺、甲叉丙烯酰胺、甘氨酸 美国Sigma公司;
其余试剂为国产分析纯。
1.2 仪器与设备
双向凝胶电泳系统、固相pH梯度(immobilized pH gradient,IPG)干胶条、Image Master 2D Platinum凝胶成像系统 美国GE公司;PD Quest软件 美国
Bio-Rad公司;5800基质辅助激光解析串联飞行时间质谱仪(matrix-assisted laser desorption/ionization time of flight to time of fight,MALDI-TOF-TOF) 美国AB SCIEX公司。
1.3 方法
1.3.1 样品制备
生鲜(宰后18 ℃、0 h)和冷藏(宰后4 ℃、24 h)有机牦牛背最长肌肌肉样品每份取约0.5 g,加入1 mL 2D裂解液,匀浆(4 m/s、匀浆15 s、停顿2 min),匀浆间隙放于冰上冷却,重复操作3 次[1]。再对匀浆液进行冰浴超声破碎(100 W、超声10 s、间歇15 s),重复操作10 次,13 400 r/min条件下离心15 min,取上清液。
1.3.2 蛋白质定量
采用Bradford法进行蛋白质定量,于-80 ℃保存备用。
1.3.3 双向电泳
取总蛋白提取物100 μg,上样量为450 μL,pH 3~10非线性IPG胶条17 cm进行等电聚焦电泳,条件为:30 V、12h,500 V、1 h,1 000 V、1 h,8 000 V、8 h,500 V、4 h。等电聚焦结束后采用12.5%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)胶进行垂直电泳,条件为:15 mA/胶、30 min,30 mA/胶至溴酚蓝离胶下沿0.5 cm。垂直电泳结束采用银染法进行凝胶染色。
1.3.4 图像采集
采用Image Master 2D Platinum凝胶成像系统对凝胶进行灰度扫描。所获得扫描图像通过PD Quest分析软件进行差异蛋白质组分析。
1.3.5 质谱分析及蛋白质数据库检索
采用5800 MALDI-TOF/TOF质谱仪对差异蛋白进行质谱检测。生物质谱的操作过程:切胶→胶内酶解→
ZipTip脱盐→抽提酶解肽段→MALDI-TOF-TOF质谱测试→数据分析→蛋白质鉴定。利用Mascot软件搜索Uniport、Swiss-Port数据库寻找匹配的相关蛋白质。
2 结果与分析
2.1 Bradford定量
采用Bradford方法利用Nano Photometer P360超微量分光光度计对生鲜和冷藏有机牦牛背最长肌肌肉全蛋白质提取量进行测定。以1 mg/mL牛血清白蛋白(bovine serum albumin,BSA)溶液制作标准曲线,以蛋白质含量(mg)为横坐标,以吸光度为纵坐标,得出y=0.003x-0.020(R2=0.988)。由标准曲线公式可知,标准曲线线性关系良好,可以用于实验蛋白质含量的测定。
2.2 双向电泳
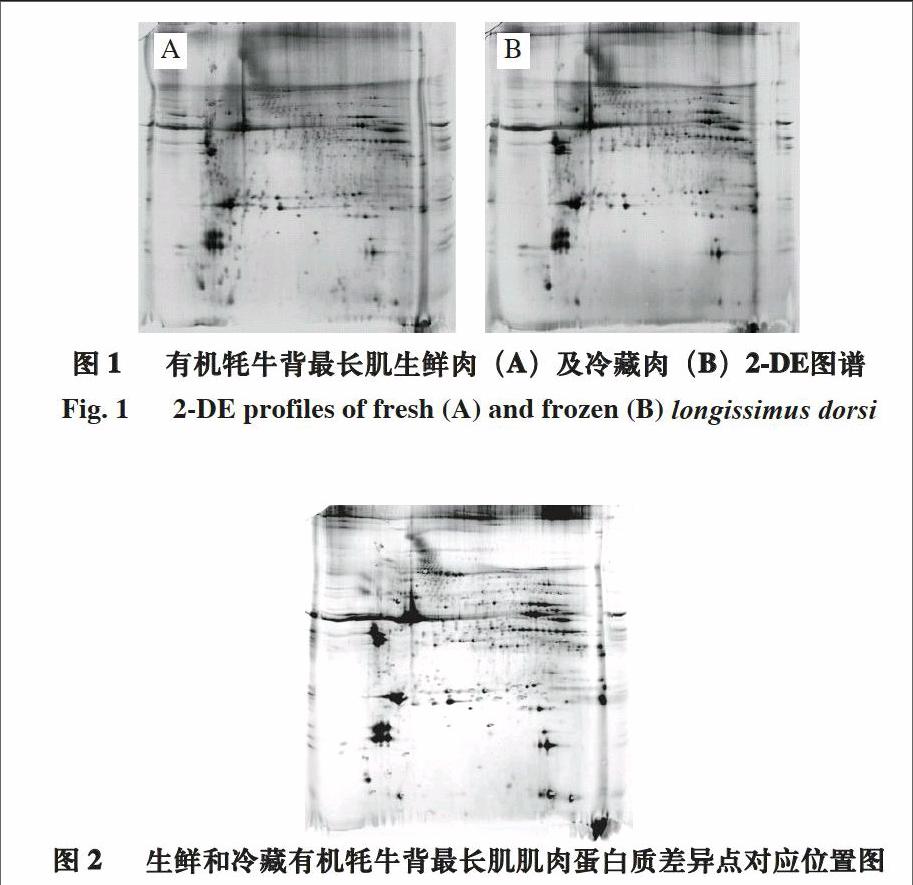
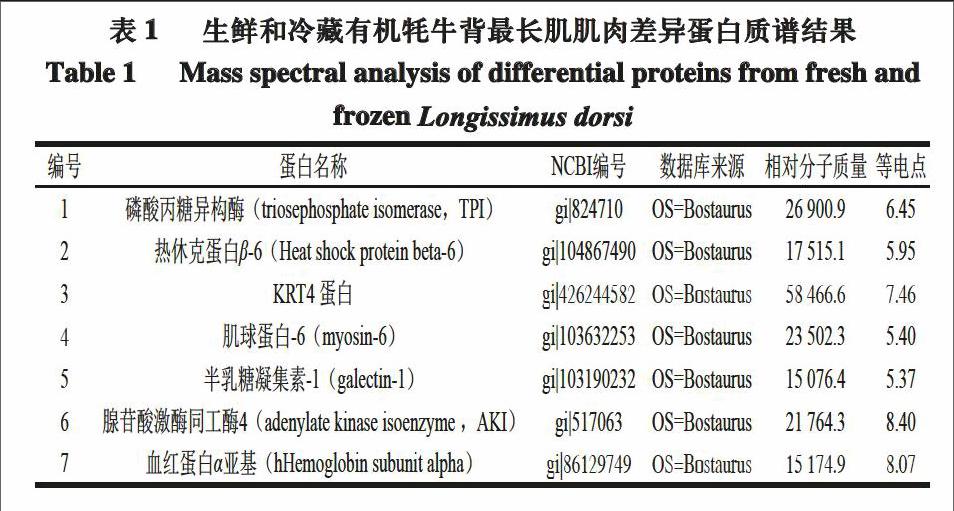
经双向电泳及银染后获得生鲜和冷藏有机牦牛背最长肌肌肉全蛋白双向电泳图谱(图1)及差异蛋白在2-DE图谱中的位置(图2)。匹配后利用PD Quest软件分析筛选差异点,实验结果显示双向电泳图谱具有较高的重复性,匹配率为75%。
通过PD Quest软件对蛋白图谱进行分析,生鲜和冷藏有机牦牛背最长肌肌肉组织的双向电泳凝胶的平均蛋白点数分别为1 840±181和2 034±86,其中具有统计学意义(P<0.05)且差异在3 倍或3 倍以上的蛋白质点共有36 个,其中生鲜有机牦牛背最长肌肌肉相比冷藏肉蛋白上调12 个点,下调24 个点。
2.3 质谱分析
选取PD Quest软件检测相对含量差异3 倍或3 倍以上的蛋白质点,手动取出凝胶上差异的蛋白质斑点(共计36 个蛋白质点),装入1.5 mL离心管中超纯水冲洗干净后进行MALDI-TOF-TOF质谱检测,结果得到7 个匹配有意义的差异蛋白质质谱鉴定结果(表1)。其中,生鲜有机牦牛背最长肌肌肉比冷藏的磷酸丙糖异构酶和热休克蛋白β-6含量上调,其余含量下调。
3 讨 论
运用蛋白质组学技术对动物肌肉贮藏过程中蛋白质组分变化的研究是目前研究的热点之一。几乎所有动物肌肉组织的蛋白质表达谱都有研究,针对青藏高原特有物种——有机牦牛,仅有少量关于感官、系水力、嫩度等理化性质方面的研究资料[2-3],而对宰后生鲜肉及冷鲜肉品质的形成机理、评价和控制方面的研究则鲜见报道。有机牦牛肉品质是影响其商品价值的重要因素之一,因其具有复杂而多元的特性,所以研究屠宰后生鲜和冷鲜牦牛肉蛋白质变化的生理生化机制及其对嫩度等肉质性状的作用,对于探讨有机牦牛肉肌肉生长与肉品品质间的相关性以及货架期的生化反应特点具有重要的意义。
据报道,动物屠宰后肌肉细胞在一定时间内开始死亡,并根据细胞类型发生一系列独特、复杂的分子变化。动物血液循环终止后供氧停止,且不能去除新陈代谢产物,肌内糖原酵解导致乳酸积累,pH值降低,进而导致肌肉持水能力降低及钙离子释放,肌球蛋白与肌动蛋白间形成交联桥[4]。本研究发现了7 种在生鲜牦牛肉和冷藏牦牛肉背最长肌中含量有显著差异的蛋白质,其中TPI及KRT4蛋白、肌球蛋白-6、AKI4蛋白质是糖酵解和三羧酸循环的关键蛋白质。在有机牦牛肉中TPI和HSP β-6含量上调,肌球蛋白-6和AKI4含量下调,其原因可能是宰后肌肉为满足ATP供应而提高了厌氧能量代谢,这些差异蛋白质与肉品性状显著相关。Jia等[5]应用蛋白质组学方法研究牛过度生长的现象,结果表明肌肉生长抑制素基因上有11 对碱基缺失导致了13 种肌肉蛋白质发生了改变,包括收缩蛋白和代谢蛋白,这些蛋白质大部分是来自有收缩性的器官组织,并能够加快肌纤维的收缩功能,这与本研究结果相似。另外Lomiwes等[6]利用蛋白质组分析屠宰后猪肌肉的变化情况,采集了刚屠宰至屠宰后48 h肌肉的蛋白质组样品,这些肌肉蛋白质为5~200 kD不等,pH值为4~9,结果发现蛋白质组模式发生了15 种显著变化。Kim[7]、毛衍伟[8]等指出羊的双肌臀突变导致臀部肌肉异常发达主要是由于18号染色体的突变,导致钙激活中性蛋白酶抑制蛋白的活性增强了2~3 倍。
近几年通过蛋白质组学的研究,揭示了结构蛋白、糖酵解酶和热休克蛋白/伴生蛋白在肌肉嫩化中的作用[9-11]。
研究发现,根据嫩度将牛背最长肌分组,使用荧光差异双向电泳技术分析其蛋白质组后发现,表达存在差异的蛋白包括糖酵解酶和结构蛋白,高嫩度牛肉样品的肌浆蛋白质组分中肌球蛋白轻链的量相对较高,可以作为预测牛肉蛋白水解和最终嫩度的标记蛋白质[12-14]。
Dutaud等[15]研究表明,安格斯牛肉宰后成熟过程中3 种蛋白表达量降低可能由于发生了等电点沉淀,推测有机牦牛肉成熟过程中表达量降低可能由于pH值的降低,发生等电点沉淀所造成。
综上所述,通过双向凝胶电泳结合生物质谱技术测定生鲜和冷藏有机牦牛背最长肌肌肉差异蛋白质,初步筛选出生鲜肉与冷藏肉的差异表达蛋白质,涉及糖酵解蛋白、热应激蛋白、结构蛋白等,说明这些蛋白在有机牦牛肉贮藏过程中对肉品质的影响发挥了重要的作用。
参考文献:
[1] PAREDI G, RABONI S, BENDIXEN E, et al. “Muscle to meat” molecular events and technological transformations: the proteomics insight[J]. Proteomics, 2012, 75(14): 4275-4289. DOI:10.1016/j.jprot.2012.04.011.
[2] LAGERSTEDT A, LUNDSTROM K, LINDAHL G. Influence of vacuum or high-oxygen modified atmosphere packaging on quality of beef longissimus dorsi steaks after different ageing times[J]. Meat Science, 2011, 87(2): 101-106. DOI:10.1016/j.meatsci.2010.08.010.
[3] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI: 10.1002/mnfr.201000453.
[4] YATES J R, RUSE C I, NAKORCHEVSKY A. Proteomics by mass spectrometry: approaches, advances, and applications[M]. Annual Review of Biomedical Engineering, 2009, 11: 49-79. DOI: 10.1146/annurev-bioeng-061008-124934.
[5] JIA X, HILDRUM K I, WESTAD F, et al. Changes in enzymes associated with energy metabolism during the early post mortem period in longissimus thoracis bovine muscle analyzed by proteomics[J]. Journal of Proteome Research, 2006, 5: 1763-1769. DOI: 10.1021/pr060119s.
[6] LOMIWES D, FAROUK M M, WIKLUND E, et al. Small heat shock proteins and their role in meat tenderness: a review[J]. Meat Science, 2013, 96: 26-40. DOI:10.1016/j.meatsci.2013.06.008.
[7] KIM Y H B, LONERGAN S M, GRUBBS J K, et al. Effect of low voltage electrical stimulation on protein and quality changes in bovine muscles during postmortem aging[J]. Meat Science, 2013, 94: 289-296. DOI:10.1016/j.meatsci.2013.02.013.
[8] 毛衍伟, 张一敏, 朱立贤, 等. 应用蛋白质组学研究肉品品质形成的机理[J]. 食品与发酵工业, 2014, 40(9): 107-114.
[9] KERWIN B A, REMMELE R L. Protect from light: photode gradation and prteinbiologics[J]. Journal of Pharmaceutical Sciences, 2007, 96(6): 1468-1479. DOI: 10.1002/jps.20815.
[10] 蒲强, 罗嘉, 沈林園, 等. 蛋白质修饰组学在肉品质研究中的应用[J]. 遗传, 2015, 37(4): 327-335. DOI: 10.16288/j.yczz.14-417.
[11] LAMETSCH R, K ARLSSON A, ROSENVOLD K, et a1. Postmortem proteome changes of porcine muscle related to tenderness[J]. Journal of Agricultural and Food Chemistry, 2003, 51(24): 6992-6997. DOI: 10.1021/jf034083p.
[12] 杨金宝, 何若钢, 秦小娥, 等. 营养与猪肉品质[J]. 猪业科学, 2006, 23(12): 68-69. DOI: 10.3969/j.issn.1673-5358.2006.12.023.
[13] 陈平, 谢锦云, 梁宋平. 双向凝胶电泳银染蛋白质点的肽质谱指纹图分析[J]. 生物化学与生物物理学报, 2000, 32(4): 387-391.
[14] BIENVENUT W V, SANCHEZ J C, SANCHEZ A, et al. Towards a clinical molecular scanner for proteome research: parallel protein chemical processing before and during western blot[J]. Analytical Chemistry, 1999, 71(21): 4800-4807. DOI: 10.1021/ac990448m.
[15] DUTAUD D, AUBRY L, SENTANDREU M A. Bovine muscle 20S proteasome:simple purification procedure and enzymatic characterization in relation with postmortem conditions[J]. Meat Science, 2006, 74: 327-336. DOI:10.1016/j.meatsci.2006.03.027.

