钠氢交换体1在星形细胞瘤中的表达及其与恶性程度的关系*
李文娟 黄 林# 孙善全
(1 成都市第五人民医院呼吸与危重症医学科,成都 611130;2 重庆医科大学神经科学中心,重庆 400016)
星形细胞瘤是胶质瘤的一种,在颅腔内呈弥漫性生长,恶性程度高,复发率和死亡率居高不下。尽管目前采取最大限度的手术切除肿瘤组织以及术后放疗和化疗技术的不断提高,但是恶性星形细胞瘤患者的预后仍不容乐观,其中胶质母细胞瘤的中位生存期为14~15 个月[1-2]。钠氢交换体1(Na+/H+exchanger 1,NHE1)存在于真核细胞中,是调节细胞内pH 的重要跨膜转运蛋白[3]。NHE1 以细胞内1 个H+,细胞外1 个Na+进行等分子比例的跨膜交换,从而排出胞内H+[4]。研究表明,实体肿瘤细胞有碱性的细胞内pH 值和酸性的细胞外pH 值,细胞内的pH 值明显高于细胞间隙,这种细胞外液的酸性微环境对肿瘤细胞的增殖、生长以及浸润转移有重要的意义,而NHE1 在形成和维持这种酸性微环境过程中具有重要意义[5]。然而,有关NHE1 在人星形细胞瘤中的表达鲜有报道。为此,本研究应用免疫组织化学和免疫印迹对NHE1 在人星形细胞瘤中的表达变化做了初步分析,探讨NHE1 在星形细胞瘤增殖、生长中的作用。
1 材料和方法
1.1 标本的采集
所有星形细胞瘤标本及正常脑组织均取自重庆医科大学附属第一医院神经外科及第三军医大学附属大坪医院神经外科星形细胞瘤的患者,星形细胞瘤共计51 例,正常脑组织27 例。所有标本自术中取出后,一部分用于病理检查,另一部分则置于液氮中迅速冷冻,-80℃保存。经病史询问,证实所有患者术前均未接受过免疫治疗、放疗和化疗等治疗手段。
1.2 主要试剂
小鼠抗人NHE1 单克隆抗体购自Abcam 公司,小鼠抗人GAPDH 单克隆抗体购自Santa Cruz 公司;免疫组织化学二抗试剂盒及DAB 显色试剂盒均购自中杉金桥公司。
1.3 免疫组织化学显色
将所取瘤周脑组织与各级别星形细胞瘤的组织经4%多聚甲醛固定后,石蜡包埋,连续切片,厚度为5 μm。常规脱蜡后行H-E 染色,进行诊断和病理分级;选片进行两步法免疫组织化学显色,NHE1 一抗浓度1∶200,DAB 显色后用0.01 mol/L PBS终止显色,苏木精复染细胞核,梯度乙醇脱水、二甲苯透明后封片,显微镜观察并照相。阴性对照用0.01 mol/L的PBS代替一抗,其余步骤不变。采用北航(CM-2000B)生物医学图像分析系统进行图像分析,测定免疫反应阳性细胞的积分光密度值(IOD)。
1.4 免疫印迹检测NHE1 表达量
细胞裂解液(碧云天)提取瘤周组织和各级星形细胞瘤组织样品总蛋白,SDS-PAGE 凝胶分离蛋白,通过湿转方式将蛋白转至硝酸纤维膜上,用免疫印迹封闭液于37℃恒温水浴箱封闭1.5 h,加入NHE1(1∶200)一抗、GAPDH(1∶500)一抗,4℃冰箱过夜孵育,PBST 洗膜后分别加入相应二抗,37℃恒温水浴箱孵育2 h,PBST 洗膜后DAB 试剂盒显色。用Quantity One 软件转换后测定灰度值,以GAPDH 为内参对照,将NHE1 条带灰度值分别与其内参GAPDH 灰度值的比值作为观察指标,进行统计学分析。
1.5 统计学处理
所有数据采用SPSS17.0 统计软件进行处理,计量资料以±s表示,多组均数比较采用方差分析,其两两比较采用LSD 法,以P<0.05 为差异有统计学意义。
2 结果
2.1 病理诊断及免疫组织化学显色
根据世界卫生组织WHO2007 对星形细胞瘤的病理分级标准,结果显示:低级别(WHO Ⅰ-Ⅱ)星形细胞瘤组织22 例,高级别(WHO Ⅲ-Ⅳ)星形细胞瘤组织29 例(图1)。
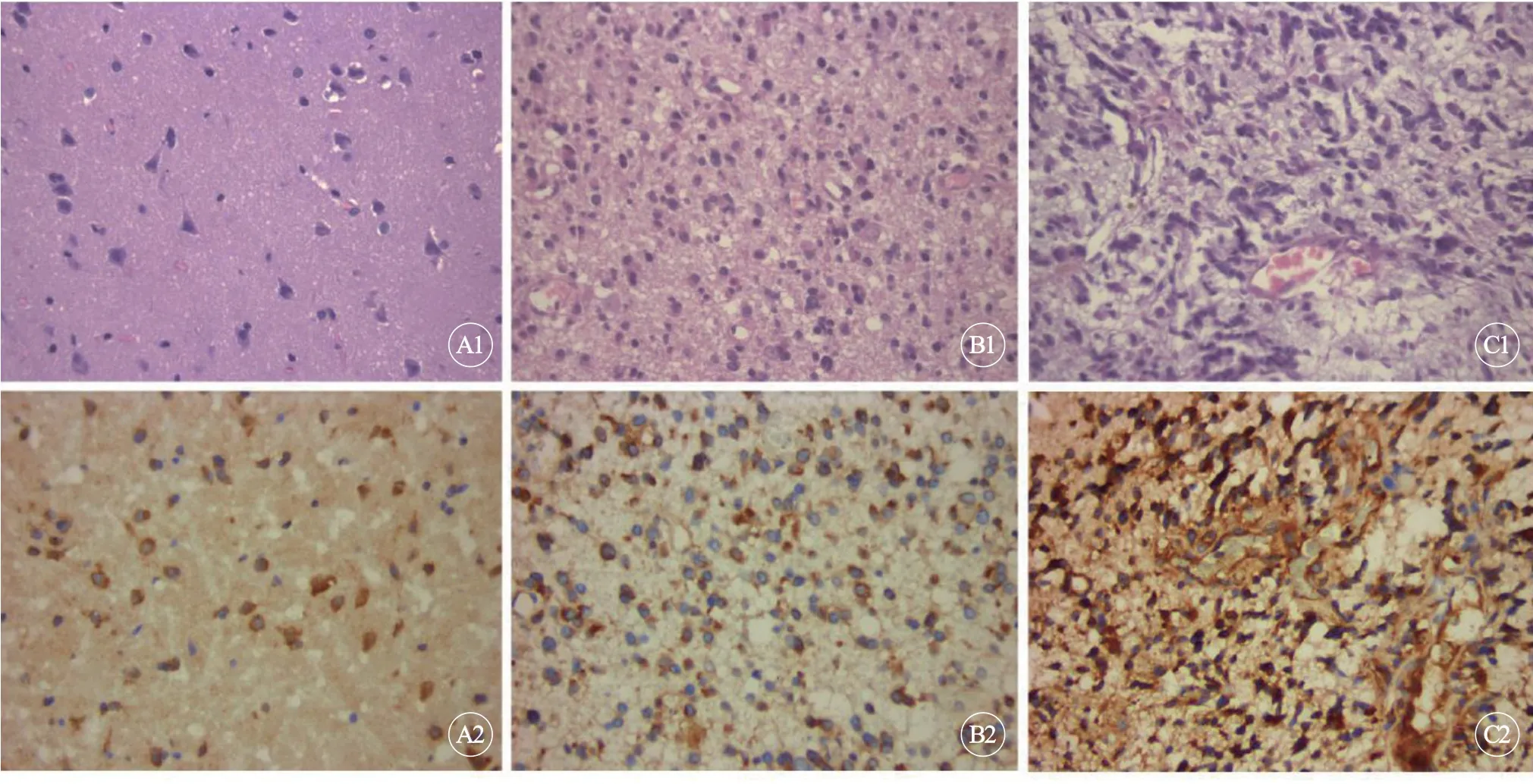
图1 星形细胞瘤病理分级(A1~C1)和NHE1 在对照组及各肿瘤组织中的表达(A2~C2),×400Fig1 Pathological grading of the astrocytomas(A1-C1)and expression of NHE1 in different tumor tissuesand control groups(A2-C2),×400
2.2 NHE1 阳性表达细胞的积分光密度值
对照组中NHE1 主要分布在神经元和少量星形细胞胞膜上。在低级别星形细胞瘤组织中,NHE1分布在瘤细胞的胞膜上。在高级别星形细胞瘤组织中NHE1 强烈表达在胞质和胞膜上(图1)。图像分析结果显示,对照组积分光密度值为3.19±0.42,低级别肿瘤星形细胞瘤组为5.04±0.67,高级别星形细胞瘤组为8.61±0.38。与对照组相比较,肿瘤组织中NHE1 表达增强(P<0.05),与低级别星形细胞瘤比较,高级别星形细胞瘤组织中NHE1 表达更强烈,差异有统计学意义(P<0.05)。
2.3 NHE1 表达
免疫印迹结果显示,对照组及肿瘤组织中均可见NHE1 条带,肿瘤组织中MHE1 表达增高,与对照组相比较,差异有统计学意义(P<0.05),与低级别星形细胞瘤组织相比,高级别星形细胞瘤组织中NHE1 表达明显增强,差异具有统计学意义(P<0.05)(图2)。

图2 不同级别人星形细胞瘤组织及对照组中NHE1 的表达Fig2 Expression of NHE1 in human astrocytoma tissues of various pathological grades and control group
3 讨论
NHE 是细胞膜上一类重要的跨膜转运载体,可将细胞内的H+与Na+以1∶1 的比例进行跨膜转运,调节细胞内的pH 值,对维持细胞内外的酸碱平衡具有重要的作用[4]。NHE1 是NHE 基因家族中最具特征性结构的亚型,被认为是管家基因。NHE1 蛋白质在分子结构上具有2 个功能域,即疏水性的N 端和亲水性的C 端,N 端位于胞膜上,是介导细胞内外H+和Na+交换的必要条件;C 端位于胞质内,决定NHE1 进行Na+/H+交换的pH 调定点,从而决定了胞内的pH 水平[6]。
体内外研究证实,肿瘤细胞内的pH 值高于细胞外,即相对于细胞外,细胞内更趋向于碱化,肿瘤细胞内的碱化能够有效防止肿瘤细胞的酸化死亡;同时肿瘤细胞外的酸性微环境对肿瘤细胞的增殖、侵袭和转移具有重要的作用[7-9]。本课题组前期研究结果显示,肿瘤细胞内乳酸的转运主要依靠细胞膜上单羧酸转运蛋白(MCTs)[10]。尽管MCTs 在转运乳酸的同时能够以1:1 的比例转运H+,但NHE1 对于细胞内H+的转运具有主导作用,被认为是维持肿瘤细胞内碱化和肿瘤微环境酸化的重要机制之一。一方面,细胞内有关的代谢酶和与细胞增殖的有关机制都需要在细胞内碱性环境下进行。如糖酵解过程中的限速酶-磷酸果糖激酶的最适pH 值为7.2,在酸性环境中,其活性明显减弱。此外,细胞增殖过程中所合成的蛋白质等物质在碱性环境中合成速度加快,而在酸性环境中合成受到抑制。另一方面,酸性的细胞外环境能够增强肿瘤细胞的侵袭能力。肿瘤细胞分泌的多种蛋白酶都需要在酸性环境中溶解其附着的基底膜和细胞外基质,而且排出的酸也能够直接溶解基底膜和细胞外基质,从而提高肿瘤细胞的侵袭和转移能力[11]。最近研究还表明,NHE1的活性与肿瘤细胞伪足的形成密切相关[12]。伪足对于肿瘤细胞的运动、黏附具有重要作用,伪足的形成需要细胞骨架中不同成分之间的相互作用,而NHE1可能是通过调节细胞内的pH值,为其提供最适的碱性微环境[13]。此外,NHE1也能够被细胞黏附所激活[14]。以上表明NHE1可能直接参与了肿瘤细胞伪足的形成、运动和黏附过程。
NHE1 在乳腺癌[15]、肺癌[16]、肝细胞癌[17]和黑色素瘤[18]等多种肿瘤细胞中高表达,且与肿瘤细胞的侵袭和转移相关。本实验研究结果显示,NHE1 主要分布在对照组神经元和少量星形胶质细胞胞膜上;在肿瘤组织中,NHE1 分布在低级别星形细胞瘤胞膜上,并强烈表达于高级别星形细胞瘤的胞质和胞膜上。与对照组比较,在低级别和高级别星形细胞瘤组织中NHE1 表达上调,其中,恶性程度较高的高级别肿瘤相对于恶性程度低的低级别肿瘤,NHE1 表达更为强烈。提示NHE1 在星形细胞瘤的增殖和生长过程中具有重要的作用,与其恶性程度呈正相关。用NHE1反义基因转染胃癌SGC-7901细胞,能够下调NHE1基因的表达,导致细胞内酸化,抑制肿瘤细胞的增殖[19];用siRNA干扰NHE1基因的表达能够抑制食管癌KYSE-70细胞的体外增殖和侵袭能力[20-21]。Yang等[22]用NHE1-siRNA和NHE1特异性抑制剂EIPA抑制了肝细胞癌的生长,同时诱导了肿瘤细胞的凋亡。
综上所述,NHE1 通过向胞外转运肿瘤细胞因高糖酵解产生的H+,维持肿瘤细胞内的pH 值,形成肿瘤细胞外酸内碱的微环境,对肿瘤细胞的增殖、侵袭和转移起到重要作用。提示NHE1 有望成为星形细胞瘤治疗的靶点。除此之外,肿瘤细胞外酸内碱的微环境的形成还可能存在其他分子机制。本课题组前期研究表明,Kir4.1 在人星形细胞瘤中高表达,其表达强度与其病理等级相关,Kir4.1 的高表达,导致K+大量内流,后者可激活Na+-K+-ATP酶,促进Na+/H+,碱化细胞内环境,促进恶性胶质细胞瘤的增殖[23];MCTs 在星形细胞瘤中的表达上调,提示MCTs 协同肿瘤细胞内乳酸等酸性物质的转运,可能在星形细胞瘤的增殖和迁移过程中发挥重要作用,并且对肿瘤细胞的增殖、生长和细胞内外pH 的维持具有重要的细胞生物学意义[11]。然而,NHE1 与Kir4.1 和MCTs 三者的表达调控是否存在某种联系,还有待进一步研究。