二氧化碳联合核桃壳提取液促进单针藻Monoraphidium sp.QLZ-3的生长和油脂积累
邢海亮,董训赞,3,韩本勇,耿树香,宁德鲁,马婷,余旭亚
(1昆明理工大学生命科学与技术学院,云南昆明650500;2云南省林业与草原科学院,云南昆明650051;3云南贵澳农业科技集团,云南昆明650100)
近年来,由于微藻具有光合效率高、生长周期短、油脂含量高等优势,被公认为制备生物柴油的新型生物质能源[1-2]。然而,较高的生产成本及较低的生物量产率和油脂产率限制了利用微藻制备生物柴油的工业化发展[3-4]。利用废弃物中的营养物质培养微藻,可以有效地降低微藻生产成本,同时废弃物得到资源化利用,成为研究热点[5]。
核桃是营养丰富的坚果,种植广泛,核桃壳作为核桃产品加工过程中的副产物,可以用于色素的提取、制作活性炭和抛光材料等[6-7]。然而大部分核桃壳却被就地焚烧,不仅造成了资源的浪费,还会带来严重的环境污染。研究指出,核桃壳中含有多种微量元素及丰富的多酚物质[8]。多酚作为一种抗氧化剂,具有较强的抗氧化性[9]。Zhao 等[10]研究指出,抗氧化剂可以通过调节与油脂合成相关的酶的活性,进而有效促进非生物胁迫下微藻中油脂的积累。此外,在微藻的培养过程中,通入适当浓度的CO2,有利于提高微藻的光合作用效率,促进微藻生物量的积累[11]。有研究指出,在BG-11无碳培养基中,当外源通入5% 的CO2时,小球藻FACHB-1580和栅藻FACHB-1618最大生物量达到3.5g/L 和5.4g/L,分别是对照组的1.41 倍和1.46倍[12]。然而,核桃壳提取液(walnut shell extracts,WSE)联合CO2用于微藻培养的研究鲜有报道,研究CO2对WSE中微藻生长和油脂积累的影响,有利于了解CO2作用下WSE中微藻生长和油脂合成的相关机制。
本文以单针藻Monoraphidium sp. QLZ-3 为对象,以WSE为培养基,研究了外源通入CO2的条件下,微藻生物量产率和油脂产率的变化及对WSE 中多酚的吸收。同时对微藻细胞内核酮糖1,5-二磷酸羧化酶基因(ribulose 1,5-bisphosphate carboxylase/oxygenase,rbcL)相对表达水平和与油脂合成相关酶的活性进行了检测。将微藻培养与核桃壳的利用相结合,为提高微藻的生物量产率和油脂产率,降低微藻培养成本,以及核桃壳的环境友好的资源化利用提供一定的指导依据。
1 材料与方法
1.1 原料与培养基的制备
以单针藻Monoraphidium sp. QLZ-3 为研究对象(本实验室筛选、保存)[13]。称取适量的核桃壳(云南省林业科学院提供)与10倍质量的蒸馏水混合,在95℃条件下提取4h,得到褐色的WSE,经8层纱布过滤后,添加NaNO3(1.16g/L),调整pH至6.8~7.0,分装至生物反应器(ϕ0.06m×h0.51m)中,121℃灭菌20min。将单针藻Monoraphidium sp.QLZ-3接入上述培养基中(初始接种量为0.4g/L),分别通入不同浓度CO2(空气、4%、8%、12%和16%),气体流速为0.5L/min,光照强度6500lux,培养温度25℃±1℃,每组设置3个平行。
1.2 仪器与设备
FA2004N 分析天平,LDZX-50KBS 灭菌锅,VS-840-1超净工作台,Ultrospec 2100pro紫外可见分光光度计,RF-540 荧光分光光度计(Shimadzu),5804R 高速低温离心机(德国Eppendorf 公司),1730R 高速冷冻离心机(丹麦Labogene Scanspeed公司),FD5-12冷冻干燥机(西盟国际集团),Agilent 7890A系列气相色谱仪(Agilent Technologies)。
1.3 生物量、油脂含量的测定[14]
(1)生物量 每天取10mL(V)藻液,3500r/min 离心10min,去上清液,冷冻干燥后,称取藻粉质量(w1)。微藻生物量Y(g/L)的计算如式(1)。
Y = w1/V (1)
(2)油脂含量 将新鲜的藻液冷冻干燥后,称取0.3~0.5g(m1)干藻粉与2 倍质量的石英砂混合,充分研磨40min,用3mL 氯仿甲醇溶液(2∶1,体积比)提取油脂,于25℃、150r/min 条件下振荡提取30min后,离心(5000r/min,10min),收集上清液。重复上述提取操作3 次,合并上清液,置于预先干燥称重的离心管(w2)中,40℃干燥至恒重(w3),油脂含量η(%)计算如式(2)。

1.4 CO2固定效率及气液传质系数的测定
二氧化碳固定效率依据式(3)计算[15]。

式中,FCO2为CO2固定效率,mg·L-1·d-1;Pb为生物量产率,mg·L-1·d-1;a 为单位生物量固定CO2的质量。
气液传质系数[16]测定方法为:先将光生物反应器中不含微藻的培养基以99.99%的氮气曝气1.5h后,再以不同浓度的CO2曝气,培养基温度为25±1℃,测量60min 内培养基中溶解CO2浓度的变化,每5min记录1次,通过气液传质方程和亨利定律计算传质系数KLa。计算过程如式(4)。

1.5 rbcL基因表达分析
使用Primer5.0 设计引物,由上海生工生物工程技术服务有限公司合成18S和rbcL酶基因的上下游扩增引物(表1),并以此进行荧光定量PCR。
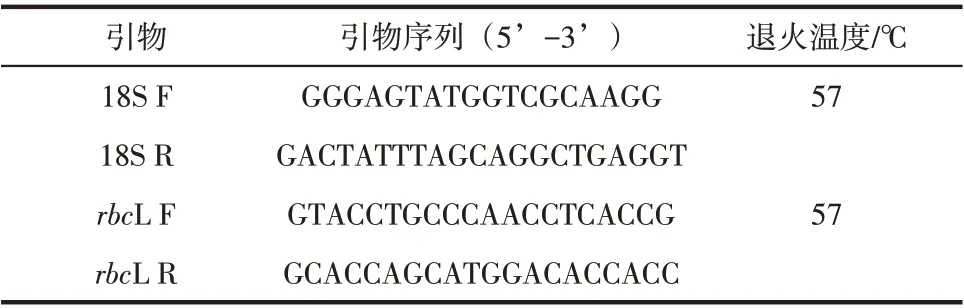
表1 酶基因荧光定量引物
Trizol 法提取不同浓度CO2处理下单针藻Monoraphidium sp. QLZ-3 内的RNA,利用逆转录试剂盒(TaKaRa)将RNA 逆转录合成cDNA,以其为模板进行RT-PCR 扩增,检测不同浓度CO2处理下单针藻rbcL 基因表达的变化。通过ABI 7500荧光定量仪对rbcL 基因的表达进行定量,RT-PCR的数据结果用2-ΔΔCT(Livak)的方法处理分析。以18s基因作为内标以调节RNA的用量和循环数,使内标基因在诱导条件下的表达丰度一致,最终得到基因表达量之间的倍数关系。
1.6 多酚含量测定[17]
WSE 中总多酚含量采用Folin-Ciocalteu 法测定:称取干燥至恒重的没食子酸10.0mg,加入到蒸馏水中定容至100mL。分别取0.1mL、0.2mL、0.3mL、0.4mL、0.5mL、0.6mL、0.7mL、0.8mL 和0.9mL 没食子酸溶液于10mL 的比色管中,加入Folin-Ciocalteu 试剂0.5mL,1min 后加入碳酸钠溶液1.5mL(200g/L),用蒸馏水定容至刻度线处,混匀,40℃保温2h 后,迅速冷却。在760nm 处测定吸光度,建立标准曲线。按照上述方法测定样品中多酚的含量。
1.7 酶活性测定[18]
单针藻Monoraphidium sp. QLZ-3 中苹果酸酶(malic enzyme,ME)、乙酰辅酶A 羧化酶(acetyl coenzyme A carboxylase,ACCase)和磷酸烯醇式丙酮 酸 羧 化 酶 (phosphoenolpyruvatecarboxylase,PEPC)的活性使用比色定量试剂盒(苏州科铭生物技术有限公司)测定。
1.8 脂肪酸组成分析
将2mL 3%的硫酸-甲醇(体积比)溶液加入到烘干的油脂中,70℃回流2h 后,加入2mL 正己烷震荡提取4h,取正己烷相进行气相色谱-质谱(GC-MS)分析[19]。
1.9 统计分析
本文全部实验均设置3 组平行,利用ANOVA(SPSS19.0)一步法分析实验数据,P<0.05表示差异显著,后文中用“*”表示;P<0.01表示差异极显著,后文中用“**”表示。
2 实验结果与讨论
2.1 CO2对WSE中单针藻生物量的影响
不 同 浓 度 的 CO2对 WSE 中 单 针 藻Monoraphidium sp. QLZ-3 生长的影响如图1 所示。在培养过程中,随着CO2浓度的不断提高,微藻的生物量逐渐增加,当CO2浓度达到12%时,微藻的生物量达到最高,为1.18g/L,是对照组的1.33倍。继续增加CO2的浓度,微藻的生物量出现下降趋势。近期研究指出,向糖蜜酒精废醪液中添加褪黑素,单针藻Monoraphidium sp. QLY-1 的生物量达到1.22g/L[1],相比对照组提高了41.82%;在80mg/L黄腐酸的作用下,微藻的生物量提高了52.26%[9]。诸多研究表明,在微藻的生长过程中,通入适当浓度的CO2,可以促进微藻光合作用的进行,使得藻细胞快速生长[11,20]。有研究指出,当向生活污水中通入2.5%的CO2时,栅藻的生物量达到1.37g/L,是对照组的1.54 倍[21]。适宜浓度的CO2有助于微藻的生长,但当CO2的浓度超过一定的范围时,微藻的生长就会受到抑制[22]。这与本实验结果一致,将WSE中的CO2浓度增加至16%时,微藻的生长受到抑制(图1)。这是由于持续通入高浓度的CO2会迅速降低溶液pH,可能抑制相关酶活性,从而使微藻的生物量降低[12]。
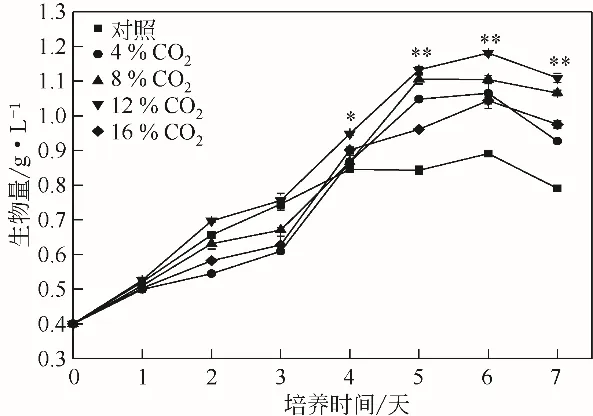
图1 不同浓度CO2对WSE中单针藻Monoraphidium sp.QLZ-3生物量的影响
2.2 CO2 对WSE 中单针藻油脂及生物量产率的影响
如图2 所示,当WSE 中CO2的浓度为12%时,单针藻Monoraphidium sp.QLZ-3 的油脂含量最高,为49.54%,是对照组的1.18 倍。此时,生物量产率和油脂产率为196.85mg/(L·d)和97.52mg/(L·d),分别是对照组的1.33 倍和1.57 倍。相关研究指出,利用养猪厂废水培养微藻,油脂含量最高可达28.8%,相比对照组提高了53.76%[23];利用水产养殖废水培养栅藻LX1,其油脂含量可达到31.6%[24]。相关研究表明,由于微藻中诱导转运机制的存在,适当浓度的CO2可以促进微藻的生长和积累脂类[25]。当BG-11 培养基中通入5% 的CO2时,栅藻Scenedesmus sp. FACHB-1600 的油脂产率达到104.163mg/(L·d),相比对照组提高了51.15%[22]。本实验结果表明,适宜浓度的CO2有助于WSE中单针藻Monoraphidium sp.QLZ-3的生长油脂积累,提高生物量产率和油脂产率。

图2 不同浓度CO2对微藻油脂含量、生物量产率和油脂产率的影响
此外,WSE的制备成本为CNY25.05/t(天然气价格为CNY2.4/m3,水价格为CNY3.45/t),在12%的CO2作用下,微藻生物量和油脂的原料成本分别为CNY21.23/kg 和CNY42.85/kg。研究指出,利用传统培养基BG-11 培养栅藻Scenedesmus SDEC-13时,微藻生物量和油脂培养的原料成本则分别为CNY144.00/kg和CNY709.01/kg[26]。结果表明,WSE联合CO2用于微藻的培养可以降低微藻生物柴油制备的原料成本。
2.3 CO2固定效率及传质效率
不同浓度的CO2对WSE 中传质系数(KLa)及微藻对CO2的固定效率的影响如图3 所示。在微藻的培养过程中,随着CO2浓度的增加,KLa值逐渐增加。当CO2的浓度为12%时,KLa值为0.073min-1,此时CO2的固定效率最高,达到0.36g CO2/(L·d)。结果表明,当CO2的固定效率最高时,单针藻Monoraphidium sp.QLZ-3的生物量产率及油脂产率达到最大(图2)。而当CO2的浓度为16%时,虽然KLa值增加至0.081min-1,但CO2的固定效率下降至0.36g CO2/(L·d)(图3),微藻的生物量产率和油脂产率也分别下降至174.05mg/(L·d)和74.97mg/(L·d)(图2),这可能是由于较高的CO2浓度限制了微藻的生长[27]。本实验结果显示,当KLa值为0.073min-1时,WSE 中有足够的持续的CO2供给微藻的生长,而当KLa值增加0.081min-1时,由于CO2浓度过高而降低了其固定效率,从而使微藻的生长(图1)和油脂积累(图2)降低。
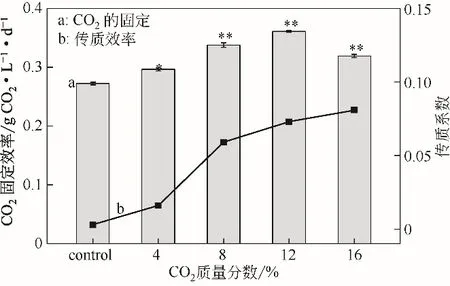
图3 不同浓度CO2在WSE中对CO2的固定(柱形图)及传质效率(折线图)的影响
2.4 WSE中多酚含量变化
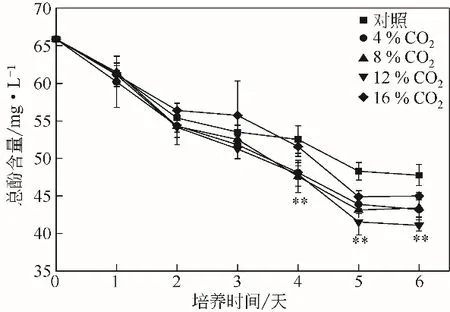
图4 不同浓度CO2下WSE中多酚含量变化
多酚具有很强的抗氧化特性,可以减缓细胞的氧化损伤[9]。Zhao 等[10]研究指出,抗氧化剂可以通过调节油脂合成相关途径,进而促进微藻中油脂的积累。由图4可知,在微藻的培养过程中,WSE中的多酚含量逐渐降低。Lu等[28]指出,多酚是一种微量营养元素,可被细胞吸收利用。在CO2的浓度为12%的条件下,WSE 中的多酚含量从65.87mg/L 下降至41.09mg/L,相比对照组降低了16.00%。图1表明,12%的CO2促进了微藻的生长,WSE中更多的多酚被单针藻Monoraphidium sp.QLZ-3吸收(图4),从而促进了微藻中油脂含量的积累(图2)。Paz-Yépez 等[17]研究指出,多酚可以阻碍自由基与脂质分子的结合,从而减少由于脂质氧化引起的细胞损伤,促进油脂的积累。褪黑素作为一种抗氧化剂(melatonin,MT),1μmol/L 的MT作用下,单针藻Monoraphidium sp. QLY-1 的油脂含量达到49.6%,是同等条件下对照组的1.32倍[29]。Che等[18]研究表明,抗氧化剂促进微藻的生长和油脂的积累,与油脂合成相关酶的活性及酶基因的表达有关。
2.5 CO2 对单针藻中与油脂合成相关酶活性的影响
ACCase 是一种依赖生物素的变构羧化酶,主要催化依赖ATP 的乙酰辅酶A(acetyl coenzyme A)转化为丙二酰辅酶A,是脂肪酸合成过程中的限速酶[1,28]。在CO2的作用下,单针藻Monoraphidium sp.QLZ-3 中,ACCase 的活性变化如图5 所示,随着CO2浓度的增加,藻细胞内ACCase 的活性逐渐增强,当CO2浓度的增加至12%时,ACCase 的活性最大,达到对照组的1.23~1.38 倍。继续增加CO2的浓度,ACCase的活性开始下降。前人研究指出,由ACCase 催化生成的丙二酰辅酶A 可以有效抑制脂肪酸的氧化[30]。通过上调ACCase 的活性,可以促进衣藻Chlamydomonas reinhardtii 油脂含量的提高[1]。本实验研究结果显示,向WSE中通入适宜浓度的CO2,可以提高单针藻Monoraphidium sp.QLZ-3中ACCase的活性,促进油脂的积累。

图5 不同浓度CO2对微藻中ACCase活性的影响
苹果酸在ME 的作用下降解为丙酮酸,还原NADP+,为脂肪酸的合成提供足够的NADPH[1]。如图6所示,CO2促进了微藻中ME活性的提高。培养第2 天时,ME 活性的提高最大,是对照组的2.60倍。在脂肪酸合成的过程中,脂肪酸合成酶可利用由ME 还 原 得 到 的NADPH[31]。 在 单 针 藻Monoraphidium sp. QLZ-3 的培养过程中,ME 的活性始终高于对照组(图6),这就为微藻油脂的合成提供了足够的NADPH,促进了微藻油脂的积累(图2)。Xue 等[32]研究指出,通过提高ME 的活性,三角褐指藻的油脂含量提高了2倍。这与本实验结果一致,CO2促进了微藻中ME 的活性,进而促进了微藻油脂含量的提高。

图6 CO2作用下微藻中ME活性的变化
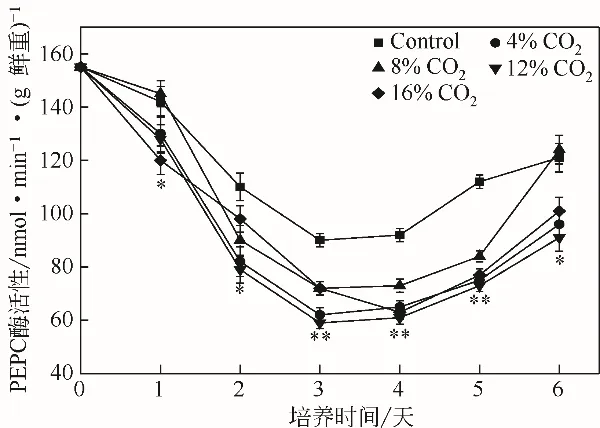
图7 不同浓度CO2对单针藻Monoraphidium sp.QLZ-3中PEPC活性的影响
PEPC 是光合作用C4途径中的关键酶之一,催化磷酸烯醇式丙酮酸的β-C羧基化并生成草酰乙酸和无机磷酸,它与ACCase 之间存在着底物的竞争[33-34]。在微藻培养过程中,实验组和对照组中PEPC 的活性均出现先降低后增加的趋势,但实验组中的PEPC活性始终低于对照组(图7)。培养前期,ACCase和ME的活性较高(图5和图6),油脂合成较快,PEPC的活性逐渐下降(图7),培养后期,ACCase和ME的活性较低(图5和图6),油脂缓慢合成,PEPC活性开始逐渐增高。Ghosh等[25]研究指出,通过上调衣藻Chlamydomonas reinhardtii中PEPC的活性,其油脂含量下降了37%。而PEPC基因的敲除,促进了三角褐指藻Phaeodactylum tricornutum中油脂的积累[35]。本实验结果表明,CO2可以降低单针藻Monoraphidium sp. QLZ-3 中PEPC的活性,促进微藻油脂的积累。
2.6 CO2对WSE中单针藻rbcL基因表达量的影响
单针藻Monoraphidium sp. QLZ-3 中rbcL 基因相对表达量的变化见图8。在CO2的作用下,微藻细胞内rbcL 基因的相对表达量均有不同程度的增加。与对照组相比,当CO2的浓度为12%时,在培养的1~3 天,rbcL 基因的相对表达量从1.64倍增加至2.63倍,随后开始下降,到第6天时下降至1.49 倍。Ikaran 等[36]研究表明,rbcL 基因与CO2的固定有关,其表达量的上调可以加快光合作用固碳。图8 表明,12%的CO2作用下微藻中rbcL 基因表达量上调,促进了微藻对CO2的吸收,为微藻的生长提供更多的碳骨架,从而促进了微藻的生长(图1)和CO2的固定(图3)。Che 等[18]研究表明,微藻固定的CO2用于合成糖、脂质等生物大分子。缺氮条件可以促进小球藻chlorella vulgaris var L3中rbcL 基因表达量的上调,油脂含量增加了25%[36]。本实验结果显示,12%的CO2上调了rbcL基因表达量,促进了CO2的固定、微藻的生长及油脂的积累。
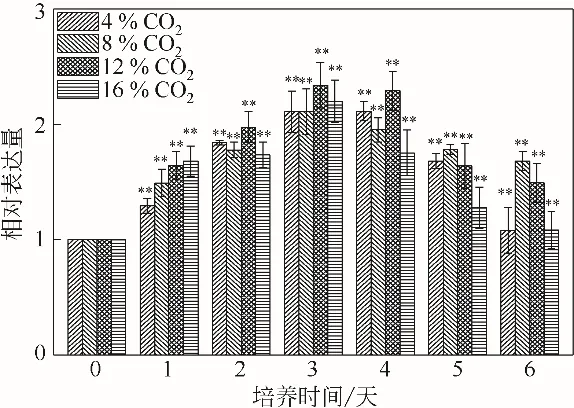
图8 不同浓度CO2对单针藻Monoraphidium sp.QLZ-3的rbcL基因相对表达量影响
2.7 WSE中单针藻脂肪酸的组成分析
单针藻Monoraphidium sp.QLZ-3脂肪酸的组成如表2 所示,C16∶0(16 表示脂肪酸碳链的长度,0表示碳链上不饱和键的个数)、C18∶1、C18∶2和C18∶3是微藻脂肪酸的主要成分。与对照组相比,12%的CO2作用下,微藻中的C16∶0 含量增加了36.27%,而C18∶2的含量则减少了34.15%,C18∶1和C18∶3 的含量基本保持不变,这就导致了实验组中饱和脂肪酸(saturated fatty acid,SFAs)含量上升,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)含量下降,单不饱和脂肪酸(monounsaturated fatty acid,MUFA)含量保持不变。12%的CO2作用下的实验组中不饱和度(degree of unsaturation,DU)为103.83,相比对照组下降了15.48%,可作为生产生物柴油的原料[37]。此外,WSE中所培养微藻脂肪酸的长链饱和因子(long chain saturation factor,LCSF)和冷滤点(cold filter plugging point,CFPP)如表2 所示。LCSF 是用来计算生物柴油的CFPP值的,CFPP值越低,生物柴油的低温流动性能越好。由于各国所处的环境不同,对CFPP 值也有不同的规定,而欧洲柴油标准并未对生物柴油的CFPP 值提出具体的要求,但我国(GB/T25199—2010)规定其值不高于-5~12℃。本实验结果表明,以WSE 为培养基,培养微藻得到的脂肪酸符合生产生物柴油的标准。
3 结论
本文研究了不同浓度的CO2对WSE 中单针藻Monoraphidium sp. QLZ-3 生长和油脂积累的影响。12%的CO2上调了rbcL 基因的表达量,加快了CO2的固定效率和多酚的吸收,同时上调了ACCase 和ME 的活性,下调了PEPC 的活性,提高了单针藻Monoraphidium sp.QLZ-3的生物量产率和油脂产率。综上,CO2联合WSE培养微藻,为微藻的工业化培养和核桃壳的综合利用提供了新的思路。

表2 不同CO2浓度对WSE中单针藻Monoraphidium sp.QLZ-3脂肪酸的组成的影响

