芦笋两性花与雄花的碳氮比及氮化合物相关基因可变剪接的差异分析
黄 玲,韦树谷,赖 佳,代顺冬,张骞方,曾华兰,刘 佳,刘 杭,叶鹏盛
(四川省农业科学院 经济作物育种栽培研究所, 蔬菜种质与品种创新四川省重点实验室,四川 成都 610300)
芦笋(AsparagusofficinalisL.)属于天门冬科天门冬属多年生植物,由于其具有较高的营养价值和较好的药用保健功能而深受人们喜爱[1]。芦笋雌雄异株,其性染色体处于植物性染色体进化途径的中间位置,性别表现出多种类型,包括雌株(XX)、雄株(XY)、超雄株(YY)和雄性雌型株(简称两性株,基因型为XY)。它们之间主要的差异表现在花器官上。雌花具有健全的雌蕊,但雄蕊高度退化;而雄花具有发育良好的雄蕊,但雌蕊发育不完全,有的形成花柱,无柱头,有的既无花柱也无柱头。两性花含有完整的雄蕊,雌蕊发育完全,含有子房、花柱和柱头,并能正常结实[2-4]。因此,两性花是研究植物花器官发育、性别决定与分化的特殊遗传材料[5]。此外,由于两性花自花或异花授粉(XY×XY→1YY +2XY +1XX),产生超雄株(YY)。以它作为父本产生的后代全部为雄株(XX×YY→XY )。已有研究表明,芦笋雄株产量较同期雌株高[6],因此培育全雄品种是芦笋育种的重要方向,而两性株是培育芦笋全雄品种的重要资源材料。但自然界中存在的两性株极少,这极大地限制了芦笋种质资源创新和全雄品种选育。因此,研究芦笋性别调控机理,将为促进两性花形成和丰富芦笋资源材料奠定基础。
已有研究表明,碳氮比与植物花芽性别分化相关[7-8]。碳氮化合物是植物花芽分化过程中重要的营养物质。20世纪初提出的碳氮比学说认为碳氮比对控制花芽分化起着重要作用[9]。在希尔核桃中,发现N的缺乏会加剧雌花败育,并且雌花败育时,2年生核桃枝条木质部中的氮和淀粉含量降低到最低点[10]。张建铭等[11]研究大花栀子花芽分化过程中碳氮比的变化,发现在花芽孕育期碳氮比急剧升高,推测碳氮比对于花芽孕育起着主要的作用。为探明芦笋两性花、雄花发育与碳氮化合物的关系,本研究比较分析了芦笋两性花与雄花不同发育阶段碳氮化合物含量及相关基因表达水平的动态变化,将有助于揭示芦笋两性花与雄花发育的调控机理。
1 材料和方法
1.1 试验材料
以芦笋品种冠军为试验材料,并将其种植于四川省农业科学院经济作物育种栽培研究所试验基地。在2016-2018年春季芦笋现蕾期-开花期进行形态学观察。在芦笋盛花期分别挑取20株正常生长且生长较一致的两性株和雄株,按照花蕾从小到大分为(0.7±0.1)mm,(1.5±0.1)mm,(2.0±0.1)mm,(3.5±0.1)mm共4个级别,在Leica S8APO体式显微镜下对其形态特征进行观察比较,每级观察30个花蕾。花蕾从植株上摘下后,立即观察,将花蕾一半的花瓣剥离,置于体式显微镜下观察拍照,对比同一时期的两性花、雄花花蕾的形态差异,具两性花特点并且后期结出果实的雄性雌型株标记为两性株。
1.2 碳氮化合物的测定
分别取两性株、雄株发育至性别分化与性别决定的前期(花蕾长度(0.7±0.1)mm)、中期(花蕾长度(1.5±0.1)mm)、后期(花蕾长度(2.0±0.1)mm)3个时期的花蕾2 g。样品烘干后研磨粉碎至0.15 mm,采用岛津NC-80型全自动碳氮分析仪测定两性花蕾与雄花蕾的碳、氮化合物总含量。
1.3 RNA 提取、文库构建和测序
分别提取两性花、雄花3个时期的花蕾总RNA。采用TRIzol(购于Invitrogen 公司)进行总RNA的提取。依据两性花、雄花发育时期的先后顺序,将各时期RNA 池分别标记为H1、H2、H3、M1、M2、M3。RNA-Seq测序由深圳华大基因研究院完成,采用 Hi Seq X10 测序。
1.4 数据分析方法
1.4.1 可变剪接事件鉴定 从芦笋基因组数据库下载芦笋全基因组序列及其注释文件(https://www.ncbi. nlm.nih.gov/genome/?term=Asparagus+officinalis+L.)。采用软件HISAT2将RNA-seq测序得到的高质量数据序列与芦笋基因组进行序列比对,使用rMATs软件对样品中可变剪接事件进行分类和统计。主要的可变剪接事件有5种:外显子跳跃、内含子滞留、5′端可变剪切位点、3′端可变剪切位点、互斥外显子。
1.4.2 发生可变剪接基因的功能注释及富集分析 对于雄花与两性花各发育时期中发生可变剪接的基因,本研究采用rMATS软件分析了各样本中共有及特有的可变剪接基因数量。应用TermFinder软件,获得包括生物学过程(Biological process)、分子功能(Molecular function)和细胞构成(Cellular component)等类别的GO 注释编号。利用在线工具(http://www.omicshare.com/tools/Home/Soft/gogsea)进行功能富集分析,统计每个GO类别中基因与背景基因间的差异,并对P值进行校正。定义校正后的P≤0.05为该基因集在此GO项中显著富集。
2 结果与分析
2.1 芦笋两性花、雄花形态差异的分析
利用体式显微镜观察芦笋两性花、雄花的4个不同发育时期(花蕾长度分别为(0.7±0.1)mm,(1.5±0.1)mm,(2.0±0.1)mm,(3.5±0.1)mm)的形态特征(图1),显示了由两性花向单性花发育的动态变化过程。芦笋两性花、雄性花蕾在发育前期(0.7±0.1)mm的花器官中均既有雄蕊又有心皮。当花蕾发育至1.5 mm时,两性花中雌蕊花柱开始发育,出现了明显的花柱和柱头,而雄花中未见花柱及柱头。当花蕾发育至2.0 mm时,两性花的雄蕊继续发育,花丝伸长,子房继续膨大,分化出花柱并伸长,形成明显的柱头;而雄花中雄蕊继续发育,花丝伸长,花柱和柱头发育受阻,不形成花柱和柱头。当花蕾发育至3.5 mm时,两性花已发育完全,有发育良好的雄蕊、子房、花柱和柱头;而雄花中雄蕊发育良好,子房发育停滞,不形成花柱和柱头。Caporali等[12]利用电子显微镜观察比较了芦笋不同发育时期的雌、雄花形态,发现芦笋花蕾由两性花向单性花转变时的形态特点是花柱开始发育。本研究发现花蕾长度约1.5 mm时为两性花的花柱开始发育,表明花蕾长度为1.5 mm时,是两性花向单性花转变的关键时期。
2.2 芦笋两性花、雄花碳氮化合物含量的差异分析
通过测定芦笋两性花与雄花在性别分化的前期、中期、后期3个时期花蕾中碳氮化合物含量(表1),发现在性别分化的前期、中期,两性花蕾中碳含量均低于雄花蕾,但差异不显著,氮含量显著高于雄花蕾,特别是在性别分化中期的差异较大;在性别分化后期,两性花蕾中碳含量与雄花蕾相当,但氮含量仍然显著高于雄花蕾。在芦笋两性花发育的整个过程中C/N比值始终低于雄花,并且在性别分化的中期、后期差异达到显著水平。可见,两性花中雌蕊的发育需要较高的氮素,即较低的C/N比值有利于雌蕊的发育。两性花中碳含量随着花发育先降低后升高,雄花中碳含量的变化趋势与两性花中一致。两性花中氮含量随着花发育逐渐降低,雄花中氮含量先降低后略有升高。
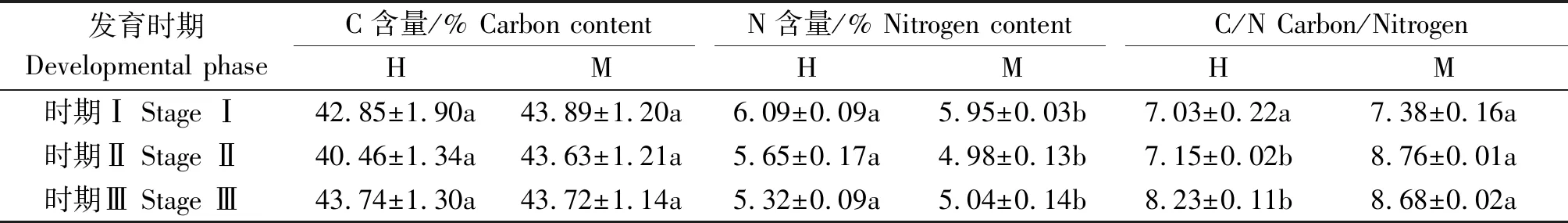
表1 芦笋两性花与雄花不同发育时期碳氮化合物含量的变化Tab.1 The dynamics of the carbon and nitrogen compound content in hermaphroditic flowers and male flowers of asparagus at different developmental stages
注:时期Ⅰ为花蕾发育至0.7 mm;时期Ⅱ为花蕾发育至1.5 mm;时期Ⅲ为花蕾发育至2.0 mm。H.两性花;M.雄花。表中数据为平均值±标准差,采用T检验法检验了数据显著性(P<0.05),同一发育时期相同指标不同小写字母表示两性花与雄花差异显著。
Note:Stage I represents the flower bud development to 0.7 mm; Stage Ⅱrepresents the flower bud development to 1.5 mm; Stage Ⅲ represents the flower bud development to 2.0 mm. H. The hermaphroditic flower; M. The male flower. The data in the table are average±standard deviation, the significance of the data is tested byT-test(P<0.05). Different lowercase letter represents significant difference between the hermaphroditic flower and male flower in the some index at the same stage.
2.3 芦笋两性花、雄花氮化合物相关基因可变剪接事件的差异分析
为了解芦笋两性花、雄花中发生可变剪接基因的功能,对所有发生可变剪接的基因进行了GO分析。结果表明,芦笋两性花与雄花相比,其特有可变剪接基因显著富集到细胞氮化合物代谢过程、有机氮化合物代谢过程和细胞氮化合物生物合成过程等5条氮化合物代谢相关的GO条目中,共包含相关基因86个(表2),而雄花特有可变剪接基因在此GO条目中没有富集,反映了氮化合物代谢相关的GO条目与芦笋两性花发育的关系十分紧密。

表2 芦笋两性花特有可变剪接基因中氮化合物代谢相关基因的GO分类信息Tab.2 GO classification information of nitrogen compound related genes only in alternative splicing genes specific to asparagus hermaphroditic flower
找到芦笋两性花特有的可变剪接基因中86个氮化合物代谢相关基因在芦笋参考基因组上的注释信息(表3),发现它们主要为编码核糖体蛋白基因、MADS-box转录因子和一些酶类物质等,其中以编码核糖体蛋白基因数量最多。表明,芦笋两性花的形成与核糖体蛋白基因、MADS-box转录因子和一些酶类物质等氮化合物代谢相关。

表3 芦笋两性花特有可变剪接基因中氮化合物代谢相关基因的注释信息Tab.3 The annotation information of nitrogen compound related genes in alternative splicing genes specific to asparagus hermaphroditic flowers
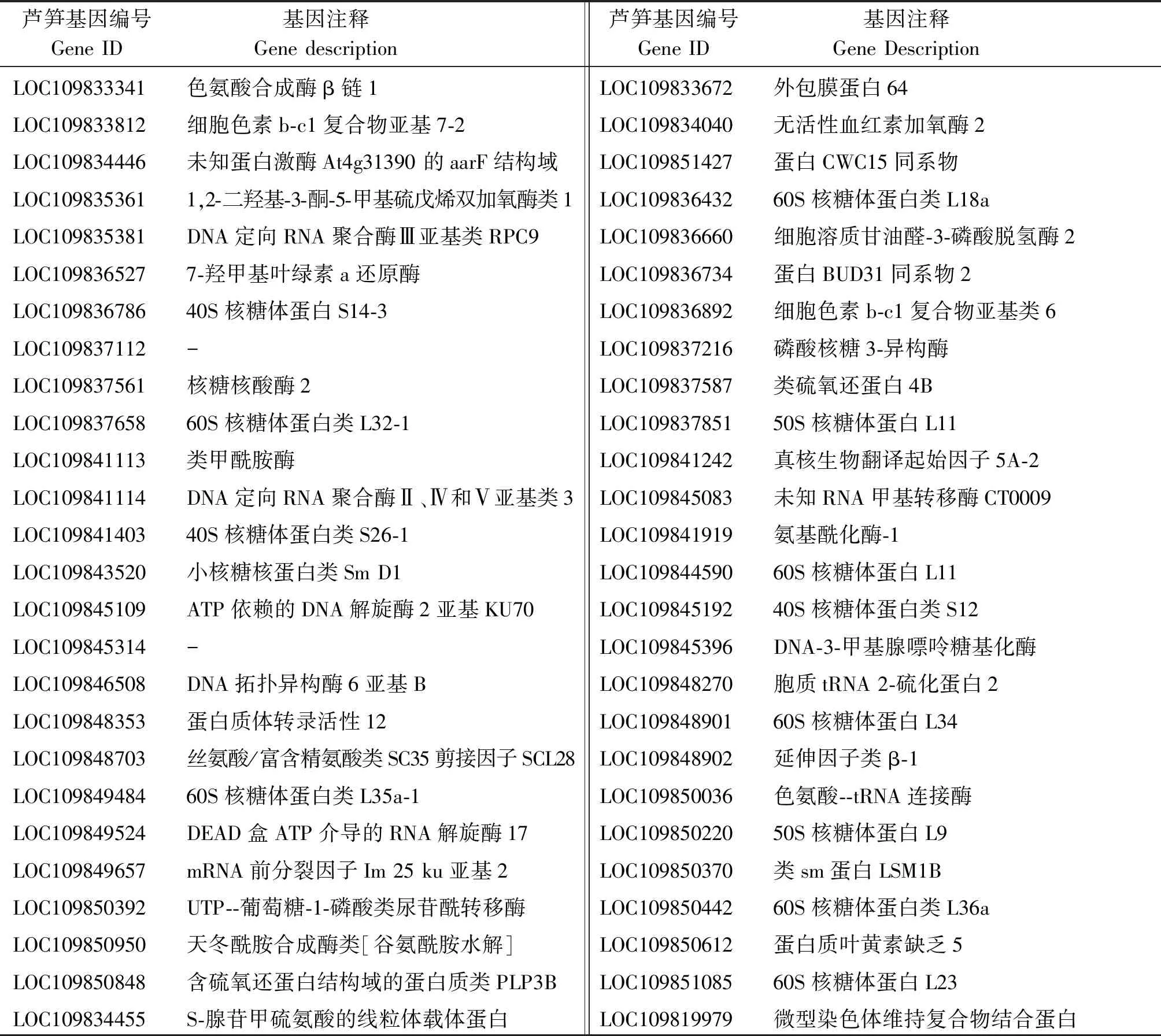
表3(续)
芦笋两性花特有可变剪接基因中86个氮化合物代谢相关基因在3个发育时期均发生了可变剪接事件,并且3个发育时期内共发生了374个可变剪接事件(表4)。进一步反映了可变剪接与氮化合物合成相关基因表达的关系非常密切。这些基因发生可变剪接的类型主要有5种,其中以A3SS类型最多,A5SS次之,MXE最少。并且在不同的发育时期,大多数基因发生可变剪接事件的类型和次数存在差异。86个基因发生可变剪接事件的时间主要在两性花性别分化前期,该时期中发生了2次及以上可变剪接的基因有37个,而在两性花性别分化的中期和后期分别有29,30个。这些剪接事件在雄花中并未检测到,说明氮化合物代谢相关基因可能与两性花的形成相关。基因发生可变剪接以后可能引起其编码蛋白的含量及功能改变,这一结论正好与前面试验中检测到芦笋两性花与雄花蕾中氮化合物含量存在差异相吻合。
2.4 芦笋两性花发生特有可变剪接的氮化合物相关基因表达分析
依据FPKM值,进一步分析了上述氮化合物代谢相关基因在芦笋两性花与雄花中的表达情况(图2)。结果表明,在芦笋两性花与雄花的不同发育时期这86个氮化合物代谢相关基因的表达量均存在差异。与雄花蕾相比,在两性花性别分化的前期、中期,分别有52,47个氮化合物代谢相关基因高表达;而在两性花性别分化后期,略高于雄花蕾的氮化合物代谢相关基因只有38个。这与两性花蕾中含氮量高于雄花蕾的差异一致。说明在性别分化的前期、中期,两性花蕾中氮化合物代谢相关基因的高表达,可能引起了氮化合物含量的增加。这进一步表明芦笋两性花与雄花中氮化合物代谢相关基因的差异表达可能是引起它们性别分化差异的重要因素。
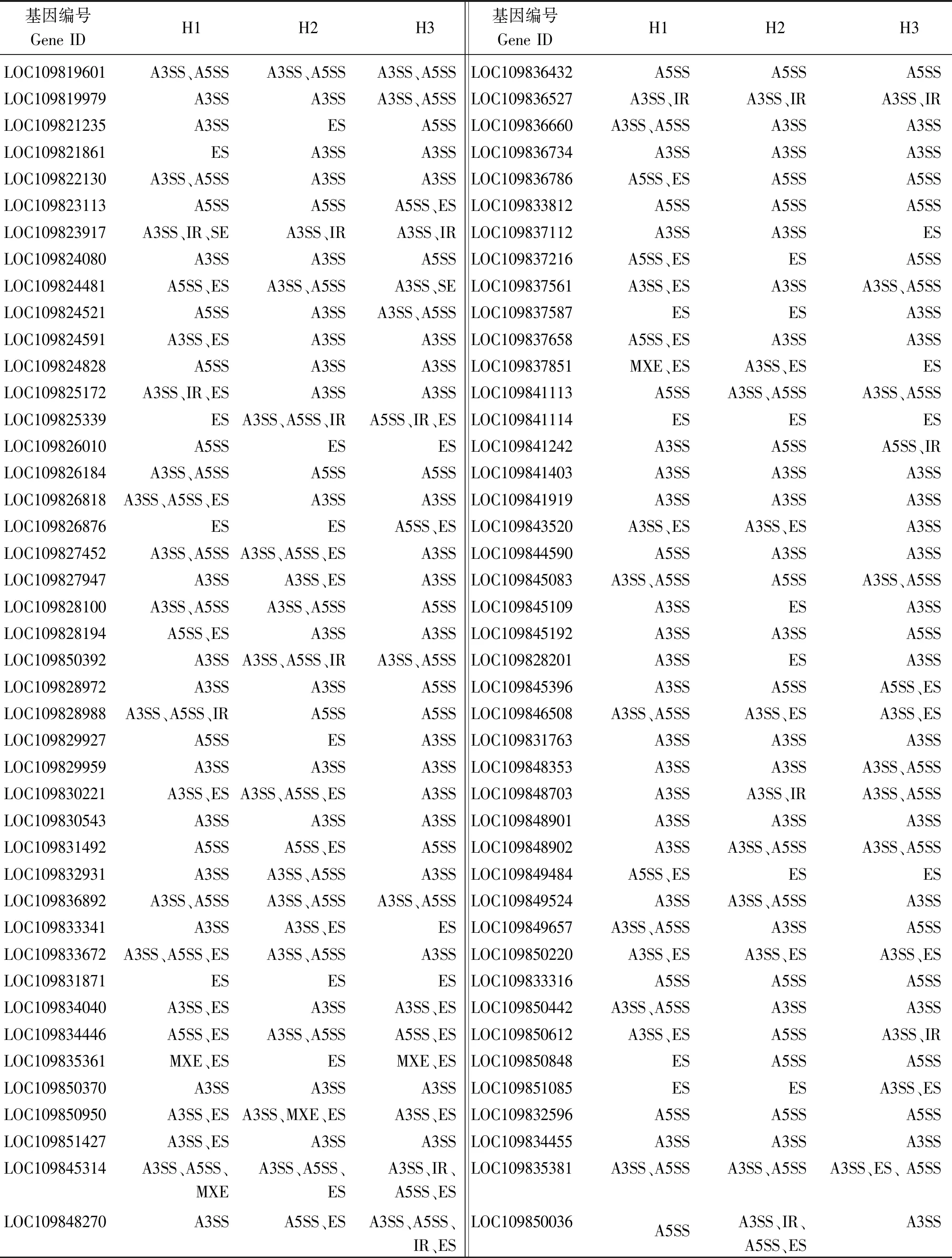
表4 芦笋两性花特有可变剪接基因中氮化合物代谢相关基因的可变剪接类型Tab.4 The alternative splicing types of nitrogen compound related genes in alternative splicing genes specific to asparagus hermaphroditic flowers
注:A3SS.3′端可变剪切位点; ES.外显子跳跃; IR.内含子滞留;A5SS.5′端可变剪切位点; MXE.外显子互斥。
Note:A3SS.Alternative 3′ splice site;ES.Exon skipping;IR.Intron retention;A5SS.Alternative 5′ splice site;MXE.Mutually exclusive exon.

图2 芦笋两性花、雄花蕾中氮化合物相关基因的表达量差异Fig.2 Expression differences of nitrogen compound related genes in the hermaphroditic and male flower buds
此外,在芦笋两性花发育进程中,86个氮化合物代谢相关基因中有67个基因表达量在性别分化中期低于性别分化前期,有44个基因表达量在性别分化后期低于性别分化中期,这与两性花中氮化合物含量逐渐降低的变化趋势一致。在芦笋雄花由性别分化前期到中期的过程中,有56个基因表达量降低;在性别分化中期到后期的过程中,有34个基因表达量降低,31个基因表达量略有升高,这与雄花中氮化合物含量先降低后略升高的变化趋势一致。
3 讨论
在众多的植物花芽分化研究理论中,碳氮比理论认为碳氮比对植物花性别的分化有较大的影响[8,11]。肖华山等[7]发现荔枝花中较小的C/N比值和较高的氨基酸含量有利于雌蕊分化。李利红等[13]发现杏花雌蕊发育较好则其氨基酸含量也较高。本研究测定了两性花与雄花在性别分化的前期、中期、后期3个时期花蕾中碳氮化合物含量,发现在3个发育时期,两性花蕾中含氮量一直高于雄花蕾,且在性别分化中期差异达到最大。在性别分化前期、中期,两性花蕾中含碳量低于雄花蕾;在性别分化后期,含碳量与雄花蕾相当。可见,较小的C/N比值有利于芦笋两性花雌蕊的分化。
已有研究表明,芦笋性别是由雌性抑制基因(SOFF)和雄性特异基因(aspTDF1)构成的“双基因座模型”调控[14-15],除了这2个性别决定基因以外,有研究者认为在芦笋两性花中还存在一些性别修饰基因[16],这些基因受环境因子的影响[17]。同一两性单株在不同年份不同季节开的花,其发育程度、结实性也存在一定的差异[5]。这些现象说明环境条件影响了与两性花中性别修饰基因的表达。可变剪接能够通过调节基因的表达,造成蛋白质组多样性,从而对植物生长发育起着重要的作用[18]。本研究分析了芦笋两性花与雄花3个发育时期中基因的可变剪接,发现有86个氮化合物相关基因只在两性花中发生了可变剪接,这些基因编码核糖体蛋白、MADS-box转录因子和一些酶类物质等。核糖体是遗传物质翻译、合成蛋白质的场所。在荔枝雄花雌蕊原基的衰败过程中首先是核糖体降解[19]。核糖体蛋白是组成核糖体的主要成分,在植物胚胎发育、花器官发育尤其是雌配子体发育等方面发挥重要作用[20]。MADS-box基因也在植物花性别分化、花器官发育方面起着重要作用[21-23]。由此可见,芦笋两性花的性别分化、雄花的性别决定与核糖体蛋白基因、MADS-box转录因子等氮化合物基因相关。进一步分析发现在两性花性别分化的前期、中期,分别有52,47个氮化合物代谢相关基因高表达,而在雄花中低表达。在两性花性别分化后期,有38个氮化合物代谢相关基因表达量略高于雄花蕾。这与两性花蕾中含氮量高于雄花蕾的差异一致。刘孟等[24]也发现芦笋雌花发育过程中氮化合物多胺含量高于雄花,并认为高水平多胺与芦笋雌性器官发育相关。这进一步表明氮化合物与芦笋两性花、雄花的发育密切相关。但含氮化合物相关基因调控两性花发育的机理还有待深入研究。
综上所述,芦笋两性花中性别决定基因可能直接或间接的调控了氮化合物代谢相关基因的表达,一方面通过可变剪接调节相关基因转录本的多样性,另一方面通过改变相关基因的表达量,这些调控机制造成了两性花中氮化合物含量高于雄花,最终使得两性花与雄花的形态结构不同。研究结果不但揭示了芦笋两性花与雄花发育调控机制的差异,更为人为调控两性花的形成提供了理论依据。
——防口干

