MRI-DWI对胰腺癌冻切术后治疗效果的鉴别诊断价值分析
吴盛赞 汪建华 吴元华 张力彬 葛明亮


[摘要] 目的 探讨磁共振弥散加权成像(MRI-DWI)对胰腺癌冻切术后治疗效果的鉴别诊断价值分析。 方法 选取2015年6月~2018年6月病理诊断为胰腺癌并接受氩氦刀冷冻治疗的患者20例为研究对象,进行MRI-DWI检查扫描,观察胰腺癌肿瘤组织在冷冻术前后MRI-DWI信号改变,对比正常胰腺组织、术前及术后肿瘤组织、坏死组织的表现弥散系数(ADC)值。对肿瘤组织ADC值与肿瘤大小的相关性进行评价,同时评估不同肿瘤位置、肿瘤直径及分期ADC值的差异。 结果 术后肿瘤组织在T1WI呈低信号而在T2WI为高信号,在DWI反而也是低信号,动态增强时没有明显强化。b值取800 s/mm2时,正常胰腺组织和胰腺肿瘤的ADC值分别是(1.914±0.113)×103 mm2/s和(1.037±0.105)×103 mm2/s。经对比发现胰腺肿瘤ADC值与肿瘤不同直径范围有关,与肿瘤分期、位置无关。 结论 MRI-DWI能有效鉴别胰腺癌切冻术后的肿瘤组织坏死及残存,为进一步临床诊治提供依据。
[关键词] 磁共振弥散加权成像;鉴别价值;表现弥散系数;肿瘤组织;残存率
[中图分类号] R735.9 [文獻标识码] B [文章编号] 1673-9701(2020)05-0123-04
The value of MRI-DWI in differential diagnosis of treatment effect in pancreatic cancer after cryotherapy
WU Shengzan WANG Jianhua WU Yuanhua ZHANG Libin GE Mingliang
Department of Radiology, Affiliated Hospital of Ningbo University Medical College, Ningbo 315000, China
[Abstract] Objective To investigate the value of magnetic resonance diffusion-weighted imaging (MRI-DWI) in the differential diagnosis of treatment effect in pancreatic cancer after cryotherapy. Methods Twenty patients with pathological diagnosis of pancreatic cancer who underwent argon-helium cryoablation from June 2015 to June 2018 were enrolled in the study. They were treated with MRI-DWI scan. The MRI-DWI signal changes of pancreatic cancer tissues before and after cryotherapy were observed. The apparent diffusion confficient (ADC) of normal pancreatic tissue, preoperative and postoperative tumor tissue, necrotic tissue were compared. The correlation between tumor tissue ADC value and tumor size was evaluated, and the differences in ADC values of different tumor location, tumor diameter, and staging were evaluated. Results Postoperative tumor tissue showed low signal on T1WI and high signal on T2WI, but also low signal on DWI. There was no obvious enhancement when dynamic enhancement. When the b value was 800 s/mm2, the ADC values of normal pancreatic tissue and pancreatic tumor were(1.914±0.113)×103 mm2/s and (1.037±0.105)×103 mm2/s, respectively. It was found that the ADC value of pancreatic tumor was related to tumor size and tumor diameter range, and was not related to tumor stage and location. Conclusion MRI-DWI can effectively identify tumor tissue necrosis and residual after pancreatic cancer cryotherapy, which provides a basis for further clinical diagnosis and treatment.
[Key words] Magnetic resonance diffusion weighted imaging; Differential diagnosis value; Performance diffusion coefficient; Tumor tissue; Residual rate
近年来,随着生活水平质量的提高,消化系统疾病的发病率逐年升高[1],其中胰腺癌为我国城乡居民发病率较高的癌症之一。胰腺癌具有位置深、早期症状不明显、恶性程度高、死亡率高、生长快等特点,患者发现时大多数已经为晚期[2],且胰腺癌術后五年生存率依然低于5%[3]。因此,对于胰腺癌的早期诊断决定了其预后和治疗的关键问题[4]。目前,传统的诊断胰腺癌的技术难以满足其诊断要求,但是利用磁共振弥散加权成像(MRI-DWI)能够解决传统诊断的不足,并且有助于将胰腺癌与肿瘤作出区别[5]。磁共振成像(magnetic resonance imaging,MRI)[6]是一种评估胰腺癌的影像学方法,扩散加权成像(diffusion-weighted imaging,DWI)是一项能够将MRI进行形态学评估且能反应病变内部结构和病理变化的功能磁共振技术[7,8]。MRI-DWI的原理是通过图像的形式从分子水平检测活体组织内水分子的运动状态,从而对胰腺癌做出诊断。随着磁共振技术的发展,许多研究者对MRI-DMI在胰腺癌诊断及治疗进行了研究,本文目的是采用MRI-DWI技术,观察记录并对比胰腺癌患者肿瘤组织分别于冻前、术后消融区信号及ADC值的变化[9],并初步探究MRI-DWI对评估胰腺癌于冷冻术后鉴别价值的意义,为临床治疗方案的选择提供支持,为分析患者预后等情况提供更有效的应用价值。
1 资料与方法
1.1 一般资料
于2015年6月~2018年6月筛选并收集本院收治的病理诊断为胰腺癌并接受氩氦刀冷冻治疗的患者20例。纳入标准:(1)均经病理活检证实并经影像学及实验室检查确诊为胰腺癌;(2)18~90岁;(3)均无心肺肝肾等脏器衰竭情况;(4)经外科医生会诊无手术指征或者自身拒绝姑息性手术治疗。剔除标准:(1)肿瘤内有明显液化坏死患者;(2)因不同病因无法准确测量病灶的ADC值患者;(3)碘对比剂过敏患者;(4)有明确磁共振检查禁忌证患者;(5)不符合上述诊断标准者。其中以上符合纳入标准的病例,均签署知情同意书,且本研究已经经医院医学伦理委员会审核批准。其中平均年龄(49.74±2.18)岁,男7例,女13例,所有患者经病理检查诊断为胰腺癌,肿瘤位置在胰头及钩突部4例,胰体尾部9例,头体及尾部均累及7例;肿瘤直径≤5.0 cm 5例,超过5.0 cm 15例;肿瘤Ⅱ期10例,Ⅲ期5例,Ⅳ期5例。
1.2 方法
1.2.1 MRI-DWI检查方法 首先使用3.0T超导核磁共振机扫描患者的腹部[10],同时利用体部表面相控阵线圈(采集中心对准股骨大转子)。扫描序列如下:①定位扫描;②冠状T2WI;③常规轴位T2WI压脂和T2WI压脂;④常规轴位T1WI同反相位;⑤动态增强三维容积GRE T1WI压脂序列。其次采用平面回波序列分别对A、B组患者进行扩散加权成像扫描,扫描参数为:TR 1500 ms,FOV 285 mm×380 mm,TE 104 ms,b值设置为50、400和800 s/m2,层厚6 mm。检查过程中使用0.15 mL/kg钆喷酸葡胺注射液作为增强扫描静脉注射剂。
1.2.2 病理检查方法 在体表超声或超声内镜的引导下,采用一次性半自动活检针,其中针头型号为16G(1.6 mm),针头可根据肿瘤物大小在1 cm和2 cm档位切换。随后进行探查,首先应明确腹盆腔内脏器腹膜和表面是否有种植转移灶,若无转移灶,使用活检针和注射器在肿瘤物上行3个穿刺点穿刺,接着将注射器内组织进行细胞学涂片,最后利用乙醚-乙醇试剂固定后对其进行HE染色。整个检查过程应控制在30 min内完成。
1.3 图像处理方法和评估方法
将b=0、800 s/mm2时软件自动生成图像后处理,确定ADC值。根据T2WI图像划定界限,对检测出的肿瘤区域最大范围地选择测量区(ROI),对该区域3次测量ADC值随后取平均值,选取测量区时尽量避开囊性和胰管病变区域。判断肿瘤是否坏死的判断依据是冷冻术后肿瘤组织动态增强是否发生强化的情况发生[5]。
1.4 统计学方法
采用美国GraphPad Prism5.0软件对数据进行处理,计量资料以(x±s)表示,采用Mann-Whitney检验对比胰腺癌病灶组织、正常胰腺组织以及手术前后损坏组织ADC值,采用t检验对病灶组织的不同直径、分期、位置肿瘤组织与ADC值相关性作比较。P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌手术前后MRI-DWI与病理结果比较
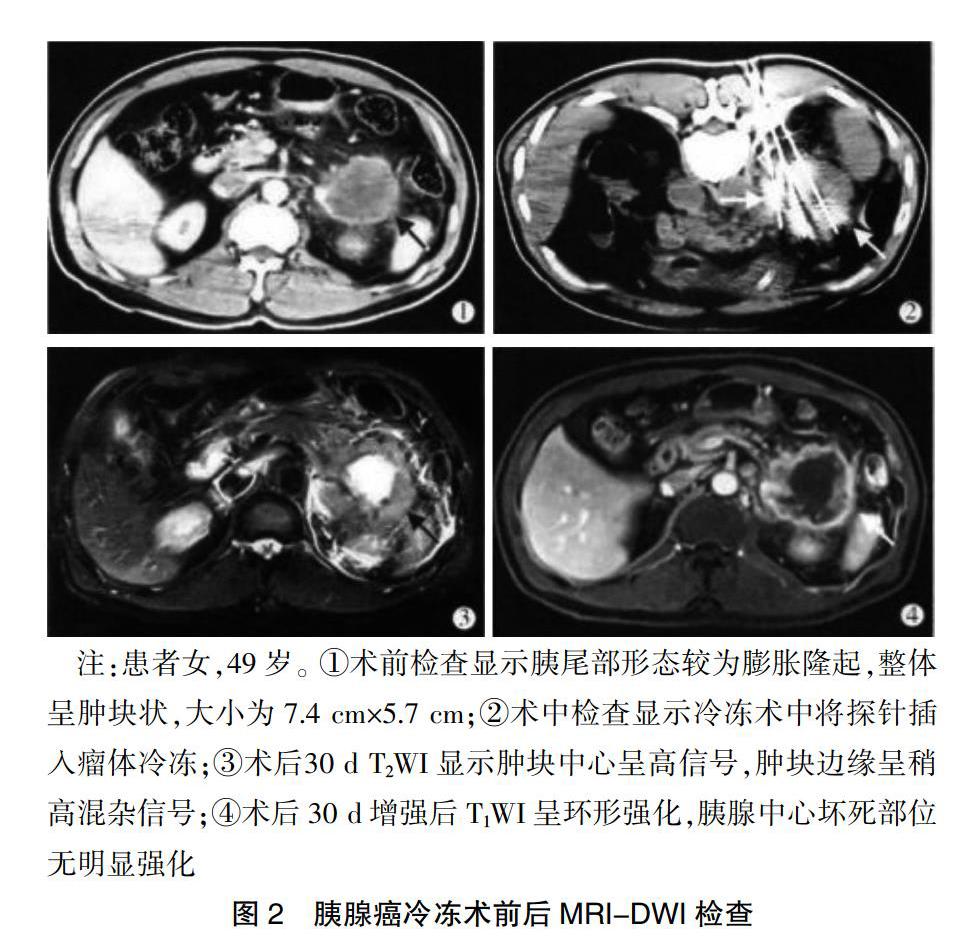
2.1.1 胰腺癌手术前后MRI-DWI结果比较 对研究对象进行MRI-DWI检查。于胰腺癌冷冻术后22~55 d对研究对象进行MRI-DWI检查。相较于正常胰腺组织(图1),术前胰腺组织在T1WI序列呈现较低信号,在T2WI序列呈不均匀且稍高信号,在DWI呈现较高且动态增强时发生不均匀强化。由冷冻术后肿瘤组织MRI-DWI检查来看,肿瘤组织在T1WI和T2WI分别呈低、高信号,而在DWI反而是低信号且动态增强时并没有明显强化(图2)。
2.1.2 胰腺癌手术前后病例结果比较 经MRI-DWI检查结果显示,均检查出胰腺癌患者中12例肿瘤完全坏死。经MRI-DWI检查后,余下8例猜测有活性肿瘤组织残留,肿瘤残留率为45%。检查结果显示,肿瘤残留部位位于胰体尾部5例,胰头及钩突部3例;肿瘤直径≤5.0 cm 3例,直径>5.0 cm 5例。
将检查出仍有活性肿瘤组织残留患者的行二次冷冻术,术中同时将肿瘤组织送至病理检查。病理检查结果显示,二次冷冻术后,肿瘤组织大部分被消除,另有一部分仍有活性肿瘤组织残留,该检查结果与MRI-DWI检查结果一致(封三图5)。随访6个月后,12例经冷冻术后肿瘤完全坏死的患者,未见其肿瘤复发。
2.2 胰腺癌手术前后ADC值比较
将研究对象的胰腺组织比较,b值取800 s/mm2时,正常胰腺组织和肿瘤组织的ADC值分别是(1.914±0.113)×103 mm2/s和(1.037±0.105)×103 mm2/s。經对比发现肿瘤ADC值与肿瘤分期、位置无关,而与肿瘤直径范围有关,见表1。
3 讨论
随着生活水平的提高,消化系统疾病发病率逐年攀升。其中胰腺疾病是最常见的消化系统疾病,胰腺癌因其恶性程度高、病程短、进展快等特点被排名为中国十大常见肿瘤之一。经研究统计,吸烟是导致胰腺癌重要危险因素,长期吸烟的人患胰腺癌的几率远大于不吸烟人群,除此之外,高热量的饮食习惯同样易导致胰腺癌。经调查发现大部分胰腺癌患者发现肿瘤时通常已失去最佳根治性切除时机,这类患者常需要采用辅助或保守治疗[11]。
冷冻切除术是指通过微血管栓塞、物理杀伤和冷冻后免疫作用来灭活肿瘤组织。这是一种及时并有效治疗中晚期胰腺癌的手段[12],常用于治疗侵犯重要血管、放化疗疗效不佳、无法耐受手术和无法手术切除的胰腺肿瘤等疾病[13]。检查是否有肿瘤组织残存是目前用于评估胰腺癌冷冻术后疗效的最主要方法。目前临床上主要使用CT、MRI、PET-CT和MRI-DWI等影像学技术来诊断胰腺癌,这些诊断技术各有利弊[14]。其中MRI-DWI是通过对不同组织中水的ADC的检测来确定细胞的完整性和结构,从而通过ADC值的差异来判断肿瘤治疗前后是否有结构变化。目前,在胰腺癌方面,MRI-DWI主要是胰腺癌诊断和鉴别方面[15,16],但针对胰腺肿瘤冷冻术后的评估还没有较多文献报道。
本研究将冷冻术前后胰腺癌患者胰腺组织MRI-DWI检查相比较,发现术前胰腺组织在T1WI序列呈现较低信号,在T2WI序列呈不均匀且稍高信号,在DWI呈现较高且动态增强时发生不均匀强化。由冷冻术后肿瘤组织MRI-DWI检查来看,肿瘤组织在T1WI和T2WI分别呈低、高信号,而在DWI反而是低信号,且动态增强时并没有明显强化。同时将ADC值比较发现,肿瘤组织ADC值的变化则是术后显著高于术前,这是由于与正常胰腺组织相比,癌细胞内与外之间的水分子运动受到限制[17-20],该实验数据结果与种欢欢[21]的研究结果一致。将MRI-DWI与病理检查结果比较,研究发现,在诊断胰腺肿瘤组织是否有残留时,诊断结果一致,其中MRI-DWI检查比病理检查能够准确判断残留肿瘤组织位置和大小。同时,将MRI-DWI技术与ADC值结合,能够准确判定冷冻治术后肿瘤组织的坏死与残存,本文将研究对象的胰腺组织比较,b值取800 s/mm2时,正常胰腺组织和肿瘤胰腺组织的ADC值分别是(1.914±0.113)×103 mm2/s和(1.037±0.105)×103 mm2/s。经对比发现肿瘤ADC值与肿瘤分期、位置无关,而与肿瘤直径有关,在关于MRI-DWI相关文章叙述相同[22]。另外,在胰头处直径>5.0 cm的肿瘤术后残存率相较于其他肿瘤更高,说明胰腺癌患者应进行早期检查,及早发现肿瘤并及时接受治疗。
综上所述,MRI-DWI不仅能够清晰准确地判断出胰腺肿瘤的位置,对于经冷冻术后的直径较小的肿瘤组织也能清晰显示出位置,并对其ADC值进行定量分析,为临床上区别正常胰腺组织和胰腺肿瘤组织提供准确的参考。由此说明,MRI-DWI信号结合ADC值定量分析能够辅助鉴别诊断冷冻术处理后肿瘤的坏死与残存,并为临床治疗提供参考依据。
[参考文献]
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(1):115-132.
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].Cancer J Clin,2016,58(3):71-96.
[3] 李忠海,曾健滢,陈梓晴,等. 磁共振弥散加权成像观察胰腺癌冷冻术后近期疗效的应用价值[J].介入放射学杂志,2017,26(2):142-146.
[4] 种欢欢,兰晓莉. PET/CT在胰腺癌诊治中的应用及与增强CT和 MRI的比较[J]. 中华核医学与分子影像杂志,2017,37(10):654-659.
[5] Iannicelli E,Di Pietropaolo M,Pilozzi E,et al. ValHe of diffusion-weighted MRIand apparent diffusion coefficient measurements for predicting the response of locally advanced rectal cancer to neoadjuvant chemoradiotherapy[J].Abdom Radiol(NY),2016,41(2):1906-1917.
[6] 张华,姚振威. 磁共振灌注加权成像在胰腺癌中的应用研究进展[J]. 中国医学计算机成像杂志,2016,22(1):83-86.
[7] 徐光如,张明辉,朱红星,等.磁共振ADC值评价肝硬化合并肝癌介入治疗后肝功能储备的初步研究[J].介入放射学杂志,2013,22(3):36-39.
[8] Kizildag Yirgin I,Amlan G,Ozturk,et al. Diffusion weighted Mr imaging of breast and correlation of prognostic factors in breast cancer[J]. Balkan Med J,2016,33(2):301-307.
[9] 李忠海,曾健滢,陈梓晴,等. 磁共振弥散加权成像观察胰腺癌冷冻术后近期疗效的应用价值[J].介入放射学杂志,2017,26(2):142-146.
[10] 苏天昊,申皓,靳二虎,等. 3.0 T质子磁共振波谱在评价胰腺疾病中的临床应用[J].临床放射学杂志,2012,1(52):52-55.
[11] 张瑜,张火俊,居小萍,等.磁共振扩散加权成像在局部进展期胰腺癌射波刀治疗疗效评估中的应用[J]. 中华胰腺病杂志,2016,16(2):127-130.
[12] Niu L,Chen J,He L,et al. Combination treatment with comprehensive cryoablation and immunotherapy in metastatic pancreatic cancer[J]. Pancreas,201342(4):1143-1149.
[13] 李登华.磁共振弥散加权成像在胰腺癌影像诊断中的应用[J]. 医学影像与临床检验,2017,4(2):334-335.
[14] Boll DT,Merkle EM.Differentiating a chronic hyperplastic mass from pancreatic cancer:A chMlenge remaining in multidetector CT of the pancreas[J]. Eur Radiol,2015, 13(2):M42-M49.
[15] 丁庆国,陆志华,贾传海,等.磁共振扩散加权成像对胰腺癌的诊断价值[J]. 中国临床醫学影像杂志,2012,23(2):358-360.
[16] 宋琦,刘玉,胡曙东,等.磁共振弥散加权成像在125I粒子组织间植入治疗胰腺癌疗效评估中的应用[J].介入放射学杂志,2016,21(1):492-497.
[17] Lee SS,Byun JH,Park BJ,et al. Quantitative analysis of diffusion weighted magnetic resonance imaging of the pancreas:Usefulness in characterizing solid pancreatic masses[J]. J Magn Reson Imaging,2008,28(4):928-936.
[18] Fattahi R,Balci NC,Permml WH,et al. Pancreatic diffusionweighted imaging(DWI):Comparison between mass-forming focal pancreatitis(FP),pancreatic cancer(PC),and normal pancreas[J]. J Magn Reson Imaging,2009,29(2):350-356.
[19] Matsuki M,Inada Y,Nakai G,et al.Diffusion-weighed MR imaging of pancreatic carcinoma[J]. Abdom Imaging,2017,32 (4):481-483.
[20] Muraoka N,Uematsu H,Kimura H,et al. Apparent diffusion coefficient in pancreatic cancer:Characterization and histopathological correlations[J]. J Magn Reson Imaging,2017,27 (6): 1302-1308.
[21] 种欢欢,兰晓莉. PET/CT在胰腺癌诊治中的应用及与增强CT和MRI的比较[J]. 中华核医学与分子影像杂志,2017,37(10):654.
[22] 张华,姚振威. 磁共振灌注加权成像在胰腺癌中的应用研究进展[J]. 中国医学计算机成像,2016,22(1):83-86.
(收稿日期:2019-02-22)

