Fe(II)-H2O2-双吡啶阻抑光度法测定食品中的微量过氧化氢
黎克纯,凌敏,张颜,刘细祥, *
1. 广西民族大学化学化工学院(南宁 530006);2. 广西多糖材料与改性重点实验室(南宁 530006)
过氧化氢作为一种强氧化剂,由于其具有漂白、防腐和除臭等作用,所以过氧化氢被广泛应用于食品工业中[1-2]。食品加工过程中残留的过氧化氢威胁着消费者的身体健康,建立过氧化氢含量的测定方法对食品安全与检测工作具有十分重要的意义。目前,过氧化氢的检测方法主要有滴定法[3]、分光光度法[4]、高效液相色谱法[5]、荧光法[6]等。近年来,基于Fe(III)的显色反应测定还原性物质已有报道[7-8],然而依据Fe(II)显色反应测定还原性物质却鲜有报道。由芬顿反应可知,Fe(II)在酸性条件下可以与过氧化氢反应;与此同时,BPY是Fe(II)的一种高效络合剂且生成具有明显的红色络合物[9]。基于此,试验拟采用过氧化氢氧化Fe(II),探究过氧化氢含量与Fe(II)-BPY显色体系吸光度减少量之间的关系,从而建立一种新型阻抑光度法来测定食品中微量过氧化氢。该方法可为食品中微量过氧化氢快速测定技术的开发提供技术参考。
1 试验部分
1.1 仪器与试剂
721N可见分光光度计(上海精科仪器有限公司)。
H2O2标准溶液:取0.1 mL H2O2(30%)稀释至1 000 mL,用高锰酸钾标准溶液标定至准确浓度;Fe(II)标准使用液(20 mg/L);2, 2’-联吡啶(BPY)(2 g/L);HAc-NaAc缓冲溶液(pH 3.58)。以上试剂均为分析纯,试验用水均为去离子水。
1.2 试验方法
分别向两支25 mL比色管中加入适量的Fe(II)标准使用液,然后向其中1支加入一定量的H2O2储备液,另外1支不加,用力振荡1 min后,再分别加一定量的BPY溶液,定容至刻度并摇匀,显色15 min。以蒸馏水为参比,用1 cm比色皿在波长522 nm处分别测定空白溶液(不含H2O2体系)和样品溶液(含H2O2体系)吸光度为A0和A。ΔA=A0-A。
2 结果与讨论
2.1 吸收光谱
按照1.2试验方法分别绘制空白溶液和含有不同浓度H2O2的样品溶液显色后在波长400~600 nm范围内的吸收光谱曲线,图谱结果见图1。图1表明,空白溶液和含有H2O2的样品溶液显色后的最大吸收波长均出现在522 nm处,且此处的ΔA最大,因此选用522 nm为测定波长。

图1 不同H2O2浓度显色体系的吸收光谱
2.2 测定条件的选择
2.2.1 pH的选择
按照1.2试验方法,分别用0.1 mol/L HCl和0.1 mol/L NaOH将Fe(II)-H2O2反应体系调节至不同pH,然后加入适量的显色剂BPY,考察不同pH对ΔA的影响,结果如图2所示。结果表明,当pH为3.5时,体系ΔA最大。这是由于H2O2为含氧型氧化剂,酸性条件更利于H2O2-Fe(II)反应体系的进行,因此,此反应体系选择pH 3.5。
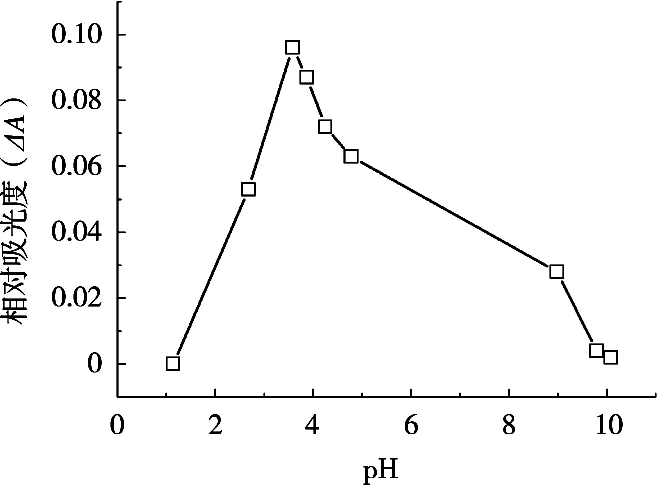
图2 pH对ΔA的影响
2.2.2 缓冲溶液用量的选择
鉴于用0.1 mol/L HCl和0.1 mol/L NaOH不能满足H2O2快速检测的需求,试验采用配置简便且pH缓冲能力强的醋酸-醋酸钠缓冲溶液来调节反应体系的pH。按照1.2试验方法,考察不同醋酸-醋酸钠缓冲溶液(pH 3.5)用量对ΔA的影响,结果如图3所示。结果表明,缓冲溶液用量在0.5~8 mL的范围内,体系ΔA变化不大。因此,醋酸-醋酸钠缓冲溶液(pH 3.5)用量选用1 mL。
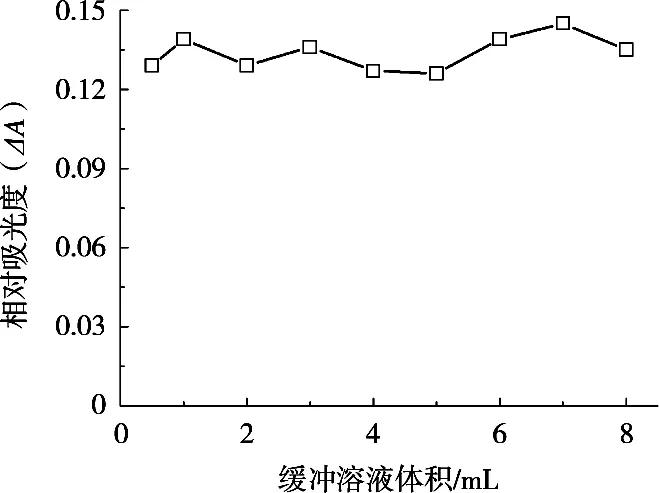
图3 缓冲溶液用量对ΔA的影响
2.2.3 BPY用量的选择
BPY作为反应体系的显色剂,其必须使用一定的量才能确保反应体系Fe(II)显色完全。按照1.2试验方法,考察不同BPY用量对体系ΔA的影响,结果如图4所示。当BPY用量由0.25 mL增加到0.5 mL时,体系ΔA显著增加;当BPY用量由0.5 mL继续增加至2.5 mL时,体系ΔA保持稳定。因此,此方法BPY用量选0.5 mL。
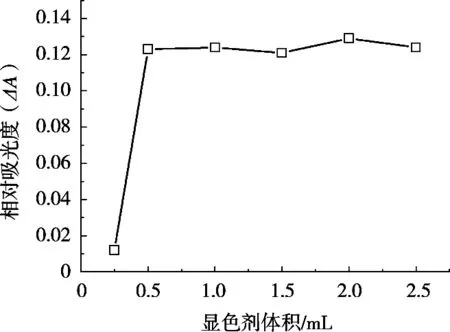
图4 BPY用量对ΔA的影响
2.2.4 振荡时间
由于试验是基于Fe(II)与H2O2反应的褪色光度法来定量H2O2,故H2O2与Fe(II)在醋酸-醋酸钠(pH 3.5)条件下是否反应完全是此方法定量H2O2准确的关键。按照1.2试验方法,考察不同振荡时间对ΔA的影响。结果表明,振荡时间在30~180 s范围内,体系ΔA几乎不变,说明H2O2与Fe(II)在酸性条件下反应是一个快速过程。综合考虑,振荡时间选用1 min。
2.2.5 显色时间
按照1.2试验方法,考察不同显色时间对ΔA的影响,结果如图6所示。结果表明,显色时间由5 min增加到25 min后,反应体系的ΔA维持不变,说明Fe(II)-BPY显色体系反应较快。综合考虑,显色时间选用10 min。
2.3 标准曲线和检出限
在选定的最优条件下,测定不同H2O2浓度下的空白溶液和样品溶液体系的吸光度,以H2O2浓度为横坐标,ΔA为纵坐标绘制工作曲线(图7)。结果表明,在0.004~0.02 mmol/L浓度范围内,体系吸光度ΔA与H2O2浓度呈良好的线性关系,其线性回归方程为ΔA=14.479C(mmol/L)-0.004(R2=0.998 8)。对浓度为0.012 mmol/L的H2O2溶液进行11次测定,其仪器检出限(3S/K)为0.001 mmol/L,进而可以计算此方法的检出限,为2 mg/kg。

图5 振荡时间对ΔA的影响
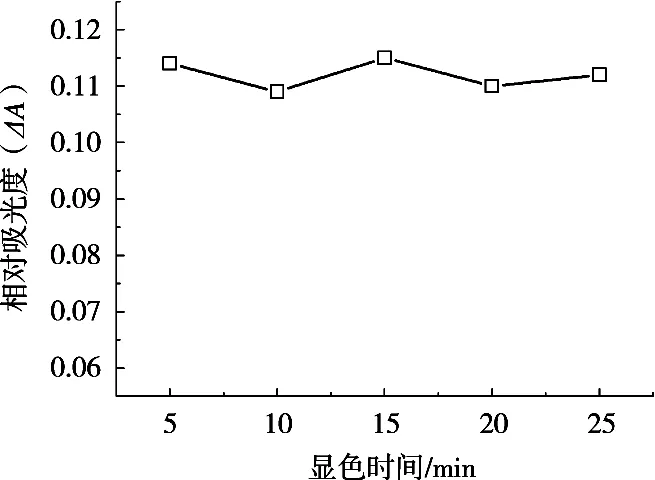
图6 显色时间对ΔA的影响
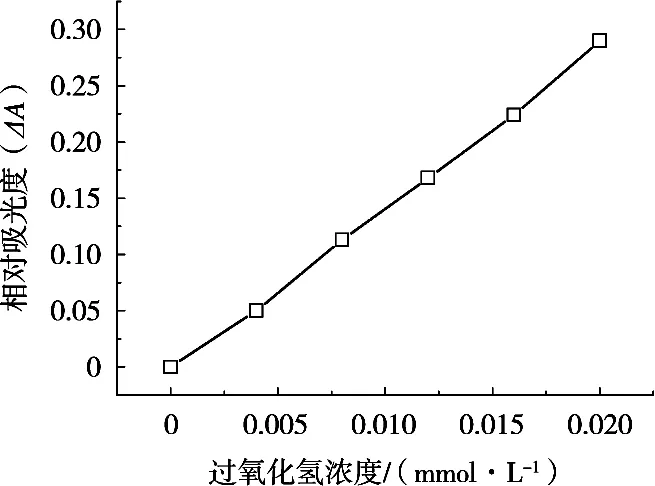
图7 H2O2标准曲线
2.4 共存离子的影响
当H2O2浓度为0.012 mmol/L时,试验考察了一些常见的无机离子对此测定方法的影响。当相对误差控制在±5%以内时,结果表明,除强氧化剂MnO42-、Cr2O72-干扰测定外,SO32-、NO2-、CO32-(3)、Cu2+(3)、NH4+、Ca2+、Mg2+(10)均无干扰。
2.5 样品测定及加标回收试验
参照国标方法,称取10 g样品(凤爪),加入50 mL水浸泡30 min,过滤,收集滤液待测。取1.00 mL待测液按照1.2中试验方法测定样品中H2O2含量,结果表明凤爪中H2O2含量(n=6)为4.70 mg/kg(RSD= 3.4%)。平行称取9份凤爪样品,分别进行0.010 3,0.020 6和0.030 9 mg/L三个质量浓度水平的加标回收试验,其加标回收率在96.8%~99.1%之间。3种浓度加样回收率RSD值分别为1.5%,2.0%和3.3%,这表明此方法具有一定的可靠性。
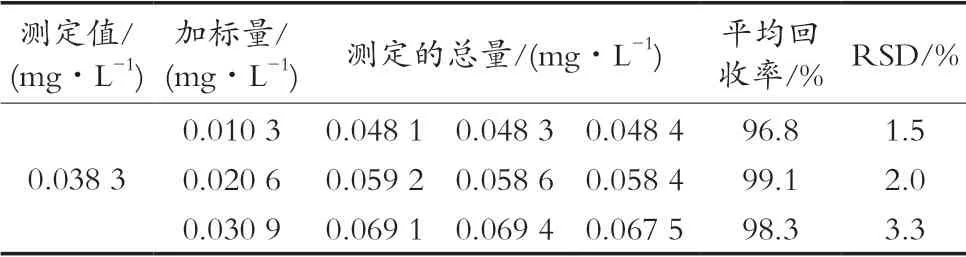
表1 凤爪样品回收率的测定结果(n=3)
3 结论
基于在HAc-NaAc(pH 3.5)缓冲溶液中,过氧化氢对Fe(II)-BPY显色体系有明显的阻抑褪色作用,且褪色吸光度(ΔA)在一定范围内与过氧化氢浓度呈线性关系,据此建立了一种新的测定微量H2O2的阻抑光度法。此方法线性范围为0.004~0.02 mmol/L(R2=0.998 8),检出限为2 mg/kg,且常见离子在一定含量范围内不干扰测定。采用此方法对实际食物样品凤爪中H2O2的含量进行测定,测定结果的相对标准偏差均小于5%,3种浓度水平下样品加标回收率为96.8%~99.1%。此方法所使用仪器简单便宜,且测试方便快捷,是一种理想的现场快速测定食品中微量过氧化氢的新方法。

