应用模式生物检测饮用水源颗粒物的毒性效应
常叶倩,顾翔,乔宇,陈鸿程,李梅,2,*
1. 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210023 2. 南京大学环境学院,环境科学与工程国家级实验教学示范中心,南京 210023
天然水体中广泛存在的颗粒物,广义上包括了粒度>1 nm的所有微粒实体。不同粒径颗粒物在天然水环境中的时空分布不同[1],自然条件下,同一河流中,水中粒径<1 μm的颗粒物百分含量高于其他粒径的颗粒物。这些颗粒物粒径小,比表面积大,不仅本身是饮用水的重要污染物之一,还可大量吸附水体中的污染物[2],形成复合污染,从而影响水生生态系统的生物、化学和物理状态[3]。当水体环境相对静止时,颗粒物作为污染物的暂时归宿,可携带污染物通过沉降作用沉积于水体底层。一旦环境条件变化或污染物发生物理化学转化,这些污染物有可能被重新释放出来,造成环境二次污染[4-6]。
研究表明,粒径越小,颗粒物越难以通过传统水处理工艺被去除,其表面吸附的污染物也会随之残留在水体中,对饮用水安全产生不利影响[4]。在饮用水处理过程中,主要通过投加无机和有机絮凝剂的方式达到去除颗粒物的目的。戴婕等[7]监测了以长江为原水的常规饮用水处理工艺的出水水质,结果表明,常规水处理工艺对于粒径>2 μm的颗粒物去除效果较好,出水浊度下降,但出水中仍含有大量粒径<2 μm的颗粒物,颗粒物总量呈上升趋势。林涛等[8]研究发现,传统饮用水处理工艺对小颗粒的去除效果并不理想,出水中仍含有大量的小颗粒(粒径<1 μm)。已有实验结果证明,颗粒物可直接或间接影响水生生物[9]。颗粒物常通过物理磨损[10]、干扰水生生物的呼吸[11]和摄入[12]等方式直接影响水生生物。Tse等[13]发现低浓度水体颗粒物暴露即可导致斜带石斑鱼(Epinephelus coioides)等水生生物出现DNA损伤。此外,由于小颗粒物易与水环境中其他污染物相互吸附、聚集,当其作为食物链中某些生物的食物源时,小颗粒物上负载的污染物可进入虾、鱼类等生物体内,进一步通过生物放大作用逐渐富集,最终被人体摄入[4],产生的健康风险不容小觑[14]。目前,我国还没有推出传统饮用水处理工艺对小颗粒物去除效率的相关标准,因此,针对小颗粒物毒性效应的研究有着极其重要的现实意义,研究结果对未来水质指标的制定与优化具有一定指导作用。
淡水单细胞微藻纤细裸藻(Euglena gracilis)培养简单、生长迅速,其细胞性状、光合作用等参数对环境胁迫十分敏感,已被广泛应用于水环境监测评价中[15]。蚕豆(Vicia faba L.)是一种能清晰观察有丝分裂的植物,其根尖微核试验常被研究者用作环境致突变性的检测手段[16]。发光菌(Photobacterium phosphoreum)急性毒性测试方法具有简便、快速、重现性好以及与其他毒性测试方法所得结果相关性高等优点,是目前应用较多的生物效应检测技术之一[17]。
本研究以纤细裸藻、蚕豆和发光菌作为受试生物,分别采用生物量、微核率和发光抑制率等作为评价指标,探讨饮用水中不同粒径颗粒物的急性毒性和遗传毒性效应,以期分析饮用水源不同粒径区间颗粒物的毒性差异,进而为监测和控制饮用水的毒性并改良饮用水处理工艺提供科学依据,为人类健康及饮用水安全作出贡献。
1 材料与方法 (Materials and methods)
1.1 水样采集与处理
选取南京某水厂进水口上游约2 km的渡口(118°43'9'' E,32°2'1'' N)作为进水采样点,以江心作为中心点,辐射范围为50 m的方式设置采样点,采集水面下0.5 m处水样。以水厂(118°43'38'' E,32°2'51'' N)附近任一自来水口作为出水点采集,由于距离较近,经管道运输距离较短,视作直接出水。
分别采集上述进水和出水各2 L作为原水,密封运输至实验室4 ℃冰箱保存。使用动态光散射激光粒度仪(Malvern Zetasizer Nano-S,英国)检测原水中的粒径分布。根据粒径分布结果,采用切向流过滤系统(TFF)(SYR2-U20-0LN,美国),选取孔径为1 μm的中空纤维微滤膜和具有1 kDa分子量截断值的膜组件,分别将100 mL进水原水和出水原水进一步分离成粒径<1 μm颗粒物组(D<1)、粒径≥1 μm颗粒物组(D≥1)和去颗粒物组。由于本文主要研究饮用水源颗粒物的毒性,无需浓缩颗粒物,故选用相同体积纯水(2 L)分散上述分离的颗粒物,所有水样均置于4 ℃冰箱保存。
1.2 发光菌急性毒性试验
发光菌(P. phosphoreum)购自中国科学院南京土壤研究所,参考GB/T 15441—1995[18]方法进行急性毒性试验。
取一定量4 ℃预冷的2% NaCl溶液加入含有发光菌冻干粉的安瓿瓶中,充分混匀,并稀释至合适浓度作为工作菌液。取各组水样2 mL加入具塞磨口比色管中,并按0.03 g·mL-1比例加入固体NaCl,以调节水样渗透压,同时以2 mL 3% NaCl溶液作为空白对照,取10 μL工作菌液于上述各比色管中,涡旋振荡均匀,去塞,反应15 min。采用DXY-2型生物毒性测试仪(中国科学院南京土壤研究所制)测试发光强度,空白对照发光强度应控制在600 mV以上。按如下公式计算各组的相对发光抑制率:
相对发光抑制率=(对照管发光强度-样品管发光强度)/对照管发光强度×100%
(1)
1.3 纤细裸藻急性毒性试验
1.3.1 微藻培养
纤细裸藻(E. gracilis)藻种由中国科学院水生生物所典型培养物保藏委员会淡水藻类藻种库(FACHB)提供。采用Checcucci培养基[19],接种于250 mL三角烧瓶中,在恒温光照培养箱中活化。培养条件如下:光强80~90 μmol·m-2·s-1,温度(25±1) ℃,光暗比12 h∶12 h,每天定时人工摇动3~5次,并随机移动各瓶位置,以减少因光照不同造成的误差。取培养3 d左右进入对数生长期的微藻,用于后续毒性测试。
1.3.2 微藻生长抑制试验
生长抑制试验参考Cheng等[20]的方法进行。取100 mL对数生长期的藻细胞悬液,3 500 g离心15 min,去上清,加入5 mL磷酸盐缓冲液(PBS)重悬细胞。取各组水样100 mL置于250 mL锥形瓶中,加入2 mL藻细胞重悬液,于光照培养箱中进行急性毒性试验,培养条件同上。藻细胞的初始接种浓度约为6×104个·mL-1。采用721-100型紫外分光光度计,于680 nm波长下,以纯水作空白对照,分别测定染毒0、24、48、72和96 h的藻液吸光度,结果取3个平行的平均值。为排除水样自身颜色的干扰,另将未接种微藻的各水样以相同方法加入96孔板,在相同波长下测定吸光度,结果作为各水样的本底值。根据本课题组前期研究结果,利用下列公式计算微藻细胞密度[21]:
y=(94.309×OD680+0.9114)×104
(2)
式中:y为细胞密度(个·mL-1),r=0.999。
1.4 蚕豆根尖细胞微核试验
蚕豆(V. faba L.)购自江苏明天种业科技有限公司,席夫氏(Schiff)试剂购自南京森贝伽生物科技有限公司,蚕豆根尖细胞微核试验参考孔志明[22]的方法进行。将干燥的蚕豆种子于25 ℃恒温箱中蒸馏水浸泡并催芽若干时间后选种,再次催芽至种子大部分初生根长约1 cm时,选取幼根粗细、长度大致相等的种子作实验材料。以纯水作空白对照,暴露6 h。恢复培养24 h后,从根尖切下1 cm的幼根,卡诺氏固定液固定24 h后,用蒸馏水浸洗根尖2次(每次5 min),再置于5 mol·L-1盐酸中,于28 ℃下水解至软化(约10 min)。采用孚尔根法(Feulgen)染色,以二氧化硫溶液作为洗涤液。处理后换入蒸馏水中,4 ℃保存,供随时制片用。制片时,将着色完全的根尖细胞1 mm有丝分裂区域放在洁净的载玻片上,滴少许45% 醋酸溶液,压片后随机镜检,计数微核细胞数及细胞总数。按如下公式计算微核千分率(micronucleus frequency, MCN, ‰)和综合污染指数(pollution index, PI):
MCN=出现微核的细胞数/所观察的细胞总数×1000‰
(3)
PI=样品MCN平均值/阴性对照组MCN平均值
(4)
为避免因试验条件等因素带来的MCN本底波动,采用PI来划分所受污染的程度。根据《全国生物技术监测规范——蚕豆根尖微核技术》所规定的污染指数划分标准:当PI为0~1.5时定为基本没有污染,PI为1.5~2.0时为轻微污染,PI为2.0~3.5时为中度污染,PI为3.5以上时为严重污染。
1.5 数据分析
采用GraphPad Prism 5软件对处理组和对照组进行显著性t检验,以P<0.05和P<0.01作为显著性依据。组间差异采用单因素方差分析。
2 结果与讨论(Results and discussion)
2.1 饮用水源进水和出水粒径分布
基于探究天然水体中颗粒物毒性效应的目的,本文首先采用动态光散射激光粒度仪对进水原水和出水原水的粒径分布进行了测定(图1),以评估水样中颗粒的分布情况。动态光散射技术(dynamic light scattering, DLS)指通过测量样品散射光强度起伏的变化,得出样品颗粒大小信息的一种技术,一般通过激光粒度仪来实现对样品颗粒粒径分布的表征。激光粒度仪可基于激光散射或衍射来分析颗粒的大小[23]。应用动态光散射激光粒度仪对进水原水和出水原水的粒径分布进行测定,结果显示,进水中的颗粒物主要由粒径<1 μm的颗粒物组成,约占颗粒物总量的61.28%;经常规水处理工艺处理后,出水中颗粒物粒径主要集中于1 μm以下。基于上述结果,本文选用1 μm作为试验中大、小颗粒的分界。
戴婕等[7]研究发现,以长江为原水的常规饮用水处理工艺出水中浊度虽然下降,但颗粒物总量呈上升趋势,结合本实验结果,可认为经常规饮用水处理工艺后,出水中仍含有大量粒径<1 μm的颗粒物。另有文献同样指出,目前,水厂主要去除了>2 μm的颗粒物,降低了浊度,但出水中颗粒物数量明显增多,且小粒径颗粒物数量占比较大(约占80%)[8]。张哲等[24]在研究中同样发现,传统饮用水工艺对小颗粒的去除效果不显著,进水和出水中均含有大量小颗粒物(<1 μm)。综上,可推测浊度与颗粒物数量之间的相关性较差,在现有水处理工艺下,饮用水出水中存在的大量粒径<1 μm的颗粒物可能威胁人体健康,对于粒径<1 μm的颗粒物的毒性效应研究迫在眉睫。
2.2 不同粒径颗粒物对发光细菌急性毒性试验
发光细菌毒性试验是快速检测水体中污染物综合毒性的有效方法,一般通过测定污染物抑制发光菌发光的程度来评价毒性的大小[25-26]。当接触到有毒物质时,细菌的荧光素酶会被抑制,光强度迅速下降[27]。本研究首先通过快速、灵敏的发光细菌急性毒性实验,评估不同粒径颗粒物的急性毒性效应,以初步确定不同粒径颗粒物间的毒性差异。
采用切向流过滤系统分别将上述进水原水和出水原水进一步分离成粒径<1 μm颗粒物组(D<1)、粒径≥1 μm颗粒物组(D≥1)和去颗粒物组。不同处理组水样对发光菌(P. phosphoreum)急性毒性测试结果如图2所示,除D<1组的进水毒性高于出水毒性外,其余处理组的进水毒性均显著低于出水毒性(P<0.05)。其中,进水原水和出水原水对发光菌的毒性差异最显著(P<0.01)。氯消毒是饮用水处理中最常用的消毒方式,嵇志远等[28]应用快速毒性测定仪
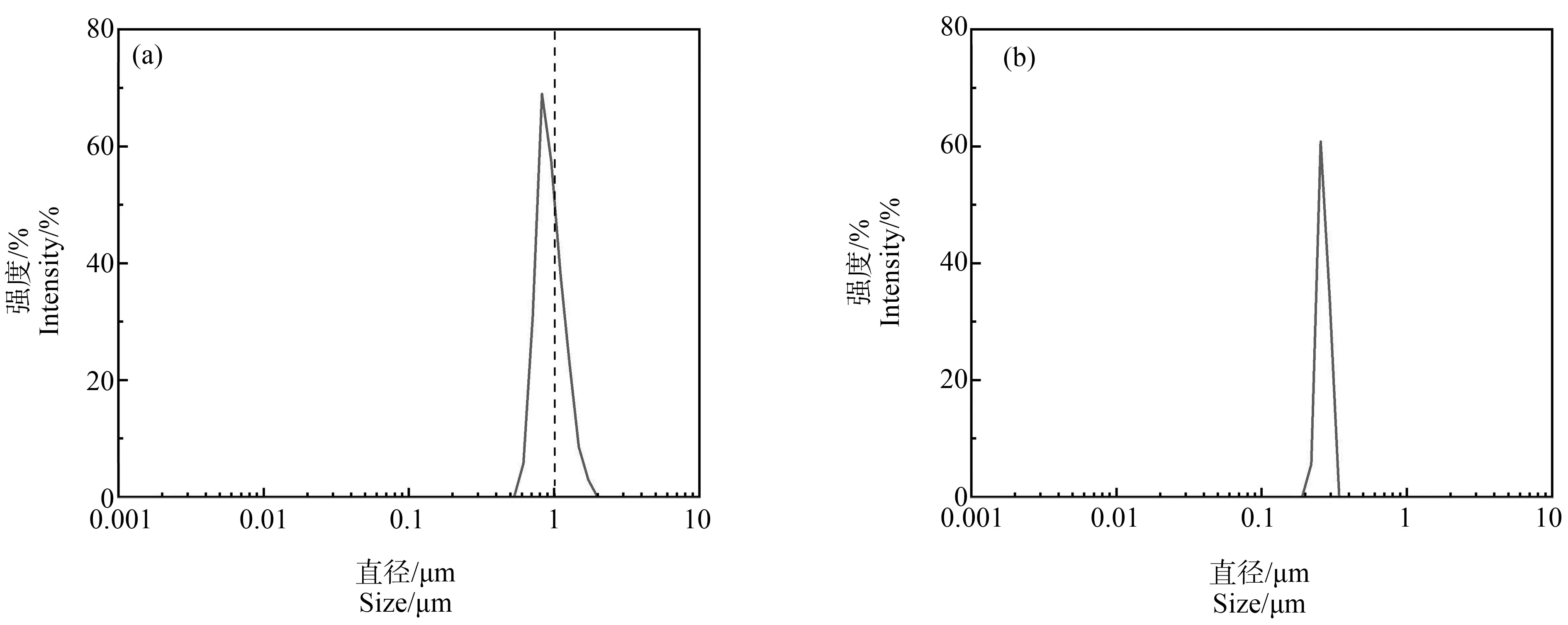
图1 饮用水源进出水中颗粒物分布注:(a). 进水;(b). 出水。Fig. 1 Size distributions of particles in inlet and outlet waterNote: (a). Inlet water; (b). Outlet water.
检测了水源水和自来水的综合毒性,发现含氯消毒剂对发光菌具有很强的毒性。因此,在水处理过程中使用含氯消毒剂会影响发光菌的毒性测试结果,表明发光菌不适宜作为水处理后出水毒性检测的受试生物。此外,由于本研究探讨饮用水中不同粒径颗粒物的急性毒性和遗传毒性效应,为避免含氯消毒干扰,后续试验均采用进水处理组水样。
在进水中,原水对发光菌的急性毒性最强,D<1组对发光菌的急性毒性与原水无显著性差异,推测进水原水对发光菌的急性毒性或主要由粒径<1 μm的颗粒物所致。D≥1组对发光菌的急性毒性显著低于D<1组(P<0.05),即粒径<1 μm的颗粒物毒性强于粒径≥1 μm的颗粒物毒性。刘红玲等[29]提出大型溞与发光菌作为生物急性毒性试验的对象可相互取代,且生物致毒机理在一定程度上非常相似。据报道,粒径<1 μm的颗粒物可能通过摄入或物理磨损的方式影响大型溞的生长、繁殖甚至死亡率[3]。考虑发光细菌的个体大小,推测进水中粒径<1 μm的颗粒物或可能主要通过物理磨损的方式对发光菌产生毒性效应。

图2 不同进、出水处理组对发光菌的急性毒性注:D表示颗粒物直径;D<1表示粒径小于1 μm颗粒物组;D≥1表示粒径大于等于1 μm颗粒物组;a、b指示进水和出水组间比较,字母不同表示存在显著性差异(P<0.01)。Fig. 2 Acute toxicity of different inlet and outlet water treatment groups to P. phosphoreumNote: D indicates diameter; D<1 indicates water sample particles diameter is less than 1 μm; D≥1 indicates water sample particles diameter is more than or equal to 1 μm; a, b indicate that there is a significant difference between the inlet and outlet water groups (P<0.01).
2.3 不同粒径颗粒物对纤细裸藻急性毒性试验
藻类生长试验可用于评价污染物对藻类的短期胁迫效应,进而反映污染物对水体初级生产者的影响。进、出水暴露下,纤细裸藻(E. gracilis)的生长情况如图3所示。结果表明,与纯水对照组(CK)相比,进水和出水均显著抑制微藻生长(P<0.05),在24 h处呈现显著的生长抑制效应(图3(a)),抑制率分别达11.1%和12.7%,表明2种水样对微藻均具有生长抑制效应。暴露96 h后进水和出水的生长抑制效应进一步加强,微藻缓慢生长,96 h时的抑制率分别为19.9%和30.0%,出水对微藻的生长抑制效应更为显著(图3(b))。
进水不同粒径颗粒物处理组对纤细裸藻生长的影响如图4所示。与原水相比,进水不同处理组均可对微藻的生长产生不同程度的影响(图4(a))。D≥1组的微藻生长速度有减慢的趋势,D<1组和去颗粒物组微藻的生长速度显著减慢,即进水D≥1组、D<1组和去颗粒物组均抑制了微藻的生长,其中D<1组和去颗粒物组的抑制效应最显著(图4(b))。由实验结果可得,饮用水源水中,粒径<1 μm的颗粒物毒性大于粒径≥1 μm的颗粒物毒性,与发光菌试验结果一致。3种处理组水样对藻类的抑制效应均在不同程度上强于原水,其中去颗粒物水的效应最为显著(图4(b)),因此,推测进水中或存在不同粒径颗粒物与水体化合物的拮抗作用,从而降低了原水的毒性效应。Xiao等[3]在贡湖湾水体中也发现粒径<1 μm的颗粒物水样对纤细裸藻(E. gracilis)的毒性比粒径≥1 μm的颗粒物水样更大。侯秀富[30]对斜生栅藻(Scenedesmus obliquus)等3种藻类的研究发现,对于相同浓度的不同粒径颗粒物,小粒径颗粒物比大粒径颗粒物对藻类生长的影响更甚。据报道,粒径<1 μm的颗粒物会限制水体的透光量,影响藻类光合作用[3],从而影响藻类生长。Kjelland等[11]指出,水体中粒径<1 μm的颗粒物还可以通过减少水中溶解氧的方式减少浮游生物群落。因此,粒径<1 μm的颗粒物对纤细裸藻毒性效应的内在机理尚需进一步实验研究。
2.4 不同粒径颗粒物对蚕豆遗传毒性试验
蚕豆微核试验是一项短期生物测试,可预测水体污染物的潜在基因毒性[31]。1982年Degrassi和Rizzoni[32]首次建立了蚕豆(V. faba L.)根尖细胞微核试验系统,并指出微核试验尤其适用于环境遗传毒性检测。根据《全国生物技术监测规范——蚕豆根尖微核技术》所规定的污染指数划分标准,蚕豆根尖细胞遗传毒性试验结果显示,进水的污染指数(PI≈3.69)显著高于对照组(PI=1) (P<0.05),属于重度污染;出水的污染指数(PI≈2.14)略高于对照组(图5(a)),属于中度污染,表明目前的饮用水处理工艺对水中污染物具有一定的处理效果,出水的污染指数显著减小,但仍具有一定的遗传毒性。王超等[33]的研究也表明,自来水厂的出厂水具有潜在致突变性。因此,对于饮用水出水的安全性需予以一定的重视。

图3 进、出水水样暴露下纤细裸藻的生长状态注:(a). 生长曲线,(b). 96 h生长抑制率,对照为纯水;*表示与对照相比,P<0.05,**表示与对照相比,P<0.01。Fig. 3 Growth state of E. gracilis exposed to inlet and outlet waterNote: (a). The growth curve; (b). The growth inhibition rate of 96 h; Control. Pure water; *indicates P<0.05, compared with control group; **indicates P<0.01, compared with control group.

图4 不同进水处理组暴露下纤细裸藻的生长状态注:(a). 生长曲线,(b). 96 h生长抑制率;D表示颗粒物直径;D<1表示粒径小于1 μm 颗粒物组;D≥1表示粒径大于等于1 μm颗粒物组;*表示与原水相比,P<0.05。Fig. 4 Growth state of E. gracilis exposed to different inlet water treatment groupsNote: (a). The growth curve; (b). The growth inhibition rate of 96 h; D indicates diameter; D<1 indicates water sample particles diameter is less than 1 μm; D≥1 indicates water sample particles diameter is more than or equal to 1 μm; *indicates P<0.05, compared with raw water group.
在进水中,D<1组污染指数最高,甚至高于进水原水,属于重度污染,表明粒径越小的颗粒物可能吸附的污染物越多,毒性越大。进水的去颗粒物组和D≥1组的污染指数显著低于进水原水的污染指数,分别属于轻微污染和中度污染(图5(b))。由于D<1组污染指数甚至高于进水原水,进水原水的毒性主要由去颗粒物水中的污染物、粒径<1 μm和粒径≥1 μm的颗粒物及其相应吸附的污染物组成,故推测污染物与污染物间、污染物与颗粒物间或存在拮抗作用,使污染物和颗粒物的综合毒性,即进水原水的综合毒性低于3个处理组毒性的总和。郭长城等[34]选择76 μm以下的颗粒物进行模拟试验,发现颗粒物粒径越小,对污染物的吸附作用越强,因此吸附的污染物可能越多,毒性也越大。朱齐齐等[1]在研究天然水体中颗粒物对7种抗生素的吸附特征时,同样得出水体中颗粒物粒径越小毒性越强的结论,并分析这是由小粒径颗粒物(<1 μm)吸附抗生素能力强所致。据报道,吸附的机理主要有静电作用、表面络合作用和竞争吸附等,pH和钙离子浓度是影响颗粒物吸附的两大重要因素[35]。任艳婷[36]探究了水环境中不同粒径颗粒物对喹诺酮类抗生素的吸附特征,结果表明,当pH值为6~8时,粒径<1 μm颗粒物的吸附能力显著强于粒径≥1 μm颗粒物。由实验测得进水pH约为8.3,因此合理推测在进水中,粒径<1 μm的颗粒物毒性强于粒径≥1 μm的颗粒物毒性,或是由粒径<1 μm颗粒物的强吸附能力所致。
本试验结果表明,进水中粒径越小的颗粒物,毒性越大,推测或主要是由于天然水体中(pH=6~8),粒径<1 μm颗粒物的吸附能力显著强于粒径≥1 μm颗粒物导致。但天然水体中颗粒物诱导发光菌、纤细裸藻和蚕豆根尖毒性效应的具体机理仍有待进一步研究。
综上所述:
(1)出水中均含大量小颗粒物,特别是粒径<1 μm的颗粒,表明传统饮用水处理工艺对这些小颗粒物的去除效果不明显。
(2)模式生物发光菌不适宜用于饮用水处理工艺出水毒性的检测。
(3)纤细裸藻、蚕豆根尖和发光菌的试验结果表明,进水中颗粒物粒径越小,毒性越强。经传统水处理工艺处理后的水源仍可能存在一定的健康隐患。

图5 不同水样组对蚕豆根尖细胞的遗传毒性注:(a). 进、出水;(b). 不同进水处理组;D表示颗粒物直径;D<1表示粒径小于1 μm颗粒物组;D≥1表示粒径大于等于1 μm颗粒物组;*表示与CK(a)/原水(b)相比,P<0.05。Fig. 5 The genotoxicity of different water sample groups on V. faba root tip cellsNote: (a). Inlet and outlet water; (b). Different influent treatment groups; D indicates diameter; D<1 indicates water sample particles diameter is less than 1 μm; D≥1 indicates water sample particles diameter is more than or equal to 1 μm; *indicates P<0.05, compared with control group (a)/raw water group (b).

