石墨烯对高等植物幼苗的毒性及机理探究
徐亚楠,徐立娜
1. 中国海洋大学海洋环境与生态教育部重点实验室,青岛 266100 2. 青岛农业大学园林与林学院,青岛 266100
石墨烯(graphene)是一种重要的二维碳纳米材料,具有非常稳定的碳结构[1-2]。近年来,石墨烯依靠本身独特的电学性质[3]、光学性质[4]、机械性能[5]及巨大的比表面积[6],在电池、电子设备、生物医药、材料和储能等领域得到广泛应用[7-8]。随着石墨烯材料及其相关产品的生产、储存、运输、使用、清理和废弃等过程,石墨烯不可避免地会释放到环境中,对生态环境产生一定的威胁[9]。因此,了解石 墨烯材料的健康和生态风险对石墨烯材料的安全应用至关重要。
植物作为生态系统的初级生产者,其多样性对生态系统的平衡至关重要。目前已有诸多研究表明,石墨烯材料对植物生长存在毒性效应。例如,Begum等[10]通过研究石墨烯对卷心菜、番茄和红苋菜幼苗生长的影响,发现石墨烯能够抑制植物生长,并对植物根部产生物理损伤及氧化损伤。Hao等[11]的研究表明,还原氧化石墨烯对水稻茎高和根长产生抑制效应,并显著降低根皮质细胞直径,导致细胞收缩变形。Zhang等[12]研究了石墨烯对番茄幼苗生长的影响,结果发现石墨烯能够渗透入液泡及在根尖沉积,从而抑制生物量的积累。然而,也有文献表明,石墨烯对植物生长具有促进作用。例如,通过调节赤霉素(GA)的生物合成促进幼苗根和茎的生长[12]。综上所述,关于石墨烯植物毒性的研究还存在争议。并且,石墨烯对单子叶植物和双子叶植物影响的研究还较为缺乏。
黄瓜和玉米是典型的双子叶和单子叶植物,其作为广泛种植的经济作物,已被广泛地用作纳米颗粒的毒理学研究。但目前关于石墨烯对黄瓜和玉米幼苗毒性效应的研究尚未有报道。基于此,本文以双子叶子植物黄瓜和单子叶植物玉米作为受试植物,采用营养液培养实验研究石墨烯对植物幼苗生长的影响,并探究其对植物生长产生抑制的机理,为石墨烯的环境风险评价提供基础数据。
1 材料与方法(Materials and methods)
1.1 石墨烯的特性表征
实验采用的石墨烯购于美国石墨烯公司(American Graphene Supermarket Co. Ltd.),纯度>99.9%。将5 mg石墨烯悬浮于100 mL无水乙醇中,利用超声清洗机超声分散(100 W, 40 kHz) 1 h。取配制的溶液滴加到铜网上,自然风干,利用透射电子显微镜(TEM) (JEM-2100,JEOL,日本)观察石墨烯的形态。取配制的溶液滴加到云母载玻片上,自然风干,使用原子力显微镜(AFM) (Agilent5400,Agilent Technologies Co.,美国)观察并分析石墨烯的厚度。称取5 mg干燥的石墨烯样品过60目筛,利用元素分析仪(Vario Elemental Analyzer,Elementar,德国)测定碳(C)、氧(O)、硫(S)、氢(H)和氮(N)元素的含量。利用傅立叶红外光谱仪(FTIR) (Nicolet6700,Thermo Fisher Scientific Inc., 美国)测量石墨烯表面含有的官能团。利用全自动物理化学吸附仪(Autosorb-1,Quantachrome,美国),使用Brunauere-Emmette-Teller (BET)方法测得石墨烯的比表面积。称取5 mg石墨烯,分别加入到100 mL蒸馏水、1/4单子叶营养液和1/4双子叶营养液中,调节pH值在6.5~7.0之间,超声分散1 h,制备成50 mg·L-1的石墨烯悬浮液,利用粒度分析仪(Zetasizer Nano ZS90,Malvern Instruments Ltd,英国)测量其Zeta电位。配制2 000 mg·L-1石墨烯悬浮液,黑暗中静置7 d后10 000 r·min-1条件下高速离心,用0.22 μm一次性针头滤器(聚醚砜(PES)膜,美仑)过滤,之后利用电感耦合等离子体质谱(ICP-MS)(Agilent 7500,Agilent Technologies,美国)测定滤液中石墨烯释放的离子浓度,用蒸馏水作为对照。
1.2 植物幼苗培养及处理方法
实验所用的黄瓜和玉米种子购于山东省青岛市城阳种子站,种子的发芽率大于90%。挑选大小一致、颗粒饱满的黄瓜和玉米种子,用10% H2O2对种子进行消毒10 min,蒸馏水冲洗3遍,将种子放置到铺有湿润滤纸的培养皿中发芽,7 d后选择长势一致的黄瓜幼苗和玉米幼苗分别移入培养盆中,分别加入1/4双子叶营养液(K2SO4,32.68 mg·L-1;Ca(NO3)2,118.08 mg·L-1;MgSO4·7H2O,40.05 mg·L-1;KH2PO4,8.51 mg·L-1;KCl,1.86 mg·L-1;Fe-EDTA,10.53 mg·L-1;MnSO4·H2O,0.042 mg·L-1;CuSO4·5H2O,0.006 mg·L-1;ZnSO4·7H2O,0.072 mg·L-1;(NH4)6Mo7O24,0.015 mg·L-1;H3BO3,0.154 mg·L-1)和1/4单子叶营养液(K2SO4,32.68 mg·L-1;Ca(NO3)2,118.08 mg·L-1;MgSO4·7H2O,40.05 mg·L-1;KH2PO4,8.51 mg·L-1;KCl,1.86 mg·L-1;Fe-EDTA,10.53 mg·L-1;MnSO4·H2O,0.042 mg·L-1;CuSO4·5H2O,0.006 mg·L-1;ZnSO4·7H2O,0.072 mg·L-1;(NH4)6Mo7O24,0.015 mg·L-1;H3BO3,0.015 mg·L-1)。每天光照12 h,光照强度16 500 lx;20~25 ℃/15~20 ℃(白天/夜晚);湿度保持在60%~70%左右;持续曝气。植物幼苗在长至两叶一心时,进行石墨烯暴露处理。实验设置了7个不同的处理组,即去离子水空白对照(CK)与10、50、100、500、1 000和2 000 mg·L-1石墨烯处理,每个处理均设置5个重复。每隔5 d更换一次营养液,并重新加入石墨烯悬浮液,处理时间持续15 d。每隔3 d从每个处理组里面选取5棵长势一致的植物,测量株高;用全自动根系扫描分析仪(WinRHIZO Pro.2005b,加拿大)扫描,分析根长、根尖数和叶面积;用电子天平称量鲜重。将植物放入105 ℃的烘箱中进行杀青处理,再放置到65 ℃烘箱中进行24 h烘干,之后称量植物的干重。根据以上实验数据绘制植物生长曲线。
1.3 物理损伤测定
取1 000 mg·L-1石墨烯处理过的黄瓜和玉米幼苗的根部,用蒸馏水冲洗干净,用pH=7.2的磷酸缓冲液(PBS)冲洗2次,将根系分散于2.5%的戊二醛中固定12 h,然后再用PBS冲洗3次,加入戊二醛中二次固定,乙醇分级脱水,叔丁醇包埋,冷冻干燥,喷金处理,利用扫描电子显微镜(SEM,S-4800,Hitachi,日本)进行观察。
1.4 氧化损伤测定
取1 000 mg·L-1石墨烯处理15 d的新鲜植物幼苗,按照1∶9的体积比加入生理盐水,冰浴条件下用匀浆机进行匀浆。取上清液,采用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)探针测量植物体内产生的氧自由基(ROS)含量;采用硫代巴比妥酸反应产物(TBARS)测定丙二醛(MDA),利用酶标仪(MultiskanFC, Thermo Fisher Scientific Inc., 美国)在532 nm处测定吸收峰,计算反应产物。
1.5 营养耗竭实验
称取0.05 g石墨烯加入50 mL 1/4双子叶营养液或者1/4单子叶营养液(pH 6.5~7.0),超声分散,配制成1 000 mg·L-1石墨烯悬浮液,放置在黑暗环境中5 d,5 d后高速离心(10 000 rmin-1)分离,用0.22 μm一次性针头滤器过滤,利用ICP-MS测定营养液中的离子浓度,用蒸馏水作为对照。并用凯氏定氮仪测定溶液中总氮含量。利用钼酸铵分光光度法测定营养液中总磷含量的变化。
在营养液中加入石墨烯,石墨烯的浓度分别为50、100、500和1 000 mg·L-1,将营养液放置5 d,过滤取其上清液,利用上清液培养植物,每5天换一次营养液。植物培养15 d后,测量植物株高、地上部/根部鲜重和干重、根长、根尖数以及叶面积参数。
1.6 数据统计分析方法
所有处理至少有3个重复,结果显示为平均值±标准偏差(SD)。实验数据统计分析使用Microsoft Excel 2013软件,利用DPS12.5软件中的单因素方差分析(Analysis of Variance,ANOVA,LSD检验法)进行显著性差异检验(P<0.05)。
2 结果(Results)
2.1 石墨烯的特性表征


图1 石墨烯(a)透射电子显微镜(TEM)照片和(b)原子力显微镜(AFM)照片Fig. 1 (a) Transmission Electron Microscope (TEM) image of graphene sheets; (b) Atomic Force Microscopy (AFM) image of graphene sheets
2.2 石墨烯对黄瓜和玉米幼苗的毒性效应
在营养液培养条件下,不同浓度的石墨烯(0、10、50、100、500、1 000和2 000 mg·L-1)悬浮液处理植物15 d后,黄瓜和玉米生长的各参数的变化曲线分别如图2和图3所示。石墨烯能够抑制植物幼苗的生长,且随着石墨烯浓度以及暴露时间的增加,对黄瓜和玉米幼苗的毒性也明显增强。对于黄瓜幼苗,在第15天,2 000 mg·L-1石墨烯处理组与对照组相比,根部鲜重和干重都减少了86%(图2(a)和图2(b)),地上部鲜重和干重分别减少了77%(图2(c))和76%(图2(d))。对于玉米幼苗,2 000 mg·L-1石墨烯处理组与对照组相比,根鲜重和干重分别减少了40%(图3(a))和33%(图3(b)),其地上部生物量没有发生显著性变化(图3(c)和图3(d))。与对照相比,石墨烯处理显著降低了根长和根尖数以及株高和叶面积,且抑制效应也都存在着时间和浓度效应。

图2 石墨烯对黄瓜幼苗的影响Fig. 2 Effects of graphene on the growth of cucumber seedlings
2 000 mg·L-1石墨烯处理植物幼苗15 d,黄瓜根长、根尖数、株高和叶面积分别减少了90%(图2(e))、84%(图2(f))、36%(图2(g))和72%(图2(h))。玉米根长、根尖数、株高和叶面积分别减少了33%(图3(e))、36%(图3(f))、7.8%(图3(g))和29%(图3(h))。以上实验结果表明,与玉米幼苗相比,黄瓜幼苗对石墨烯更加敏感。
2.3 物理损伤
石墨烯具有锋利的边缘,与植物根系接触可能会对植物造成物理损伤。使用SEM观察黄瓜和玉米根系(图4和图5)发现:石墨烯处理过的黄瓜(图4(b))根冠有明显的切割伤痕;未处理的黄瓜成熟区(图4(c))表面光滑、有根毛,石墨烯处理过的黄瓜成熟区(图4(d))表面有明显的切割痕迹。这说明,石墨烯能够通过切割作用对植物幼苗根系造成直接的物理损伤。Begum等[10]在研究中观察到石墨烯对卷心菜、番茄、红苋菜和生菜根部造成物理损伤,出现表皮脱落的现象。对于玉米幼苗,未处理的玉米幼苗根部较细,根冠和根成熟区较为光滑(图5(a)和图5(c)),与对照相比,1 000 mg·L-1石墨烯处理过的玉米根冠(图5(b))和成熟区(图5(d))变粗受损。

图3 石墨烯对玉米幼苗生长的影响Fig. 3 Effects of graphene on the growth of maize seedlings
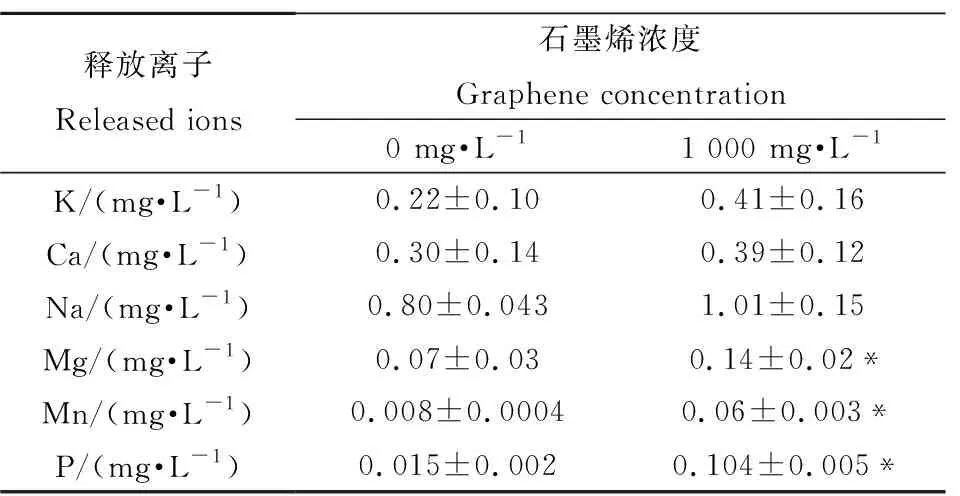
表1 石墨烯悬浮液释放的离子Table 1 Ions released of graphene suspension
注:表中数据表示为平均值±标准误;*代表与对照组相比有显著性差异(P<0.05)。
Note: Data are expressed as Mean±SE; significant difference (P<0.05) between graphene treatments and control group is marked with “*”.

图4 黄瓜根扫描电子显微镜(SEM)照片注:(a)对照,根冠;(b)石墨烯处理(1 000 mg·L-1),根冠;(c)对照,成熟区;(d)石墨烯处理(1 000 mg·L-1),成熟区。Fig. 4 Scanning Electron Microscope (SEM) images of cucumber rootsNote: (a) CK, root cap; (b) graphene treatment (1 000 mg·L-1), root cap; (c) CK, maturation zone; (d) graphene treatment (1 000 mg·L-1), maturation zone.

图5 玉米根SEM照片注:(a)对照,根冠;(b)石墨烯处理(1 000 mg·L-1),根冠;(c)对照,成熟区;(d)石墨烯处理(1 000 mg·L-1),成熟区。Fig. 5 SEM images of maize rootsNote: (a) CK, root cap; (b) graphene treatment (1 000 mg·L-1), root cap; (c) CK, maturation zone; (d) graphene treatment (1 000 mg·L-1), maturation zone.
2.4 氧化损伤
通过对植物体内的ROS进行定量分析发现,与对照组相比,石墨烯导致黄瓜体内ROS含量增加了50%(图6(a)),而玉米体内ROS含量无显著变化(图6(a))。这说明,石墨烯对黄瓜幼苗产生了氧化胁迫,对玉米幼苗没有产生氧化胁迫。脂质过氧化的终产物MDA会损害细胞膜的结构和功能,是检测氧化损伤程度的重要指标[13]。进一步分析MDA的含量,发现1 000 mg·L-1石墨烯处理过的黄瓜体内MDA含量与对照组相比显著升高(34%),而石墨烯处理过的玉米幼苗体内MDA的含量无显著性变化(图6(b))。
2.5 营养吸附
通过吸附实验,发现石墨烯主要吸附了双子叶营养液中的N元素(主要以硝酸根的形式)和Cu离子(表2),1 000 mg·L-1石墨烯吸附后,营养液中的这2种元素分别减少了84%和30%;对于单子叶营养液,石墨烯主要吸附了其中的N元素(表2),导致营养液中N元素减少了85%。同时,由于石墨烯材料中含有杂质,会释放Mn离子和P离子[14],从而导致营养液中的Mn和P离子含量的升高。

图6 石墨烯对植物体内活性氧(ROS)和丙二醛(MDA)含量的影响注:*代表显著性差异(P<0.05)。Fig. 6 Effects of graphene on reactive oxygen species (ROS) and malondialdehyde (MDA) content in plantsNote: Significant difference was marked with * (P<0.05).
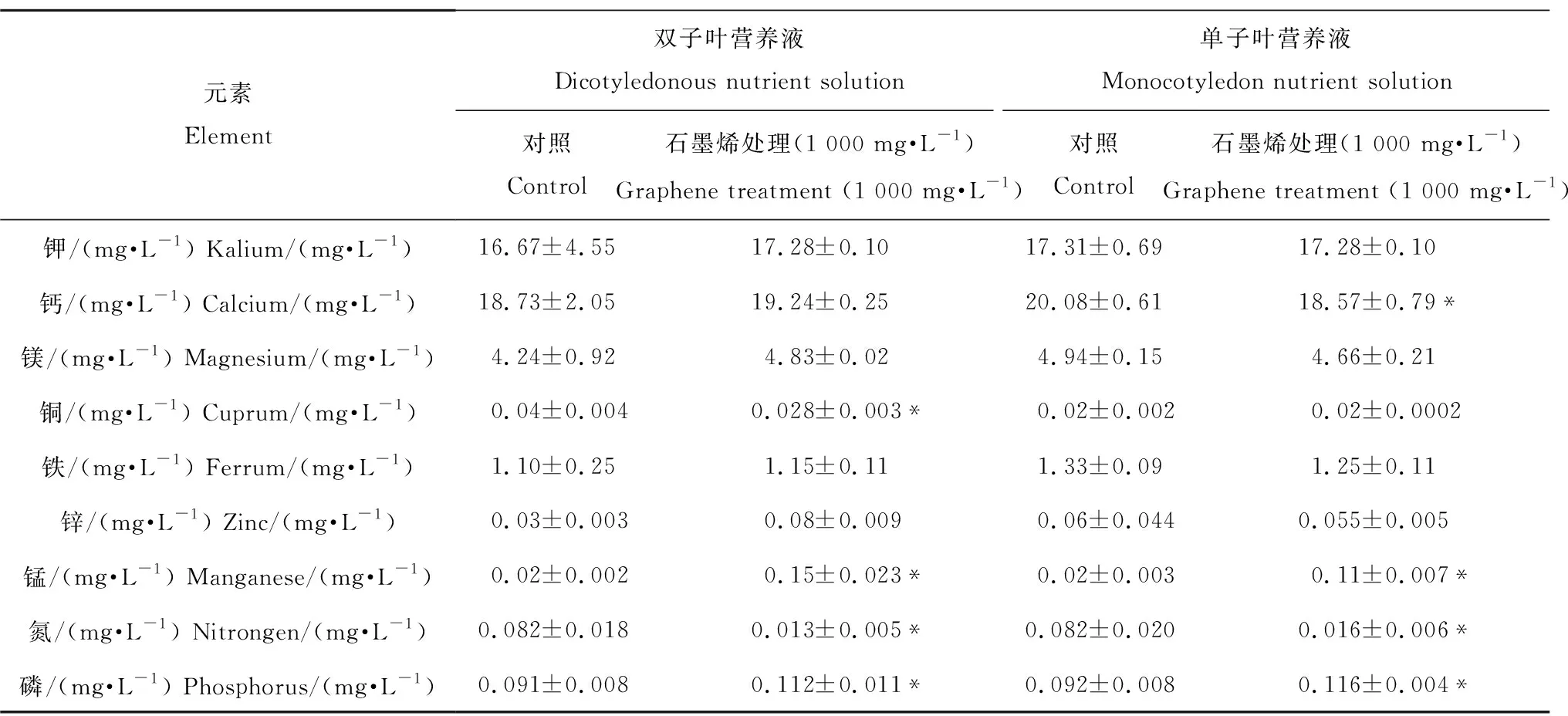
表2 石墨烯吸附后营养液中离子的含量变化Table 2 Changes of ion content in nutrient solution after graphene adsorption
注:表中数据表示为平均值±标准误;*代表与对照组相比有显著性差异(P<0.05)。
Note: Data are expressed as Mean±SE; significant difference (P<0.05) between graphene treatments and control group is marked with “*”.
利用石墨烯吸附后的1/4营养液上清液培养植物15 d,结果发现黄瓜和玉米幼苗生长都受到了不同程度的抑制。与对照组相比,当石墨烯浓度达到50 mg·L-1时,黄瓜幼苗的生物量(根/地上部鲜重和干重)、根部形态参数(根长和根尖数)和株高都受到了明显的抑制(表3)。玉米除了地上部鲜重和根尖数,其他的生长指标也都明显减弱(表4)这说明,石墨烯对营养液中的大量元素(N)和微量元素(Cu)的吸附,导致黄瓜和玉米幼苗生长缺乏营养、生长受抑制。营养耗竭是石墨烯对黄瓜和玉米幼苗产生毒性效应的重要机理之一。
3 讨论(Discussion)
随着石墨烯产业的发展,石墨烯材料不可避免地进入到环境中,在迁移、转化的过程中会对生态系统产生潜在的危害。本研究中,石墨烯对植物幼苗的毒性具有时间和浓度效应,即随着石墨烯暴露浓度和时间的增加,毒性效应增强。这与人工纳米颗粒对植物的毒性效应研究结果一致[15]。同时,石墨烯对黄瓜幼苗的抑制程度要高于其对玉米幼苗的抑制。单子叶植物和双子叶植物木质部结构的不同是产生差异的一个关键因素,单子叶植物只有初生木质部,中央有髓,起贮藏作用;不具有形成层,从而不能产生次生结构。双子叶植物初生木质部缺少髓;形成层会不断地形成次生木质部,对水分的输送要求也较高。这种木质部结构的不同对纳米颗粒就可能表现出不同的吸收动力学[10]。也有研究认为,纳米颗粒对双子叶植物和单子叶植物的抑制效应不同是它们根系构型的差异引起的,但这并不是一个共性的结论[16]。
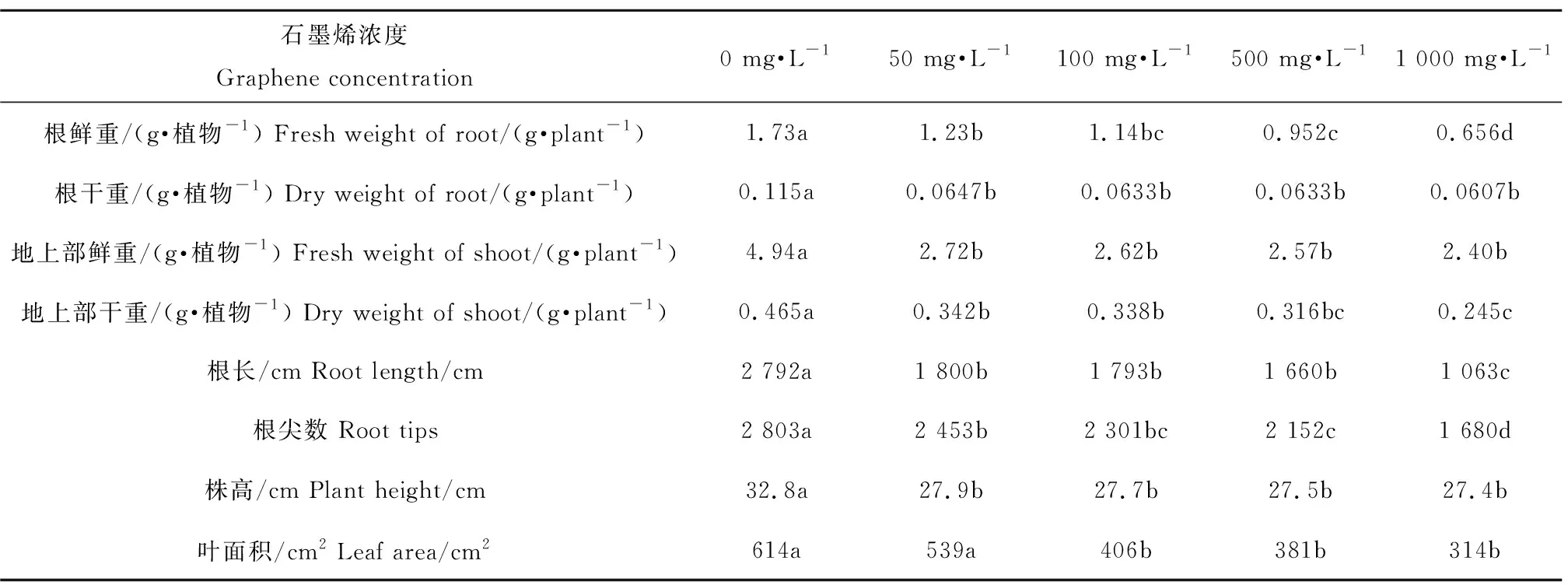
表3 石墨烯吸附后的营养液对黄瓜幼苗各生长指标的影响Table 3 Effects of nutrient solution after graphene adsorption on growth of cucumber seedlings
注:字母代表显著性差异(P<0.05)。
Note: Significant differences are marked with different letters (P<0.05).

表4 石墨烯吸附后的营养液对玉米幼苗各生长指标的影响Table 4 Effects of nutrient solution after graphene adsorption on growth of maize seedlings
注:字母代表显著性差异(P<0.05)。
Note: Significant differences are marked with different letters (P<0.05).
石墨烯锋利的边缘,会对植物根部产生物理的切割损伤,同时导致受试生物体内的氧自由基的累积而产生氧化胁迫,这已经成为了石墨烯致毒的最为普遍的机理。Begum等[10]的研究表明,石墨烯本身的疏水性质导致其分散性较差,易在水体环境中发生团聚,与植物根系发生异相团聚从而在甘蓝、番茄和红苋菜根系表面聚集而导致物理损伤;同时,植物叶片中的ROS和H2O2含量显著升高,从而对植物的生长产生抑制效应。本研究发现,石墨烯对黄瓜和玉米的根部都造成了切割损伤,黄瓜幼苗的ROS和MDA含量都明显升高,而玉米幼苗的ROS和MDA含量无显著性变化。
已有研究表明,石墨烯能够吸附锌、铜等离子[17],对硝酸根的吸附量为202 mg·g-1[18]。Zhao等[17]和Ganesan等[18]研究认为,石墨烯吸附阴离子的主要机理有2个方面,第一是离子交换,如石墨烯对氟离子的吸附就是通过氟离子和石墨烯上的羟基离子交换;第二是形成强的阴离子—π键,吸附能随其电负性的增大而降低。Zhao等[19]的研究指出,石墨烯吸附培养基中的营养元素,造成营养耗竭,是造成蛋白核小球藻生长毒性的重要机理。本实验所用的植物营养液中也含有多种离子,而这些离子是黄瓜和玉米幼苗生长所必需的,因此,探究了石墨烯导致的营养耗竭对植物生长的影响,实验结果表明,石墨烯对培养液中的营养元素氮和铜的吸附,会导致培养液中营养失衡,从而影响幼苗的正常生长而产生毒性效应。本文系统研究了石墨烯对黄瓜和玉米的毒性效应,并分析了其致毒机理。进一步的研究需要探讨石墨烯对黄瓜和玉米幼苗致毒机理不同的原因。

