大辽河流域土壤中微塑料的丰度与分布研究
韩丽花,李巧玲,徐笠,陆安祥,李冰茹,巩文雯,田佳宇
1. 中北大学理学院,太原 030051 2. 北京市农林科学院,北京农业质量标准与检测技术研究中心,北京 100097 3. 农产品产地环境监测北京市重点实验室,北京 100097
微塑料(microplastics)一词最早由Andrady[1]提出,后经美国国家海洋和大气管理局(National Oceanic and Atmospheric Administration, NOAA)将其定义为直径<5 mm的塑料颗粒,主要来源于大尺寸塑料的风化和降解产物、化纤纺织品的断裂及个人护理品或工业原材料,即按其来源可分为初级微塑料和次级微塑料。微塑料具有粒径小、比表面积大、疏水性强和难降解等特性,是众多疏水性污染物和重金属的理想载体[2]。微塑料不断上升的环境浓度以及潜在的生态毒理效应,引起了全球的日益关注[3]。
近年来,国内外学者对微塑料污染的研究已取得了一定的成果。这些研究表明,微塑料广泛存在于海洋[4-5]、淡水湖[6]、河流沉积物[7-10]和淡水生物[11]等中。而海洋和淡水中微塑料的一个重要来源是陆地塑料的使用[12]。据报道,土壤可能比海洋接收更多的塑料垃圾[13]。已有研究表明,微塑料经过长期的风化、老化过程,比表面积逐步增大,疏水性增强,在土壤盐度、有机质和pH等多种因素影响下,与土壤中的重金属和有机污染物发生相互作用,引起土壤的物理化学性质的改变[14]。此外,微塑料在被土壤中的动物摄食后沿着土壤食物链传递,进而影响各营养级的土壤动物[15]。因此,对土壤中微塑料污染方面的研究迫在眉睫。
目前有部分研究证明了滨海潮滩土壤[16]、瑞士洪泛区土壤[17]、西南地区土壤[18]和滨海盐场土壤[19]等均存在微塑料的污染,而流域土壤中的微塑料很可能随着大风、降雨等冲蚀进入河流中,最终汇入海洋。目前对流域土壤中微塑料污染的认识仍存在很大的空白。因此,本文以大辽河为研究对象,选取附近8个土壤样品,进行了微塑料的丰度与分布研究,以期更好地了解大辽河附近土壤中微塑料的污染状况,为我国流域土壤中微塑料的评估和治理提供科学数据。
1 材料与方法 (Materials and methods)
1.1 研究区域概况
大辽河地处辽河下游冲积平原,系指浑河、太子河合流后由三岔河至营口入海口的河段,河道全长97 km,流域面积1 962 km2。两岸土质为壤土和亚粘土沉积,地势平坦,河道蜿蜒曲折多变,属弯曲形河道。整个大辽河的流向是向西南,由三岔河经下坎子、石佛、赏军台、田庄台、水源至荣兴农场附近,流向折向东南,经鸭岛进入营口市,由营口市区流入渤海辽东湾。土壤采自大辽河附近,采样点分布如图1所示,采样时间为2018年9月。
图1 研究区域概况Fig. 1 Overview of the study area
1.2 实验材料与方法
1.2.1 实验试剂与仪器
实验试剂包括ZnCl2(分析纯,购自天津福晨化学试剂有限公司)、30% H2O2(分析纯,购自天津市风船化学试剂科技有限公司)、超纯水(实验室自制,用前过滤)。
实验仪器包括Magellan-MobleMapper 6手持GPS导航仪(美国麦哲伦导航定位公司)、FA2204电子天平(上海力辰仪器科技有限公司,中国)、OLYMPUS SZ61体式显微镜(Olympus Corporation,日本)、DH-101电热鼓风干燥箱(天津市中环实验电炉有限公司,中国)、LC-DMS-H双显恒温磁力搅拌器(上海力辰仪器科技有限公司,中国)、DB-2EFS石墨电热板(上海邦西仪器科技有限公司,中国)、标准不锈钢筛(5 mm和2 mm)。
1.2.2 实验方法
(1) 样品采集
随机选择若干个50 cm×50 cm正方形采样点,采样点的位置分别由GPS定位器确定,采集表面约5 cm厚的土壤,去除大型石头、树枝等杂质(>5 cm),铝箔包好,装入聚乙烯(PE)自封袋,做好标记后带回实验室,放置于4 ℃的冰箱内,直至分析。
(2) 样品处理
微塑料通常具有相对较低的密度(0.9~2.3 g·cm-3)[20]。对于具有高密度(2.6~2.7 g·cm-3)[21]的土壤,微塑料的提取常采用密度浮选法。饱和NaCl (1.2 g·cm-3)、ZnCl2(1.5~1.7 g·cm-3)、NaI (1.6~1.8 g·cm-3)、CaCl2(1.5 g·cm-3)和聚钨酸钠(SPT)常作为水体、沉积物、土壤中浮选微塑料的溶液[20,22-23],特别是NaCl和CaCl2,因为它们的成本低且没有潜在的污染[24]。也有研究采用甲醇和二氯甲烷溶液有效提取了土壤中的微塑料,并可在高温下蒸发至干燥后进行称重[25]。然而,这些萃取方法可能会高估微塑料的浓度,并导致土壤有机质在180 ℃时溶解[26]。Zhang等[27]用去离子水重复超声浮选,并用加热法去除微塑料样品中的杂质,从不同类型的土壤中成功分离提取出了聚乙烯(polyethylene, PE)、聚丙烯(polypropylene, PP),微塑料的回收率接近90%。Mani等[28]用蓖麻油结合双氧水消解法,从土壤和沉积物中分离出PP、聚苯乙烯(polystyrene, PS)、聚对苯二甲酸乙二醇酯(polyethylene terephthalate glycol, PET-G)、聚甲基丙烯酸甲酯(polymethyl methacrylate, PMMA)微塑料,并将该方法应用于莱茵河样品。余构彬等[29]用0.4 mol·L-1高锰酸钾与1∶3硫酸酸度等量混合,常温静置氧化24 h,使得甘蔗地土壤有机质的去除率达到90.90%,并结合饱和NaCl溶液浮选法,使得微塑料的检出率达到74.50%。
本研究选择较为常用的ZnCl2(ρ=1.5~1.7 g·cm-3)溶液作为密度浮选液,对采集的土壤样品进行微塑料的提取分离。具体步骤如下。每份土壤样品混匀,取300 g于60 ℃的恒温鼓风干燥箱中烘干。将干燥后的土壤混匀取150 g,过5 mm和2 mm的不锈钢筛[30],去除大型石头、树枝等杂质,将过筛样品分为三等份。实验前将ZnCl2溶液(ρ=1.5~1.7 g·cm-3)通过直径47 mm、孔径0.45 μm的混合纤维素酯膜(MF-Millipore TM Membrane Filter)过滤。将50 g过筛土壤(干重计)样品(n=3)置于500 mL玻璃烧杯中,加入150 mL ZnCl2溶液,于恒温磁力搅拌器上持续搅拌30 min,静置过夜。固液分层后,将上清液用真空抽滤装置进行抽滤,滤膜采用直径47 mm、孔径5 μm的纤维素滤膜(Whatman AE 98)。用少量去离子水多次冲洗滤器内壁,冲洗液一并过滤。将载有可疑微塑料的滤膜用不锈钢镊子转移至玻璃培养皿中,待消解。重复上述密度浮选操作3次(ZnCl2溶液重复利用),以期将上清液漂浮的物质全部收集至滤膜上。
将滤膜上的物质全部转移至200 mL玻璃烧杯中,用少量超纯水冲洗滤膜,冲洗液转移至上述烧杯中。本研究中浮选得到的漂浮物中还含有一些其他的残留杂质,这与其他研究相似[20]。因此,本研究采用双氧水消解法去除这些杂质[31]。向上述装有可疑微塑料的烧杯中加入100 mL 30%双氧水,用铝箔密封,在石墨电加热板上于60 ℃下消解样品中残留的有机物3 d,将烧杯中消解液再次真空抽滤,完成过滤前,多次反复使用超纯水淋洗滤器内壁,使目标物全部富集至滤膜上。用无齿不锈钢镊子将滤膜取下转移至60 mm洁净的玻璃培养皿中,室温干燥,待分析。
(3) 微塑料的定性与定量
用无齿不锈钢镊子和解剖针在体式显微镜下挑拣,将挑出的可疑微塑料置于混合纤维素网格滤膜(Whatman WME WHGR ST 47 mm 0.45 μm ME 25)上,并做好标记。按颜色和形貌特征分类,记录在电子表格中。再将样品单层平铺拍照,以最长一边计,测量可疑微塑料的尺寸(图2)。傅立叶显微红外光谱仪(Perkin Elmer Spotlight 400)工作条件:采用透射/反射模式,MCT检测器,波数范围4 000~750 cm-1,分辨率4.00 cm-1,扫描次数16次,光栅大小与累加次数随样品大小变化。采用显微红外光谱(μ-FTIR)的透射模式对所有粒径在0~500 μm的可疑微塑料进行测定;采用傅立叶衰减全反射(ATR-FTIR)对所有粒径在500~5 000 μm的颗粒进行聚合物成分的鉴定和官能团的表征。将图谱与购买的标准品谱库(萨特勒谱库)进行比对,规定匹配度达60%及以上的谱图对应的样品为微塑料,以此确定微塑料的成分。

图2 显微镜下的微塑料(放大倍数为20×)注:(a),(b)为碎片类;(c),(d)为薄膜类;(e)为泡沫类;(f)为颗粒类;(g),(h)为纤维类。Fig. 2 Microplastics under stereo microscope (magnification times 20×)Note: (a) and (b) are fragments; (c) and d are films; (e) is foam; (f) is particle; (g),(h) are fibers.
1.3 数据统计与处理
本实验结果采用平均值±标准偏差表示,土壤中微塑料丰度以“个·kg-1”(干重)为单位,数据统计在Microsoft Excell 2010中完成,绘图采用Origin 9.0软件进行。采用IBM-SPSS 22.0对采样区域微塑料丰度的差异进行显著性检验,显著性水平设定为α=0.05。
2 结果(Results)
2.1 大辽河土壤中微塑料的形状、粒径及组成
2.1.1 大辽河土壤中微塑料的形状特征
根据微塑料的形状特征,将微塑料分为薄膜、纤维、颗粒、泡沫和碎片(图2)。碎片类微塑料(图2(a),2(b))边缘整齐、有一定厚度、形状多样,有三角形、矩形和正方形等,质地较硬。薄膜微塑料(图2(c),2(d))质地较软而薄,颜色多种多样,边缘较不规则。泡沫类微塑料(图2(e))为轻质的、白色聚苯乙烯泡沫塑料。颗粒类(图2(f))微塑料为质地较硬的、规则的球状或椭球状的塑料颗粒。纤维类微塑料(图2(g),2(h))呈细而长的线状或极细的条状,较软,部分呈卷曲状或缠绕在一起。
由图3可知,整体上看,各形状的微塑料在微塑料总量中的占比由高到低顺序依次为:薄膜(57.36%)、碎片(32.21%)、泡沫(6.75%)、纤维(2.15%)和颗粒(1.53%)。不同形状的微塑料在各点的检出情况不同。碎片类和薄膜类微塑料在各点土壤中均有检出。而DL1检出的纤维类和颗粒类微塑料是8个采样点中最多的,在该点的微塑料数量中占比均为15.79%,分别占所有纤维类和颗粒类微塑料总量的42.86%和60.00%。DL8未检测到纤维类微塑料,DL2中薄膜类微塑料占该点微塑料的91.84%,占所有薄膜类微塑料总量的72.19%。DL3中碎片类微塑料占该点微塑料的91.38%,占所有碎片类微塑料总量的50.48%。DL5中泡沫类微塑料占比最大(45.95%),占泡沫类微塑料总量的77.27%。
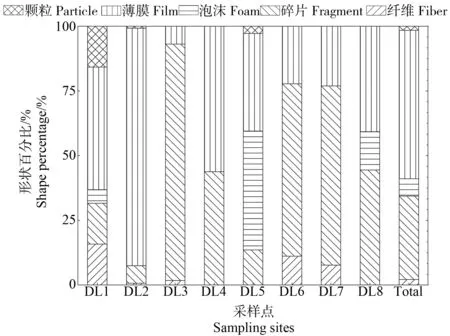
图3 大辽河土壤中微塑料的形状Fig. 3 Shape of microplastics in soil of Daliao River
2.1.2 大辽河土壤中微塑料的粒径特征
将所检出的塑料粒径分为0~100 μm、100~500 μm、500~1 000 μm、1 000~2 000 μm、2 000~5 000 μm、>5 000 μm共6个等级。如图4所示,经分析统计,8个土壤样品中各粒径范围内的塑料碎片在所有塑料总量中占比最高的为500~1 000 μm(41.10%),其次为1 000~2 000 μm(26.38%)、100~500 μm(19.33%)、2 000~5 000 μm(11.66%)、0~100 μm(0.92%)及5 000 μm以上(0.61%)。<1 000 μm的微塑料占微塑料总量的61.35%。其中,500~1 000 μm的微塑料占67.00%,其次是100~500 μm,占31.50%,0~100 μm的微塑料占比最小,为1.50%。各点不同粒径微塑料的分布存在显著差异(P=0.00)。DL1、DL6和DL7土壤微塑料粒径以1 000~2 000 μm为主,占比范围为46.15%~57.89%。DL2、DL3、DL4、DL5和DL8以500~1 000 μm为主,占比范围为37.04%~72.97%。在本研究中所有粒径为0~100 μm的微塑料仅在DL2、DL3中有分布。
2.1.3 大辽河土壤中微塑料的颜色特征
将检测出的微塑料大致分为白色、蓝色、黄色、绿色、红色、透明、黑色及彩色等类型。其中含量最多的为蓝色(43.87%)、其次为白色(32.82%)、绿色(11.04%)、黄色(6.13%)、彩色(3.07%)、透明(1.53%)、红色(0.92%)和黑色(0.61%)(图5)。不同颜色的微塑料在各采样点的占比情况不同。除DL2以蓝色为主,DL3以绿色为主外,2/3的土壤样品中白色微塑料占比均最大,占比变化范围为33.33%~83.78%。其中,DL5中白色微塑料在该点微塑料中占比最大,为83.78%,DL6中白色微塑料占比为33.33%。此外,DL1中仅观察到白色、黄色和黑色的微塑料。DL2仅观察到白色、蓝色和绿色微塑料。DL3除透明和黑色微塑料未观察到以外,其余颜色均有观察到。DL4白色微塑料占比最大,为50%,其次为透明,占31.25%。DL5中蓝色和黄色占比相同,均为8.11%。DL6中白色和绿色微塑料占比相同,均为33.33%。DL7中白色和黄色微塑料占比相同,均为38.46%。蓝色、红色和绿色微塑料占比相同,均为7.69%。DL8中白色微塑料占74.07%,其次为黄色(18.52%)、彩色(7.41%)。
2.1.4 大辽河土壤中微塑料的组成成分
对大辽河各采样点的微塑料进行红外光谱分析,按匹配度为60%,确定了微塑料的组成成分。挑出384个颗粒,其中微塑料颗粒共326个,即FTIR鉴定后假阳性的颗粒所占比例为15.10%。各聚合物类型(共20种)的微塑料中英文名称、英文缩写及在微塑料的总量中所占比例列于表1。由表1可知,大辽河土壤中微塑料的主要类型为聚乙烯(PE)、聚丙烯(PP)和聚苯乙烯(PS)。为便于统计分析,将聚11-溴代十一烷丙烯酸酯(PBA)、聚(N-甲基丙烯酰胺)(PMAA)、聚4-甲基己内酰胺(PMCL)、聚丁二炔二酯(PALE)、聚11-溴代十一烷甲基丙烯酸酯(PBMA)、聚(乙烯/4-甲基-1-戊烯)(PE/PMP)、聚十八烯(PODE)和聚十八烷基异氰酸酯(PODC)归于“其他”类型的聚合物中(图6)。

图4 大辽河土壤中塑料碎片的粒径分布Fig. 4 Particle size distribution of debris plastics in soil of Daliao River
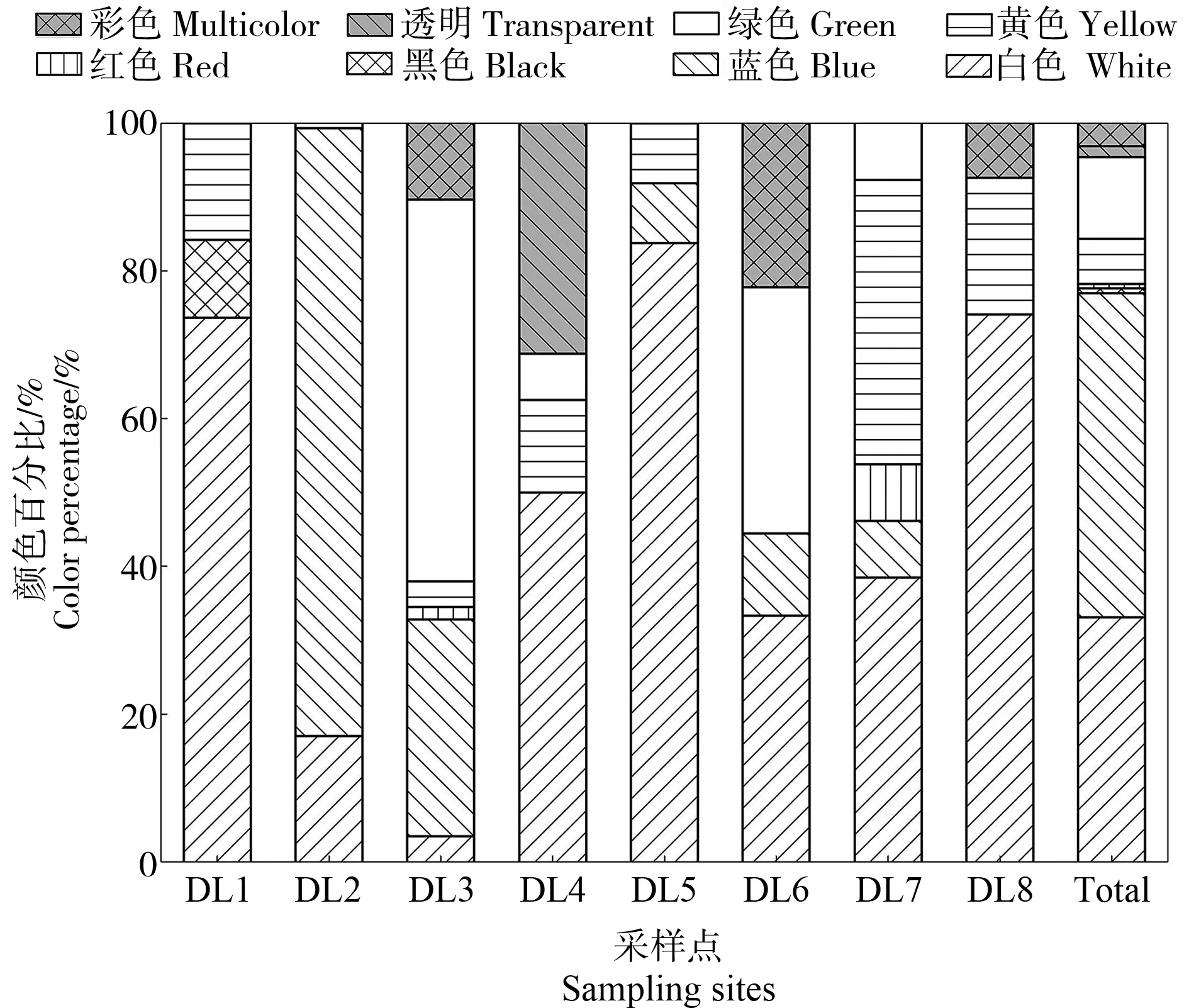
图5 大辽河土壤中微塑料的颜色Fig. 5 Color of microplastics in soil of Daliao River
由表1和图6可知,不同聚合物类型的微塑料在微塑料总量中所占比例不同。所有PE占50%,PP占24.23%,PS占7.67%,PA占2.15%,POA占3.07%,RY占3.25%,PODC占3.37%,其他微塑料占比<2.00%。各采样点不同种类的微塑料所占比例也不同。DL2中的PE在微塑料总量中占比最大,为87.76%。DL3中PP微塑料在微塑料总量占比最大,为82.76%。DL1中PA占比最大,为15.79%。DL5中PS在微塑料总量中占比最大,为45.95%。但PE和PP类微塑料在8个土壤样品中均有检出,占比变化范围分别为5.17%~87.76%和2.70%~82.76%。土壤中典型微塑料样品及对应微塑料标准品的红外光谱如图7所示。特别的,参考先前的研究将人造丝(Rayon)也归为微塑料的研究范畴[1,32-35]。

图6 大辽河土壤中微塑料的聚合物类型Fig. 6 Polymer types of microplastics in soil of Daliao River
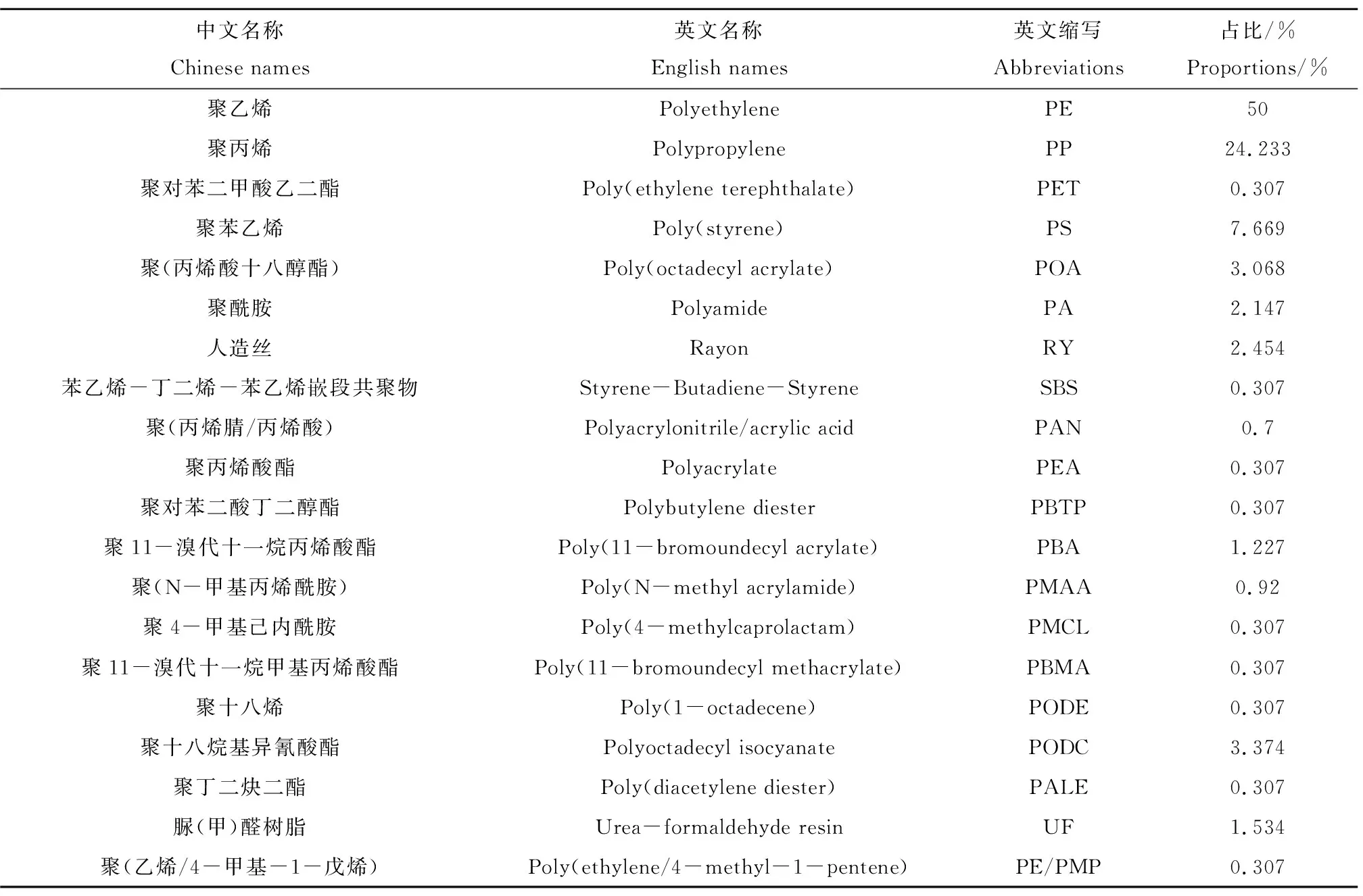
表1 大辽河土壤中微塑料聚合物类型Table 1 The microplastic polymer types in soil of Daliao River

图7 典型微塑料样品的红外光谱图Fig. 7 Infrared spectra of typical microplastics samples
2.2 大辽河土壤中微塑料的丰度及空间分布
如图8所示,在大辽河表层土壤中共检测出326个微塑料颗粒,微塑料在8个采样点的检出率为100%。本研究土壤样品中微塑料数量丰度介于(60±52.92)~(980.00±383.14) 个·kg-1(干重)之间,平均丰度为(273.33±327.65) 个·kg-1(干重)。各点丰度顺序由高到低依次为DL2>DL3>DL5>DL8>DL1>DL4>DL7>DL6。即大洼区、大石桥、鞍山海城市玉米地土壤中微塑料丰度高于辽中区耕地和大洼区大辽河入河口草地土壤。但盘山县、辽阳县柳壕镇玉米地土壤中微塑料丰度低于上述耕地和草地。因此,本研究中微塑料丰度与土壤利用方式有相关性,且丰度有显著性差异(P=0.001,<0.05)。将本研究中玉米地、草地、耕地的丰度进行比较,可以看出玉米地土壤微塑料平均丰度最大,其次是耕地、草地。该研究区域的上中游为浑河和太子河至河口汇入处之间的河段,包括DL5、DL6、DL7和DL8。下游为河口汇入处至入海口之间的河段,包括DL1、DL2、DL3和DL4。据此,大辽河流域土壤中微塑料的丰度顺序为:下游(406.33±216.21) 个·kg-1>上中游(143.33±101.65) 个·kg-1。

图8 大辽河土壤中微塑料的丰度Fig. 8 Abundance of microplastics in soil of Daliao River
3讨论 (Discussion)
3.1 研究区域土壤微塑料的形状、颜色、粒径及组成
目前,已有的研究结果表明,不同区域土壤中微塑料的形状有所差异。如渤海、黄海沿岸土壤中微塑料主要有泡沫、小球、碎片、薄片、纤维、薄膜和海绵等7种形态[16];滨海潮滩土壤中微塑料的类型有颗粒、碎片、纤维和薄膜,其中颗粒类占总数的3/4[19];上海蔬菜地农田土壤中微塑料的形状主要为碎片、薄膜和纤维[36]。福建漳浦近岸海域表层土壤中微塑料的形状类型为碎片、纤维、颗粒、泡沫和薄膜[37]。本研究中颗粒类微塑料在各形状的微塑料中占比最小(1.53%),薄膜类微塑料占比最大(57.36%),碎片类占32.21%,即碎片类和薄膜类微塑料占比之和超过85%。本研究中纤维类仅占2.15%,这一结果与渤海、黄海沿岸土壤中纤维类微塑料占1.0%[16]的结果相近,也与上海稻鱼共养土壤[38]、中国西南滇池河岸森林缓冲带及4种不同种植面积土壤[18]、智利迈珀河附近土壤[39]的结果形成了对比,这些区域中纤维类微塑料百分比均超过90%。存在这种差异的主要原因可能是微塑料的来源和材质不同[40]。例如,颗粒类占比较小的原因可能是颗粒状微塑料主要来自硬质塑料的分解,而硬质塑料分解需要较长时间[41]。
本研究中粒径<1 mm的微塑料占微塑料总量的61.35%。这一结果与渤海、黄海沿岸土壤粒径<1 mm的微塑料(60%)[16]、上海蔬菜农田深层土壤粒径<1 mm的微塑料(59.81%)[36]占比结果很相近,比滨海潮滩土壤粒径<1 mm的微塑料(49.8%)[19]、上海菜地农田表层土壤粒径<1 mm的微塑料(48.79%)[36]占比高,比墨西哥热带家庭花园土壤粒径<50 μm的微塑料(93.7%)[42]、瑞士漫滩土壤粒径<500 μm的微塑料(85%)[16]占比低。本研究中500~1 000 μm的微塑料占总数的41.10%,是所有粒径范围内占比最大的区间。进一步的分析发现(图9),粒径<1 mm的微塑料中,500~1 000 μm范围内的微塑料占比最大,为67.00%。且500~1 000 μm范围内的薄膜(66.00%)、泡沫(5.50%)和碎片类(26.50%)微塑料占比的高低顺序与总体规律一致,而纤维类微塑料在粒径<1 mm的微塑料中仅在100~500 μm内有分布。在所有纤维类微塑料中,微塑料粒径主要分布在1 000~2 000 μm(57.14%)。颗粒类微塑料在100~500和500~1 000 μm范围中的占比相同,而所有颗粒类微塑料的粒径主要集中在1 000~2 000 μm之间(60.00%)。Doyle等[43]的研究结果中也未发现<1 mm的纤维。在目前报道的研究中土壤微塑料的粒径大部分以<1 mm为主[15-16,18,36,38-39,42]。在不同粒径的微塑料中,<1 mm或微米级的微塑料更易进入生物体内[44-45],这种尺寸范围的微塑料与许多海洋生物的食物尺寸相近,很可能被它们误食,进而对这些生物群落产生潜在的威胁[46]。因此未来对丰度较高、颗粒更细的<1 mm的微塑料应给予更高的关注。

图9 大辽河土壤微塑料的形状与粒径分布Fig. 9 Shape and particle size distribution of microplastics in soil of Daliao River
当前的报道中土壤中微塑料的成分各不相同。如渤海、黄海沿岸土壤[16]中微塑料的主要成分为PE、PP、PS、PE/PP和聚氨酯(PEU)。墨西哥热带家庭花园土壤中微塑料的主要组成为PE、PS[42]。Scheurer和Bigalke[17]的研究结果表明,瑞士漫滩土壤中微塑料的主要类型为PA、聚碳酸酯(PC)、PE、PP、聚氯乙烯(PVC)和丁苯橡胶(SBR),其中最主要的是PE。澳大利亚悉尼工业区土壤中微塑料主要类型为PVC[25]。而本研究中微塑料的主要成分为PE和PP。这与上海菜地农田土壤[36]、上海稻鱼共养土壤[38]的结果相同。由图10可知,本研究中微塑料的形状与聚合物类型有关。薄膜类微塑料的主要成分为PE、PP和PA,其中PE占比最大,为77.54%,其颜色以蓝色、白色为主,推测其来源主要是日常生活中的塑料制品如膜类食品包装袋及鱼饲料编织袋上的防水薄膜层[46],此外,地膜在工程和农业上的应用也是潜在的来源[46-47]。碎片类微塑料的成分包括PE、PP和POA,其中PP占64.76%。其颜色以绿色、白色和蓝色为主,推测其来自化肥、水泥的塑料编织包装袋的破碎分解。颗粒类的组成有PE、PP、PEA和PS,占比最大的为PS(占微塑料总量的0.61%)。泡沫类微塑料的成分只有PS,颜色为白色,说明了这2种材质的微塑料有相同的来源,包括聚苯乙烯泡沫塑料和岸边的缓冲材料、以及海水养殖中使用的泡沫浮标及个人清洁护理品中的微珠等[48-50]。纤维类微塑料的主要成分包括PP、PA、PAN和SBS等,其中PA占比最大,为42.86%。其颜色以白色、黄色为主,它们可能来自于附近居民服装和纺织行业的织物洗涤后的污水排放[51]。此外,渔具、大气沉积和地表径流也是塑料纤维的潜在来源[52-53]。而福建漳浦近岸海域表层土壤[37]中泡沫塑料均为聚乙烯(PE),纤维塑料均为聚酯纤维(PES),碎片塑料多为聚丁烯(PB)。这一结果与本研究结果存在差异。

图10 大辽河土壤中不同形状微塑料的聚合物类型Fig. 10 Polymer types of microplastics in different shapes in soil of Daliao River
3.2 研究区域土壤微塑料的丰度及空间分布特征
ANOVA统计分析可知,大辽河各采样点土壤中微塑料的丰度存在显著差异(P=0.001,<0.05)。本研究大辽河土壤中微塑料的丰度为(60±52.92)~(980.00±383.14) 个·kg-1(干重),与渤海、黄海沿岸土壤微塑料的丰度值50~1 000 个·kg-1很相近[16]。低于中国西南滇池河岸森林缓冲带及4种不同种植面积土壤的7 100~42 960 个·kg-1[18]、智利迈珀河附近土壤的18 000~41 000 个·kg-1[39]、墨西哥热带家庭花园土壤的(900±1 900) 个·kg-1[42],高于滨海潮滩土壤的634 个·kg-1[19]、上海菜地农田深层土壤的(62.50±12.9) 个·kg-1[36]、上海菜地农田表层土壤的(78±13) 个·kg-1[36]、上海稻鱼共养土壤(10.3±2.2) 个·kg-1[38]等。此外,澳大利亚悉尼工业区土壤[25]中微塑料丰度为0.03%~6.70%(300~67 500 mg·kg-1)。Ramos等[54]发现阿根廷土壤中PE膜残留量为3 g·m2,平均尺寸为28 cm2,占采样区域土壤表面积的10%。Scheurer和Bigalke[17]的研究结果表明,瑞士洪泛区土壤中的微塑料污染较轻(≤0.00555%,≤593个·kg-1)。国内有关土壤(主要为农田土壤)样品中微塑料含量较低(≤320 个·kg-1)[36,38]。由此可知,大辽河土壤微塑料的丰度为(273.33±327.65) 个·kg-1处于中等偏低水平。
不同形状的微塑料在不同利用方式的土壤中的空间分布情况也不同。薄膜类微塑料在草地、玉米地和耕地中均有检出,主要分布在玉米地中(平均值556.67 个·kg-1;百分比89.30%)。其中,大洼区玉米地薄膜类微塑料占72.19%。颗粒类微塑料也主要分布在大洼区草地中(60 个·kg-1,60%)。泡沫类微塑料主要在鞍山海城市的玉米地检出(340 个·kg-1,77.27%),纤维类微塑料主要在大洼区草地检出(60 个·kg-1,42.86%),此外,2/3的玉米地也检测到了纤维状微塑料。碎片类微塑料在3种土壤类型中均有检出(2 100 个·kg-1),其中,大石桥玉米地碎片类微塑料最多(1 060 个·kg-1,50.48%)。造成这一结果的原因可能是为了轮作、倒茬、提早上市以及提高玉米的商品价值,该区域大多采用盖拱膜或盖地膜方式种植,这些留在土壤中的塑料薄膜在物理、化学和生物效应的综合作用下,可以慢慢地破碎成更小的塑料[55-56],进而导致微塑料污染。也可能是该区域的土壤有污泥改良和污水灌溉史[18],包括衣物洗涤水、生活污水或个人护理品中微珠的排放等,使得微塑料含量较高。Majewsky等[31]也发现,废水中PE和PP的总浓度为80~260 mg·m-3。这些塑料制品可能通过处理过的废水或自然洪水灌溉进入农田土壤。此外,大气沉积也可能是进入表层土壤的微塑料的一个重要来源。如对偏远的高山地区土壤中微塑料的检测结果表明,空气沉积可能是某些地区的主要来源[17]。土壤采样深度[36]、微塑料提取方法的不同等也可能是土壤微塑料丰度差异的原因。
综上所述,大辽河流域土壤中微塑料的检出率为100%。薄膜和碎片类微塑料百分比分别为57.36%、32.21%,是占比最大的2类微塑料。其次为泡沫(6.75%)、纤维(2.15%)和颗粒(1.53%)。该研究区域微塑料粒径基本遵循粒径越小,数量越多的规律。<1 mm的微塑料占微塑料总量的61.35%。其中,500~1 000 μm的微塑料占67.00%,其次是100~500 μm,为31.50%,0~100 μm的微塑料占比最小,为1.50%。>1 mm的微塑料中,1~2 mm的微塑料占68.25%,2~5 mm的占30.16%,>5 mm的塑料碎片占1.59%。大辽河流域土壤样品中共检测出20种微塑料,其主要类型有PP、PE、PS、POA、PA和RY等。其中,PE占50%,PP占24.23%,是占比最大的2类微塑料。微塑料的形状类型与组成有关,薄膜类微塑料的主要成分为PE,碎片类微塑料的主要成分为PP。颗粒类、泡沫类微塑料的成分为PS。纤维类微塑料的主要成分为PA。各采样点微塑料丰度具有显著差异,其中,DL2(大洼区玉米地)微塑料丰度最大,为(980.00±383.14) 个·kg-1(干重),DL6(辽阳县柳壕镇玉米地)丰度最小,为(60±52.92) 个·kg-1(干重)。大辽河流域土壤中微塑料平均丰度为(273.33±327.65) 个·kg-1(干重),与现有研究结果相比,大辽河流域土壤中微塑料污染状况处于中等偏低水平。

