白洋淀典型抗生素与底栖藻类群落指标相关性研究
张璐璐,申立娜,张玲菲,秦珊,姚波,2,崔建升,2
1. 河北科技大学环境科学与工程学院,石家庄 050000 2. 河北省污染防治生物技术实验室,石家庄 050000
抗生素可分为磺胺类、喹诺酮类、四环素类、大环内酯类、聚醚类、β-内酰胺类、林可霉素类、氯霉素类、多肽类、氨基糖苷类及其他种类[1-2],其具有水溶性、耐降解或转化、化学结构和作用机理复杂等特点[3],在不同的pH条件下可呈现为中性、阳离子、阴离子或两性离子[1]。近几十年来,抗生素被广泛应用于人类医疗和兽药中,并在牲畜和水产养殖中使用量颇大[4]。2017年中国抗生素消费量高达12万t[5],其中约有84 240 t抗生素用于兽药[6]。而抗生素进入机体后不能被完全吸收,约90%随粪便或尿液以母体化合物或代谢物的形式排出[7],最终进入水环境。来源于医疗、畜禽和水产养殖等的抗生素直接或间接进入污水处理厂,而污水处理厂对于喹诺酮类抗生素的去除效率仅有9.35%~26.96%[8-10],抗生素最终随污水处理厂出水排放进入环境[11]。研究表明,抗生素在地表水[12-21]、地下水[22]、饮用水[23]和海洋[24]中均被检出,因此越来越多的研究者开始关注其对水生态系统的生态效应。
河北省作为我国制药大省,拥有华北制药、石家庄制药、神威药业和以岭药业等众多大型制药企业[25-26]。此外,河北省人口密集,抗生素的消费量随经济快速发展也显著增加,使得大量未经有效处理的含抗生素废水、生活污水排入水环境中,加剧了河北省水环境中抗生素的污染形势[27-28]。白洋淀作为河北省内最大的潜水草型湖泊,由于当地自然条件限制和经济快速发展,使得白洋淀面临着污染负荷严重的问题[29-30]。除上游的保定市中含抗生素的城市污水和生活废水经府河进入白洋淀外[31],大淀周围的众多水产养殖使用含抗生素兽药,也造成白洋淀抗生素的严重污染[21,32],其中,喹诺酮类抗生素(quinolones, QNs)尤为严重。
底栖藻类作为湖泊中主要的生产者,为其他水生生物提供营养,其对抗生素也比较敏感[33],然而,目前研究者多关注抗生素的时空分布、风险值及其源解析[34],而对抗生素和底栖藻类的相关性研究较少。因此,为研究QNs和底栖藻类群落结构和功能指标的相关性,本研究主要考察:(1)解析白洋淀典型抗生素QNs的时空分布特征;(2)评价白洋淀QNs生态风险;(3)分析底栖藻类群落结构和功能指标;(4)建立QNs生态风险与生物群落结构和功能指标相关关系。
1 材料与方法(Materials and methods)
1.1 研究区域
白洋淀(38°44'N~38°59'N,115°45'E~116°06'E)位于我国河北省保定市雄安新区,其占地面积约366 km2,水深范围为2~6 m,由143个大小不一的淀泊组成,周围与36座村庄相连。随着人口增加和经济增长,白洋淀生态环境不断恶化,多种污染物在白洋淀内被检出,如持久性有机物、重金属等。此外,由于水产养殖废水和生活污水直接排放,白洋淀内普遍存在抗生素的污染。
1.2 水样采集与理化特征
本研究设定了8个采样点(图1),分别于2017年4月、8月和11月在各采样点采集水样,并按照前人研究的方法进行采样[30]。部分理化参数包括温度(temperature, T)、透明度(transparency, Trans)、水深(water depth, WD)、pH值和溶解氧(dissolved oxygen, DO)在采样时进行测定,其他参数包括总氮(total nitrogen, TN)、总磷(total phosphorus, TP)和化学需氧量(chemical oxygen demand, CODMn)等根据标准方法[35]在实验室测定(表1)。所有样品标记好在24 h内运回实验室,并于-20 ℃的暗处冷冻保存,待实验测定。
1.3 典型抗生素的分析方法
根据研究可知[36],喹诺酮类抗生素(QNs)普遍存在于沉积物(65.50~1 166.00 μg·kg-1)和水生植物中(8.37~6 532.00 μg·kg-1),因此,本研究选取QNs作为白洋淀目标抗生素。环丙沙星(ciprofloxacin, CIP)、丹诺氟沙星(danofloxacin, DAN)、依诺沙星(enoxacin, ENO)、恩诺沙星(enrofloxacin, ENR)、氟罗沙星(fleroxacin, FLE)、氟美喹(flumequine, FLU)、马波沙星(marbofloxacin, MAR)、诺氟沙星(norfloxacin, NOR)、氧氟沙星(ofloxacin, OFL)、奥比氟沙星(orbifloxacin, ORB)、恶喹草酸(oxolinic acid, OXO)、吡哌啶酸(pipemidic acid, PIP)和沙氟沙星(sarafloxacin, SAR)均取自Sigma-Aldrich(Steinheim, Germany),所有试剂均属于分析纯(纯度>95%)。此外,同位素标记的化合物danofloxacin-d5用作内标。
本研究采用利用超高效液相色谱串联质谱法(HPLC-MS/MS)测定QNs的浓度。使用Agilent 1200系列HPLC系统(Agilent, Palo Alto, USA),通过Agilent Zorbax XDB-C18色谱柱(2.1 mm×50 mm, 1.8 μm)实现QNs的分离。流动相A为0.1%的甲酸水溶液(V/V),流动相B为含0.1%甲酸的甲醇溶液(V/V),其流速为0.3 mL·min-1,控制温度为40 ℃,进样量为5 μL,干燥气体温度为350 ℃。在配备电喷雾离子化源(ESI+/ESI)的Sciex API 4000三重四级杆质谱仪(美国应用生物系统公司)上进行了测量,气体温度为350 ℃,流速为12 L·min-1,雾化器压力为45 psi,毛细管电压为-3 500 V(负模式)、+4 000 V(正模式),加速电压为4 V。
本研究采用内标法定量。配制浓度分别为0.1、0.5、1.0、5.0、10.0、50.0和100.0 μg·mL-1的抗生素标准溶液,并设空白组。标准曲线的相关系数范围为0.992~0.999。QNs的回收率为73%~110%,实验的相对标准偏差为3.40%~14.50%。以信噪比为10的浓度计算的定量限(LOQs)为0.05~0.20 ng·L-1,信噪比为3的最低检出限(LODs)为0.02~0.08 ng·L-1。
图1 白洋淀采样点分布图注:S1.府河入淀口、S2.南刘庄、S3.王家寨、S4.烧车淀、S5.枣林庄、S6.圈头、S7.采蒲台、S8.端村。Fig. 1 The sampling sites of Lake Baiyangdian in this studyNote: S1. Fuhe inlet, S2. Nanliuzhuang, S3. Wangjiazhai, S4. Shaochedian, S5. Zaolinzhuang, S6. Quantou, S7. Caiputai, and S8. Duancun.
1.4 底栖藻类的采集与分析方法
在各采样点采集底栖藻类样品,收集方法参考前人的研究[30]。将采集的底栖藻类样品分为2份:一份加入0.5 mL 5%的福尔马林溶液进行成分分析,另一份保存于塑料瓶中进行计量分析。其生物指标包括藻密度(algal density, AD)、叶绿素a(chlorophyll a, Chl a)、叶绿素b(chlorophyll b, Chl b)、叶绿素c(chlorophyll c, Chl c)、叶绿素b/a(chlorophyll b/a, Chl b/a)、叶绿素c/a(chlorophyll c/a, Chl c/a)、硅藻比例(BAC)、绿藻比例(CHL)、蓝藻比例(CYA)、碱性磷酸酶(APA)、β-葡萄糖苷酶(GLU)、亮氨酸氨基肽酶(LEU)、多糖含量(PSC)、无灰干重(AFDW)和一般初级生产力(GPP)[30](表2)。
1.5 生态风险评估方法
根据欧盟委员会的技术指导文件[42]和已有研究[43],对QNs的生态风险进行了评估。本研究利用风险商值法(RQ)计算了底栖藻类的QNs生态风险,该值由实测环境浓度(MEC)与预测无效应浓度(PNEC)的比值求得,其中PNEC由L(E)C50与安全系数(f=1 000)的比值计算求得,具体计算方法如下:
RQ=MEC/PNEC=MEC/(L(E)C50/f)
(1)
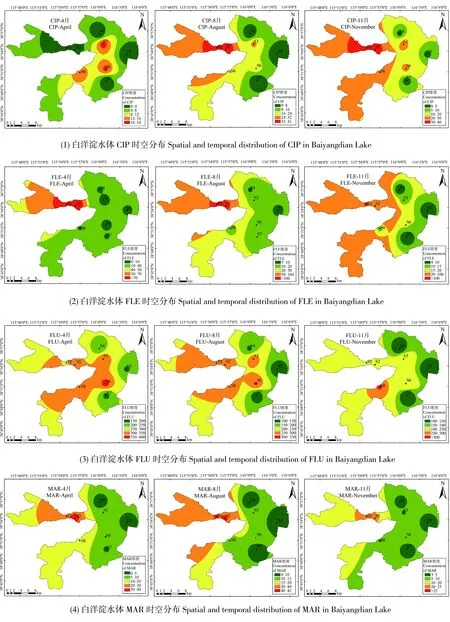
根据Hernando等[45]的分类方法,将生态风险分为3个层次:低风险水平(RQ<0.1)、中等风险水平(0.1 根据水质理化特征,通过聚类分析将8个采样点进行分类。对白洋淀QNs的生态风险水平与底栖藻类的结构和功能指标进行Spearman相关性分析,建立两者之间的相关关系,显著性水平分别为P<0.05和P<0.01。聚类分析和相关性分析采用SPSS 16.0统计分析软件。利用ArcGIS软件对白洋淀QNs进行时空分布描述,绘制其时空分布图,QNs的生态风险时空分布热点图用Origin绘制。 表1 白洋淀水体理化参数特征Table 1 The chemical and physical attributes in water for Baiyangdian Lake, China 表2 底栖藻类群落的结构和功能指标Table 2 The structure and functional metrics based on the periphyton community 注:D630、D647、D664和D750分别为630、647、664和750 nm处的吸光度;Ve为萃取容量;A为底质表面积;d为比色管的光学长度。 Note: D630, D647, D664 and D750 are the absorption of the extraction at 630, 647, 664 and 750 nm, respectively; Ve is the constant volume of extraction;A is the area of substratum surface; d is the optical length of the cuvette. 为确定QNs对解释底栖藻类指标变化的相对重要性,使用CANOCO 4.5版本软件对方根转化的丰度数据进行了冗余分析(RDA)[46]。RDA分析前进行了去趋势关联分析(detrended correlation analysis, DCA),发现总梯度长度小于标准差达3个数量级,说明环境变量与物种丰度和密度数据之间存在线性关系。为在分析中只保留重要的环境变量,选择蒙特卡罗排列试验(999个排列,P<0.05)。 表3 各喹诺酮类抗生素(QNs)对不同营养级的急性毒性(L(E)C50)Table 3 Acute toxicity (L(E)C50) used for the risk assessment of quinolones (QNs) for fish, invertebrate and algae 注:LC50表示半数致死浓度,EC50表示半数效应浓度,PNEC表示预测无效应浓度。 Note: LC50stands for median lethal concentration; EC50stands for concentration for 50% of maximal effect; PNEC stands for predicted no effect concentration. 根据水体理化参数特征,采用聚类分析的方法,将8个采样点分为3个生境:生境1(S1、S2)代表受城市污水影响;生境2(S3、S6和S8)代表受养殖废水和生活污水影响;生境3(S4、S5和S7)代表人为干扰较少(图2)。白洋淀水体主要理化参数如图3所示。 在14种目标抗生素中,有5种QNs被检出(图4),MAR、FLE、OFL、CIP和FLU浓度分别为9.84~82.43、16.11~223.09、32.51~367.70、0.00~77.34和321.64~1 054.38 ng·L-1。QNs浓度呈现明显的时空变化。就空间分布而言,QNs的最高浓度出现在生境1(1 309.80 ng·L-1),其次为生境2和生境3;就时间变化而言,4月QNs浓度最高,其次为8月和11月。QNs中以FLU污染(最高浓度为1 054.38 ng·-1)最为显著,其次为OFL(最高浓度为367.70 ng·L-1)和FLE(最高浓度为223.09 ng·L-1)。 图2 基于水体理化特征的聚类分析结果Fig. 2 The classify analysis results for sampling sites based on physical and chemical attributes 图3 白洋淀各生境不同时间的水体理化参数注:图中理化参数的单位列于表1。Fig. 3 Time course of water physiochemical properties at the different habitats for Baiyangdian Lake, ChinaNote: The unit for each physiochemical property in this figure could refer to Table 1. 生境1和生境2分别受上游城市污水和淀区养殖及周边生活污水影响较为严重,因此其QNs污染较为严重,人为干扰较少的生境3则QNs污染较小[21,32,34];QNs的浓度为4月>8月>11月,其原因可能是4月开始上游的保定市有大量城市污水排入淀内,再加上处于畜禽和水产品的繁殖期,大量含抗生素的兽用药物的投加,使得4月QNs浓度最高;到8月份,随着降水量的增大,地表径流量增大,使淀内水量大幅度增加,QNs的浓度有所降低;到11月,因畜禽和水产养殖处于淡季,兽用药物投加量有所下降,再加上夏季大量水草繁殖生长,沉积物和水体中的QNs被吸收和吸附,从而使得QNs浓度大幅度降低。由此可知,白洋淀上游的城市污水及周边养殖是QNs的主要来源,因此应加强对上游城市污水的QNs处理效率,做好来水的监测工作,严格管控兽药的使用。 MAR、FLE、OFL和CIP在白洋淀的生态风险水平较低(RQ值为0.0000~0.0020),FLU(RQ值为0.1704~0.5378)处于中等风险水平。其中,生境2的生态风险最高(RQFLU最大值为0.5378),其次为生境1(RQFLU最大值为0.3153)和生境3(RQFLU最大值为0.2980)(图5)。QNs的时空分布特征表明,生态风险与人为干扰程度存在直接关系。 图4 白洋淀中QNs时空分布注:QNs浓度单位为ng·L-1。Fig. 4 The spatial and temporal distribution of QNs in surface water of Baiyangdian LakeNote: The unit of QNs concentration is ng·L-1. 图5 白洋淀中QNs生态风险的时空分布注:RQs为风险商值。Fig. 5 The spatial and temporal variation of ecological risk of QNs in waterNote: RQs stands for risk quotient. 调查期间测定的AD范围为(15.31±1.78)~(78.98±18.45) (104cells·cm-2);Chl a、Chl b、Chl c、Chl b/a和Chl c/a的浓度范围分别为(0.03±0.01)~(0.22±0.02)、(0.01±0.00)~(0.14±0.03)、(0.01±0.00)~(0.12±0.05)、(0.05±0.02)~(0.39±0.04)和(0.18±0.03)~(0.68±0.08) μg·cm-2;BAC、CHL和CYA的范围分别为(5.67%±0.76%)~(24.32%±3.42%)、(36.12%±3.41%)~(60.42%±6.57%)和(29.18%±2.34%)~(40.91%±3.89%);APA、GLU和LEU的范围分别为(0.32±0.10)~(1.52±0.22)、(0.14±0.08)~(2.89±1.14)和(0.75±0.23)~(5.67±1.08) nmol·cm-2·h-1;PSC和AFDW的范围分别为(0.06±0.02)~(0.25±0.03) mg·cm-2和(158.65±43.21)~(809.65±212.43) μg·cm-2。AD、Chl a、Chl b、Chl b/a、CHL、CYA、APA、GLU、LEU和AFDW等指标在生境2中最高,而其他指标在生境3中最高,且大部分指标在8月始终最高(表4)。 生境2主要受淀区周边养殖废水和生活污水的影响,其偏中-富营养化和富营养化状态,因此其底栖藻类群落结构和功能指标较高[47];11月的水污染水平相对于4月和8月较低,抗生素可影响藻类的光合作用,而11月QNs浓度较低,对底栖藻类的抑制作用较小,因此,白洋淀底栖藻类群落指标在11月最高。 通过斯皮尔曼(Spearman)相关性分析,建立了底栖藻类指标与QNs的生态风险之间的关系。表5即底栖藻类指标与QNs的生态风险之间的Spearman相关系数。结果表明,AD、Chl a、Chl b、Chl c、Chl b/a与RQCIP、RQFLU呈显著相关,其中Chl a与RQFLU显著相关(r = 0.827,P<0.01),RQMAR与PSC呈显著负相关(r = -0.670,P<0.05),RQCIP与APA(r = 0.721,P<0.05)、LEU(r = 0.715,P<0.05)和AFDW(r = 0.727,P<0.05)呈显著性相关。在QNs抗生素的风险值中,RQFLU最高,与AD、Chl a、Chl b、Chl c、Chl b/a、Chl c/a、BAC和CHL等结构指标均显著相关。结构指标与功能指标相比,其与生态风险的相关性较高。 本研究选取底栖藻类群落结构和功能指标进行RDA分析,其特征值为0.990和0.008,解释了底栖藻类指标数据中99.8%的方差(图6)。LEU和AFDW与坐标轴1的相关性最大。轴1与RQCIP呈显著正相关(r =0.7294,P<0.05),将其解释为与城市污水相关。BAC和Chl c/a与轴2相关。轴2与RQFLU呈显著正相关(r =0.8884,P<0.01),其来源之一可能为水产养殖。此外,抗生素与底栖藻类指标存在显著的时间差异,因此应重视抗生素与底栖藻类的季节变化。 欧盟《水架构指令》指出,建立生态系统与污染物之间的关系是一项重要工作[48],因此,越来越多的研究者开始关注生物群落的组成,尤其是底栖生物群落的生物学指标[49]。然而,目前关于抗生素与底栖藻类结构和功能指标的相关性的研究较少[34]。一些研究预测,抗生素会对底栖藻类产生不同的影响[50-55],相关研究结果表明,抗生素对硅藻有明显的抑制作用,而抗生素对蛋白核小球藻和淡水绿藻的生长则表现为“低促高抑”[51-52,55],而其余11种常见的底栖藻类不受抗生素的影响[56]。本研究首次探讨了QNs对湖泊底栖生物群落的影响,其结果与上述预测相符,如BAC与RQFLU呈显著负相关(r=-0.782,P<0.01);CHL与RQFLU呈显著正相关(r=0.764,P<0.05),表明BAC和CHL受抗生素影响,而CYA不受其影响,突出了不同抗生素对底栖藻类群落的不同影响。 图6 基于底栖藻类指标的冗余分析(RDA)注:底栖藻类指标(黑色箭头)与坐标轴的相关性为-0.6~1.2,环境变量(红色箭头)与坐标轴的相关性为-1.0~1.0;1表示4月生境1,2表示4月生境2,3表示4月生境3;4表示8月生境1,5表示8月生境2,6表示8月生境3;7表示11月生境1,8表示11月生境2,9表示11月生境3。Fig. 6 Correlation biplots for the first and second axes of the redundancy analysis (RDA) based on the periphyton metricsNote: The scale is -0.6 to 1.2 for correlations of the periphyton metrics (black arrows) with the axes and -1.0 to 1.0 for correlations of the environmental variables (red arrows) with the axes; the abbreviation codes for the biological metrics refers to Table 2; 1 means Habitat 1 in April, 2 means Habitat 2 in April, 3 means Habitat 3 in April; 4 means Habitat 1 in August, 5 means Habitat 2 in August, 6 means Habitat 3 in August, 7 means Habitat 1 in November, 8 means Habitat 2 in November, and 9 means Habitat 3 in November. 表4 白洋淀底栖藻类结构和功能指标的时空变化Table 4 Time course of periphyton structural and functional metrics at the different habitat for Baiyangdian Lake, China 表5 生物指标与风险值的Spearman相关系数Table 5 The Spearman’s correlation coefficients between biotic metrics and risk indexes 注:*在0.05级别,相关性显著;**在0.01级别,相关性显著。 Note: *Correlation level at 0.05, **correlation level at 0.01. 不同的藻类对QNs的敏感性存在一定差异,其原因有藻类细胞的大小和种间竞争。体积较小的藻比体积大的更为敏感(硅藻体积小,比表面积大,因此硅藻对QNs比绿藻更敏感)。此外,由于营养物质和其他资源的种群间竞争,硅藻数量的降低使得绿藻优势增加。 QNs的最高浓度出现在生境1(1 309.80 ng·L-1),其次为生境2和生境3,上游含抗生素的城市污水的排入,使得生境1的QNs浓度偏高;生境2的生态风险最高(RQFLU最大值为0.5378),其次为生境1(RQFLU最大值为0.3153)和生境3(RQFLU最大值为0.2980),表明生态风险与人为干扰程度存在直接关系,干扰程度较高的地方生态风险则偏高,干扰程度较低的地方生态风险则偏低;AD、Chl a、Chl b、Chl b/a、CHL、CYA、APA、GLU、LEU和AFDW等指标在生境2中最高,而其他指标在生境3中最高,表明藻类的群落结构和功能指标与人为干扰程度呈现负相关性,人为干扰程度低的地方藻类的群落结构和功能指标则偏高。QNs生态风险与底栖藻类群落结构和功能指标相关性结果显示,与这二者均具有显著相关性,且底栖藻类的结构指标与QNs生态风险的相关性更为显著。 综上所述,白洋淀水体中QNs的使用量、检出率、浓度和生态风险时空分布均存在明显的差异性,不同区域QNs的来源也不同;白洋淀底栖藻类群落结构和功能指标也存在明显的时空分异特征,其主要与水体营养水平、污染程度和光合作用强弱有关;白洋淀底栖藻类群落结构指标与QNs风险值相关性较为显著,因此,可考虑筛选较为敏感的底栖藻类群落结构指标运用于生态监测,为富营养化湖泊生态监测方法研究提供理论基础及相关数据支撑。1.6 统计分析



2 结果(Results)
2.1 白洋淀理化特征及其生境划分

2.2 白洋淀QNs的时空分布


2.3 白洋淀QNs生态风险时空分布


2.4 底栖藻类群落结构和功能指标时空分布
2.5 白洋淀QNs生态风险与底栖藻类群落指标相关性分析
3 讨论(Discussion)




