瘤胃可降解淀粉:决定反刍动物消化道健康与养分利用的关键日粮因子
姚军虎 申 静
(西北农林科技大学动物科技学院,陕西杨凌712100)
反刍动物的瘤胃内栖居着大量的微生物,可通过 发酵日粮碳水化合物产生挥发性脂肪酸(VFA)和ATP,为机体供能和用于微生物蛋白质合成。非纤维性碳水化合物是反刍动物主要的能量来源,在高产反刍动物日粮中占40%~50%,淀粉是其主要组成成分(Ortega 等,2003),淀粉在瘤胃的降解速率与降解量是影响瘤胃代谢和健康的重要营养因素(Zebeli 等,2010)。生产中常通过改变谷物来源及其加工方式调控淀粉的瘤胃降解特性。随着对养分营养实质认识的提高,奶牛日粮营养指标的有效性不断改进,奶牛生产性能和产奶效率也随之提高(图1),但NRC(2001)和我国(NY/T 34—2004)奶牛饲养标准中仍采用日粮淀粉含量这一表观指标,不能反映降解位点对淀粉能量效率的影响。瘤胃可降解淀粉(RDS)可用于评价日粮淀粉对瘤胃与机体代谢的影响(Huhtanen等,2006;Zebeli等,2010;李飞,2014)。本文总结本团队近年研究,综合论述日粮瘤胃可降解淀粉(RDS)对反刍动物胃肠道代谢与健康及生产性能的影响,为优化反刍动物淀粉利用和高效精准日粮设计提供依据。

图1 奶牛营养评价指标演变
1 日粮淀粉的降解与调控方式
反刍动物日粮淀粉包括RDS 和过瘤胃淀粉(RES)。通常,谷物淀粉在瘤胃的降解率约为75%~80%,进入小肠的淀粉约有35%~60%被降解(消化),到达后肠道的淀粉约有35%~50%被降解(Harmon,2009)。
1.1 淀粉的瘤胃微生物降解
淀粉在瘤胃内被微生物分泌的淀粉酶水解为单糖,进入胞内代谢产生VFA,并释放能量用于微生物蛋白合成(Huntington 等,2006)。瘤胃内主要的淀粉降解菌包括普雷沃氏菌(Prevotella)、嗜淀粉瘤胃杆菌(Ruminobacter amylophilus)、溶淀粉琥珀酸单胞菌(Succinimonas amylolytica)、反刍兽新月形单胞菌(Selenomonas ruminantium)、牛链球菌(Streptococcus bovis)和双歧杆菌属(Bifidobacterium)(冯仰廉,2006)。这些微生物通过产生α-1, 4 和α-1, 6 淀粉酶水解直链和支链淀粉的糖苷键,释放寡糖(表1)。瘤胃微生物分泌的碳水化合物活性酶(CAZymes)根据其序列特异性分为:糖苷转移酶(GTs)、糖苷水解酶(GHs)、多糖裂解酶(PLs)和碳水化合物酯酶(CEs),碳水化合物结合模块(CBMs)和辅助模块酶(AAs)(Boraston 等,2004;Vincent 等,2014)。GHs 中含大量酶能够降解多糖如淀粉、纤维素、半纤维素、木质素和几丁质等(Stewart等,2018)。负责淀粉水解的GHs 主要有:GH13、GH31、GH57 和GH77,其中GH13 是主要的淀粉水解家族,GH13-CBM48 是主要的淀粉水解酶体系(Machovic等,2008;Sophie等,2017;Zhang等,2017)。

表1 淀粉水解酶
以Bacteroides thetaiotaomicron 为例展示淀粉被微生物降解的过程(如图2)。在B. thetaiotaomicron的基因组中有236 个GHs 和15 个PLs,在淀粉降解过程中起重要作用的基因集sus 含8 个基因。B. thetaiotaomicron 细胞表面具有麦芽糖诱导的外膜蛋白SusC、SusD、SusE 和SusF,结合淀粉分子。SusG 编码支链淀粉酶剪切直链和支链淀粉的α-1, 4 糖苷键,将淀粉分子剪切成寡糖分子,使其进入细胞质。SusA 存在于细胞周质中,在寡糖通过细胞质膜时水解寡糖。
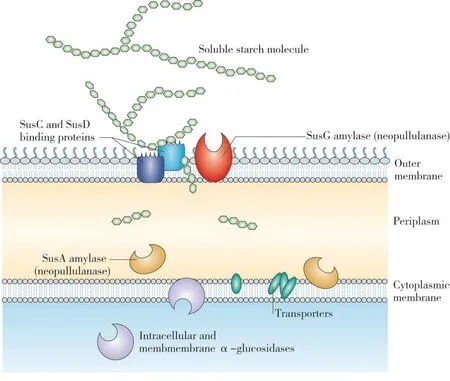
图2 Bacteroides thetaiotaomicron的淀粉降解过程(Flint等,2008)
1.2 淀粉的小肠酶解
在胰腺α-淀粉酶的作用下,淀粉在小肠被水解为糊精和寡糖,继而被肠黏膜分泌的二糖酶水解为葡萄糖,进入后续代谢或周转。淀粉在瘤胃内被微生物降解的过程中伴随着气体产生和热量耗损,且微生物代谢也消耗能量。因此,淀粉在小肠被直接酶解为葡萄糖的能量利用率更高(Harmon,2009)。为降低亚急性瘤胃酸中毒风险和提高日粮淀粉利用效率,有学者提出增加日粮过瘤胃淀粉含量的观点。然而,反刍动物胰腺淀粉酶分泌相对不足,导致小肠淀粉消化率不到60%,故仅将淀粉消化位点从瘤胃转移至小肠并不能提高其整体利用效率。针对“胰腺α-淀粉酶分泌不足限制反刍动物小肠淀粉的消化与利用”这一关键科学问题,本团队持续开展十余年研究工作,提示一些支链和功能性氨基酸(如苯丙氨酸、亮氨酸和缬氨酸等)可通过调节胆囊收缩素分泌和激活mTOR通路促进胰腺发育和胰酶合成,进一步提高小肠淀粉消化利用(Liu 等,2015;Ren 等,2020a;郭龙,2019;姚军虎,2013;于志鹏,2013)。
1.3 日粮淀粉降解特性的调控
瘤胃淀粉降解量受日粮淀粉含量、淀粉降解率和瘤胃食糜的流通速率等因素的影响。改变谷物含量、选择谷物类型及其加工方式可调控日粮瘤胃可降解淀粉含量(Offner 等,2003)。谷物的淀粉特性影响其降解率:淀粉的晶体结构、颗粒大小和形状、直链淀粉和支链淀粉的含量以及蛋白质基质的存在是决定植物淀粉特性的主要因素(French,1973)。与玉米相比,大麦和小麦淀粉中的支链淀粉比例更高,不溶性蛋白包被较少,更有利于微生物的接触,故其淀粉的瘤胃有效降解率更高(Mosavi 等,2012;Callison 等,2001)。
根据冷热干湿方法,谷物饲料的加工方式可分为:干冷、冷湿、干热和湿热加工法。生产中常用的有破碎、蒸汽碾压和蒸汽压片。破碎降低了谷物原料的颗粒大小,进而增加了淀粉与瘤胃微生物的接触面积,提高其瘤胃降解率。对玉米进行蒸汽压片处理会提高淀粉降解率(Zebeli 等,2010)。蒸汽压片是将谷物经过高温蒸汽处理使谷物糊化,再经压片将蛋白质包被破裂,使淀粉颗粒释放出来,从而增加其与微生物的接触面积,提高降解率(Kotarski 等,1992;Vonnie,2017)。
2 瘤胃可降解淀粉对瘤胃和后肠道代谢与健康的影响
增加反刍动物日粮RDS可促进瘤胃丙酸型发酵,有利于能量高效利用;但RDS 过高会导致异常发酵,造成瘤胃乳酸与内毒素积累,严重威胁瘤胃和机体健康,降低生产性能。
2.1 瘤胃可降解淀粉对瘤胃代谢与健康的影响
日粮RDS 增加可提高瘤胃VFA 产量,且瘤胃发酵模式趋向于丙酸型发酵(Ren 等,2020b)。在瘤胃微生物及相关酶作用下,葡萄糖转化为乙酸、丙酸和丁酸对机体的能量供给分别为葡萄糖原来能量(2 805 kJ/mol)的62%、109%和78%(Ryle 等,1990),可见,瘤胃丙酸型发酵的能量效率最高(李宗军,2018)。富含淀粉的日粮可促进丙酸产生菌增殖,抑制甲烷产生菌(Bannink 等,2006;Ellis 等,2008)。二羧酸(如天冬氨酸、苹果酸、延胡索酸)可通过琥珀酸途径生成丙酸,这一过程需利用氢,可与甲烷菌竞争氢,从而减少甲烷产生,降低能量损失(Offner 等,2006),增加瘤胃中的能量利用效率。
RDS 过高会增加瘤胃VFA 和乳酸产量,降低瘤胃pH 值,引发亚急性瘤胃酸中毒(SARA)(Gozho 等,2007;Li 等,2014a)。当瘤胃pH 值降至一定阈值(5.0~6.0)时,纤维降解菌活性明显下降(Mould 等,1983),进而降低日粮纤维的瘤胃降解率。反刍动物瘤胃中主要的纤维降解菌为白色瘤胃球菌(Ruminococcus albus)、黄色瘤胃球菌(Ruminococcus flavefaciens)和产琥珀酸丝状杆菌(Fibrobacter succinogenes)。本团队前期研究发现,日粮小麦部分替代玉米诱导奶山羊发生SARA 的模型中,显著降低R. flavefaciens 和F. succinogenes 丰度(Li 等,2014a),SARA组显著降低了苜蓿和玉米青贮的NDF 有效降解率(Li 等,2014b)。前期研究集中于日粮RDS 对瘤胃发酵特性及微生物组成的影响,本团队近期利用宏基因组学技术研究日粮RDS 对瘤胃微生物功能的影响,结果表明提高日粮RDS 含量可降低内切纤维素酶基因的碳水化合物活性酶家族GH9 的基因丰度。
小麦部分替代玉米增加日粮RDS 可引起奶山羊SARA,提高了瘤胃淀粉降解菌R. amylophilus 和S.amylolytica 的丰度,对小麦和玉米淀粉的瘤胃有效降解率无影响,但提高了玉米淀粉慢速降解部分的降解速率(Li等,2014b)。本团队近期开展的研究表明,高RDS可提高瘤胃中淀粉转葡糖苷酶的基因丰度,但降低了淀粉降解相关碳水化合物酶家族GH13-9 和CBM48 的基因丰度,说明高RDS 可能提高淀粉酶浓度但降低淀粉酶的水解活性。
2.2 瘤胃可降解淀粉对后肠道代谢与健康的影响
RES 大部分在小肠中由α-淀粉酶及二糖酶等催化水解成葡萄糖,其他则到达大肠,主要由大肠微生物降解生成VFA。高谷物日粮条件下,小肠未消化的淀粉进入大肠进行发酵,降低盲肠和结肠食糜pH值,造成LPS和生物胺积累,损害肠道上皮的紧密连接结构(Liu 等,2014)。本团队最新研究表明,提高RDS(小麦部分替代玉米)可降低泌乳期奶山羊盲肠MUC2的表达量与菌群抗压能力,增加菌群潜在致病性;类似地,通过粉碎玉米替代整粒玉米提高RDS,也降低了青年奶山羊结肠MUC2的表达量,提高了革兰氏阴性菌丰度,有提高LPS浓度和兼性厌氧菌丰度的趋势。与饲喂高精料不同,在日粮淀粉含量基本一致的前提下,提高RDS水平可降低到达后肠道的淀粉含量。上述结果提示,日粮高RDS对后肠道屏障的损伤并非由淀粉发酵导致,但是否与瘤胃或小肠的代谢产物有关,有待进一步研究。
3 瘤胃可降解淀粉对泌乳性能的影响
为满足高产泌乳反刍动物的能量需要,生产中常应用高精料或高谷物日粮,极易引起乳脂降低综合症(MFD),危害动物机体健康,造成经济损失。反刍动物MFD 的机制包括胃肠道消化和组织代谢两方面,主要因乳脂合成前体物的减少所致(Bauman 等,2003;Bauman,2011)。
反刍动物乳脂前体物质来源于两部分:小于C14和部分C16脂肪酸由乳腺上皮细胞从头合成;其他长链脂肪酸由血液吸收(Shingfield等,2013)。乳脂降低的原因包括:①瘤胃乙酸和丁酸产量不足限制乳腺乳脂合成(Sutton 等,1989);②肝脏损伤造成营养重分配,促进脂质β-氧化(Li等,2017);③瘤胃中的部分氢化产物抑制乳腺中乳脂的从头合成(Shingfield 等,2010);④胰高血糖素-胰岛素介导的乳腺组织和非乳腺组织营养分配(Jenny 等,1974)。本团队正在开展日粮RDS调控奶畜乳脂合成的相关试验,初步结果显示,高RDS 可下调乳脂合成相关基因的表达,降低奶山羊乳脂产量(Zheng 等,2020)。进一步分析瘤胃氢化细菌与瘤胃和乳中长链脂肪酸表明:高RDS降低了溶纤维丁酸弧菌属和假单胞丁酸弧菌属丰度,抑制了trans 10, cis 12-共轭亚油酸(CLA)向trans 11 C18∶1的转化,从而提高瘤胃液和乳中trans 10, cis 12-CLA浓度。前人研究报道,trans 10, cis 12- CLA可抑制奶畜乳腺上皮细胞中脂肪酸从头合成,诱导MFD,该调控途径对乳脂合成的贡献最高可达50%(Bauman,2011)。结果提示,提高RDS 影响瘤胃内细菌氢化过程,提高乳腺trans 10, cis 12-CLA 浓度,抑制乳腺乳脂合成,如图3。
肝脏作为反刍动物重要的免疫与代谢器官,可调控乳成分前体物进入乳腺。高精料日粮可提高瘤胃LPS浓度,损伤瘤胃上皮,且瘤胃LPS可移位至外周血液循环进入机体各组织、器官(Li 等,2017)。研究表明,LPS引发肝脏炎症反应,引起营养重分配,促进脂肪酸的β-氧化(Dong等,2013)。本团队研究亦发现:奶山羊高RDS显著提高肝脏L-肉毒碱和L-棕榈酰肉毒碱浓度,降低磷脂酰胆碱浓度及部分游离脂肪酸浓度,这表明高RDS促进脂肪酸β-氧化,阻碍甘油三酯转运,减少进入乳腺的乳脂前体物。
同时,研究结果表明奶山羊高RDS提高颈静脉碱性磷酸酶活性,提示胆管堵塞,影响胆汁正常分泌。与此同时,高RDS组提高肝脏牛磺鹅胆酸和牛磺脱氧胆酸浓度,降低乳动脉和乳静脉牛磺胆酸浓度。胆汁酸促进脂肪酸代谢,但胆汁酸对反刍动物乳脂含量与产量的影响有待进一步研究。
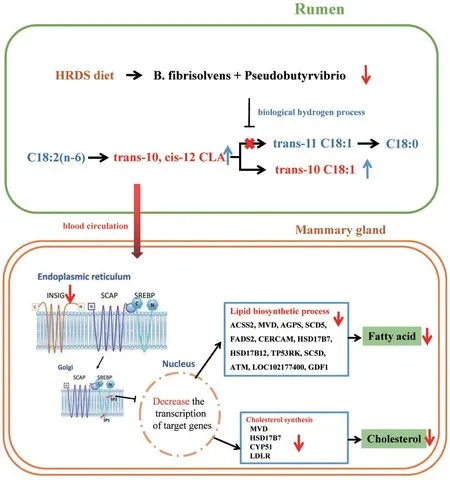
图3 日粮RDS影响奶山羊乳腺乳脂合成(Zheng等,2020)
4 日粮淀粉能量利用效率
饲料淀粉在消化道的降解位点显著影响淀粉的能量效率。提高淀粉在小肠中的消化率可提高淀粉的全消化道能量转化效率;当淀粉在小肠中的消化率高于75%时,增加淀粉在瘤胃中的降解率,淀粉的全消化道的能量转化效率降低;相反,当淀粉在小肠中的消化率低于75%时,增加淀粉在瘤胃中的降解率,淀粉的全消化道能量转化效率提高(图4)。
淀粉在瘤胃内降解的能量利用效率为小肠降解的61%~73%,平均为70%,在大肠内降解的效率仅为小肠降解的35%~50%(Harmon 等,2001)。 因此,我们可以预估淀粉在反刍动物整个消化道的能量利用效率,我们提出了日粮淀粉能量利用效率(SEF)的概念,计算方法为:
SEF(%)=0.70RDS+1.0SIDS+0.40LIDS
式中:RDS——瘤胃降解淀粉占日粮的百分比(%);
SIDS——小肠降解淀粉占日粮的百分比(%);
LIDS——大肠降解淀粉占日粮的百分比(%)。且假设淀粉在小肠完全降解的能量利用效率为1。从公式可看出,提高小肠可消化淀粉可提高淀粉的能量利用效率。
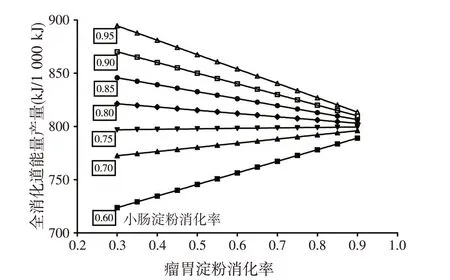
图4 根据淀粉在全消化道的消化率计算的淀粉能量效率(Harmon,2009)
SEF 受淀粉小肠消化率影响。当淀粉的小肠消化率低于70%时,在保证瘤胃健康的前提下,提高RDS 可提高淀粉能量利用效率。小肠淀粉的利用存在限制性,消化率很低;通过综合营养调控措施提高RES 的小肠消化率,亦可提高反刍动物日粮淀粉SEF。
提高淀粉能量利用效率,可节约饲料原料,有利于促进畜牧业的可持续发展。如果按中高产奶牛每天玉米摄入量5 kg、玉米SEF76%计算,通过瘤胃和小肠的营养调控,使SEF提高2%,每头泌乳牛可节省玉米0.128 kg/d。如果将低产及其他阶段牛折算为高产牛,全国高产泌乳牛按300 万头计算,每年可节约玉米约14万吨(约2.38亿元,或节约耕地约20万亩)。
5 小结
越来越多的研究表明,RDS是决定反刍动物消化道健康与养分利用的关键日粮因子,是比淀粉更为有效的营养指标。目前,反刍动物饲粮配方仍应用淀粉水平这一表观指标,不能充分体现淀粉降解位点的差异。研究牛羊RDS 适宜需要量是保证消化道健康和高效生产的迫切技术需求。

