金属有机骨架低温吸附储氢罐充气过程的数值模拟研究
程友良,周 彬,李帅领
(华北电力大学(保定)能源工程系, 保定071003)
1 引言
氢能源具有众多优异的特性,被誉为人类终极清洁能源[1-2]。 氢燃料电池能源动力系统具备噪音低、启动快捷等优点,通过温控设计的燃料电池电源系统,可以在炎热及寒冷状态下稳定工作源[3],但是氢介质的储存和运输问题是制约燃料电池能源动力系统在航天、军事等方面应用的技术瓶颈[4-5]。
由于多孔吸附材料具有较高的储氢密度以及较快的吸放氢动力学特性而被认为是较有前景的储氢技术[6]。 其中,金属有机骨架(Metal Organic Framework,MOFs)具有微孔尺寸和形状可调、比表面积高、纯度高及结晶度高等优点,具备更好的应用前景[7-9]。
Furukawa 等[10]测得BET 单位面积为4600 m2/g,单位孔体积为41.5 cm3/g 的MOF-177 在7.0 MPa和77 K 时饱和吸附约为7.5 wt%。 Schlichtenmayer等[11]在2 MPa 的范围内,对AX-21 和MOF-177 在77~125 K 以及室温下的吸附特性进行了研究,结果表明,在77 K 下AX-21 的储氢量为5.6 wt%,MOF-177 的储氢量为7.4 wt%。 Tyler[12]关注吸附储氢材料在汽车方面的应用,调查了微孔材料在298 K、压力范围为50 MPa 下的存储容量,包括活性炭、沸石模板、超高交联聚合物和金属有机框架MOF-177 等,结果表明这些材料的峰值过量吸附仅为0.8 wt%~1.8 wt%。 Wang 等[13]调查了几种典型的纳米多孔材料(共价有机骨架(COF-105,COF-108,MOF-5 和MOF-177)在298 K 下对H2等气体的吸附性能,MOF-177 在吸附性能方面明显要优于MOF-5。 Balderas-Xicohténcatl 等[14-15]在77 K,2 ~2.5 MPa 下研究了各种MOF 的绝对体积吸氢量,结果表明,材料的体积吸附量可以通过改善其体积表面积来增加。
吸附储氢罐在实际应用中需要频繁地充放气,充气过程伴随着氢吸附放出的吸附热以及氢压缩带来的压缩功,罐内温度升高会降低吸附效果,所以需要对整个充气过程进行探讨[11]。 Xiao等[16-18]采用Fluent 和Matlab/Simulink 2 种模型模拟了一种适用于氢动力汽车的吸附储氢罐的充装过程,罐内装有Cu-BTC 和活性炭2 种材料,模拟结果与实验进行了对比,吻合较好。 模拟分析了较好的外部传热条件和较高的床层导热率能使得温度水平较低,增强了吸附能力。 此外还研究了不同的质量流速对罐内温度水平的影响。 Ubaid等[19]为了克服充气过程中等量吸附热对吸附性能的不利影响,提出了一种流通冷却方式:在充装完成后继续充装,冲入冷氢气(77 K),排出热氢气,以此来快速降低罐体温度水平。 Ortmann等[20]探究了不同尺寸下的MOF-5 整料的快充过程,以确定快速充氢的“最佳”颗粒尺寸,结果表明,棒状几何形状(h/d)和平面曲棍球几何形状(h/d≪1)都能实现快速充气。 Tong 等[21]分别讨论了充气流量、预冷和流通冷却对填充过程的影响,结果表明,流通冷却与预冷相结合是一种有效的方式来传递吸附过程中产生的热量,提高系统的储氢能力。 Quellet 等[22]结合遗传算法(FPGA),找到了可以在安全的前提下根据给定的传热系数、目标储氢质量以及吸附材料特性等给出最快的充气方式。
充气过程中的热效应对储氢效果影响很大,需要进一步研究有效的热管理措施。 本文针对MOF-177 低温吸附罐的充气过程进行模拟,改变充气策略、吸附剂热导率以及添加换热片,分析充气过程中的温度、压力等变化。
2 数值模型
2.1 物理模型
几何模型和网格图如图1 所示。 储氢罐入口处内外径分别为4 mm 和5 mm,罐体处内外径分别为46.9 mm 和50.8 mm,罐体内高和外高分别为450 mm 和454 mm。 在COMSOL Multiphysics 中,采用物理场控制网格,这是COMSOL 独有的划分网格的方式,它会根据物理场的设置及耦合方式自动选取合适的网格形状及尺寸,网格质量较好,整个网格有1559 个三角形网格和876 个节点。

图1 几何模型和网格Fig.1 Geometry model and grid
2.2 质量守恒方程
多孔材料吸附储氢过程的质量守恒[19],如式(1)、(2)所示。

式中,εb为多孔介质的孔隙率,ρg为气相氢气的密度(kg/m3),v 为氢气的达西速度,Fm为质量源项,MH2为氢气的摩尔质量(kg/mol),ρp为多孔材料的颗粒密度(kg/m3),na为单位质量多孔介质对氢的绝对吸附量(mol/kg)。
2.3 动量守恒方程
用达西定律表示氢气在多孔材料中的动量守恒,表达式如式(3)所示。

式中,k 为渗透率(m2),μ 为氢气的动力粘度(Pa·s)。
对于低速流体在多孔材料中的流动,可以忽略其惯性阻力,而对于高速流体则不能,采用尔格方恒进行修正[17],如式(4)所示。
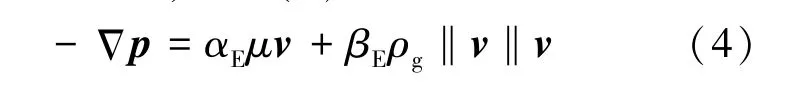
式中,αE为粘性阻力系数,βE为惯性阻力系数。
2.4 能量守恒方程
多孔材料吸附储氢过程中的能量守恒方程如式(5)所示[19]。

式中,(ρCp)eff为氢气和多孔材料的有效热容,表达式如式(6)所示[19]。

式中,ρg、Cpg分别代表气态氢的密度和恒压热容,Cpa代表吸附相氢的恒压热容,Cps代表吸附剂的热容。 在这里我们近似认为气态项氢与吸附相氢的比热近似,即Cpg≈Cpa。
热传导项中的keff为床层有效热导率,采用体积平均的方式计算,如式(7)所示。

热源项Q 由吸附过程中释放的吸附热和气体压缩放热的压缩功组成,可表示为式(8)[19]。

其中,Qa为吸附热源,ΔH 为等量吸附热(J/mol),Qp为压缩功,αp为体膨胀系数。
2.5 吸附等温线
本文采用的是D-A 模型,绝对吸附量如式(9)所示[23]。

式中,nm为氢气的极限吸附量(mol/kg),R为通用气体常数(J/(mol·K)),α 为焓因子(J/mol),β 为熵因子(J/(mol·K)),p0为极限压力(Pa),b 为经验参数。 对于不同的吸附材料,上述参数值都不相同。 本文用到的材料是AX-21和MOF-177,上述相关参数值列于表1。

表1 AX-21、MOF-177[11]吸附H2 的D-A 模型中各参数Table 1 Dubnin-Astackov parameters for H2 isotherms of AX-21 and MOF-177[11]
吸附热是指气体吸附过程中释放出的热量,相对地,气体脱附时会吸收热量。 胡敏[24]对吸附热进行了推导,如式(10)所示。

2.6 材料物性
本文设计的材料及其物性参数如表2 所示。

表2 低温下的材料物性表[11,25]Table 2 Material properties at low temperatures[11,25]
氢气在低温高压下的状态会偏离理想气体状态方程,为了使结果更加精确,本文采用实际气体状态方程。 压缩率表示为温度、压力的函数,数据来源于NIST RefProps 数据库[26],如式(11)所示。

氢气状态方程表示为式(12)。

MOF-177 的比热容为式(13)。

3 结果与讨论
3.1 模型验证
采用Comsol Multiphysics 来模拟二维吸附罐的充放气过程,选择了Xiao 等[27]研究的常温活性炭AX-21 吸附H2储存系统作为模型验证的依据,实验数据是由加拿大三河城魁北克学氢能研究所提供的Test No.13 号实验,初始绝对压力为32 080 Pa,罐内初始温度为281 K,管壁初始温度为281 K,外部采用水(282.5 K)冷却,充放气条件如表3,储罐的尺寸如1.1 中所述。

表3 Test No.13 入口质量通量Table 3 Inlet mass flow rate of test No.13
选取压力变化曲线和监测点C(其坐标为(0,0.220 25))的温度变化曲线作为模型验证的依据,压力的对比图见图2,温度对比图见图3。 可见模拟和实验数据吻合得较好,模型的正确性得到验证。 此吸附模型可以模拟任何气体、吸附剂之间(如H2/AC,CO2/ AC,CO2/ MOF,H2/ MOF)的吸附行为,包括质量、热量变化。 区别仅在于从一种气体/吸附剂到另外一种气体/吸附剂,相应的吸附等温线和热效应上有些改变[25]。 所以,本文将材料更换为MOF-177 对正确性没有影响。

图2 实验与模拟的压力对比Fig.2 Comparison of experimental and simulated pressure

图3 实验与模拟的C 点温度对比Fig.3 Comparison of temperature at point C between experiment and simulation
3.2 充气特性分析
采用吸附材料为MOF-177,所做模拟的边界条件及初始条件如下:储罐内的初始绝对压力为34 600 Pa,初始温度为78.6 K,储罐放在液氮(77 K)中进行冷却,管壁与液氮的换热系数取12 W/m2K,入口质量流速为1.3896e-4 kg/s(前385 s)、0 kg/s(385 s 后)。
3.2.1 充气速率
为了探究充气的质量流速对储存性能的影响,Xiao 等[16]把质量流量设为了2 倍、4 倍进行比较,结果表明较低的质量流速会明显降低充气过程的温度,提高储存性能。 但由于质量流速是个定值,流速低的同时必然导致充气时间的延长。所以,本文在环境温度、系统初始温度、进口氢气温度、充气时间(385 s)和总充气质量等不变的情况下,采用几种不同的充气策略(流速随时间t 变化),比较分析温度变化和压力变化等。 具体充气质量流速的表示如式(14)~(18)所示。
1)恒定流速:

2)流速匀速升高:
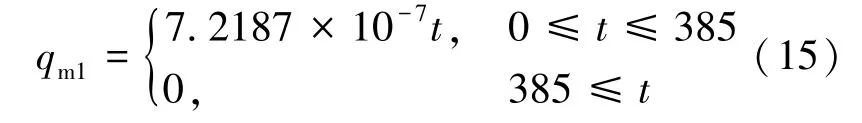
3)流速匀速降低:
4)流速分段(先快后慢):
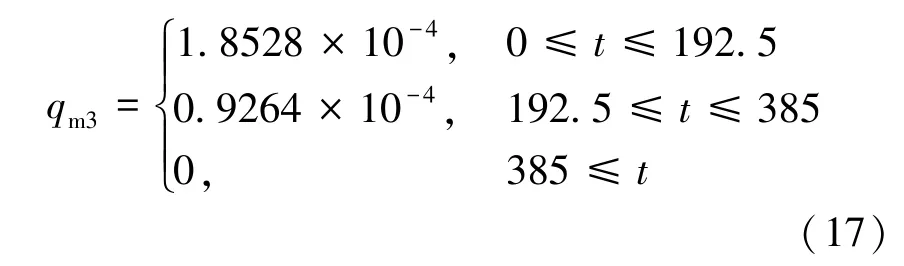
5)流速分段(先慢后快):
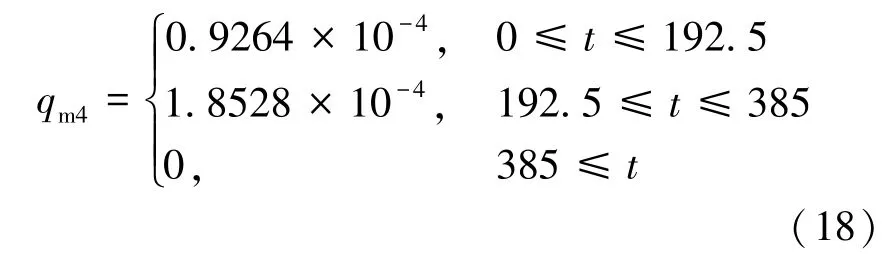
本文以热容平均温度来衡量整个体系温度水平,计算公式如式(19)所示。
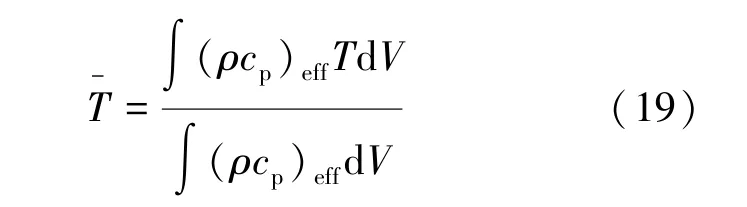
5 种充气策略的热容平均温度如图4 所示。罐内温度上升是因为充气伴随着吸附,既有吸附热又有压缩功,所以温度上升的速率和充气的速率是密不可分的。 充气前期罐内温度水平不高,向外的传热量不大,所以qm1和qm4虽然前期充气速率不高,但仍然具有较快的温升,只是不如qm2和qm3剧烈。 充气后期,罐体与环境已经有了一定的温差,此时qm2和qm3的充气流量较小,产生的内热源小于向环境的传热量,温度开始下降,qm1和qm4则具有较大的充气流量,温度继续上升。 温度最大值从小到大依次是qm0、qm3、qm4、qm2、qm1,即从平均温度的温升来说,匀速充气的温升最低,在同样的变速策略下(qm1与qm2比较、qm3与qm4比较),先快后慢比先慢后快的温升低。
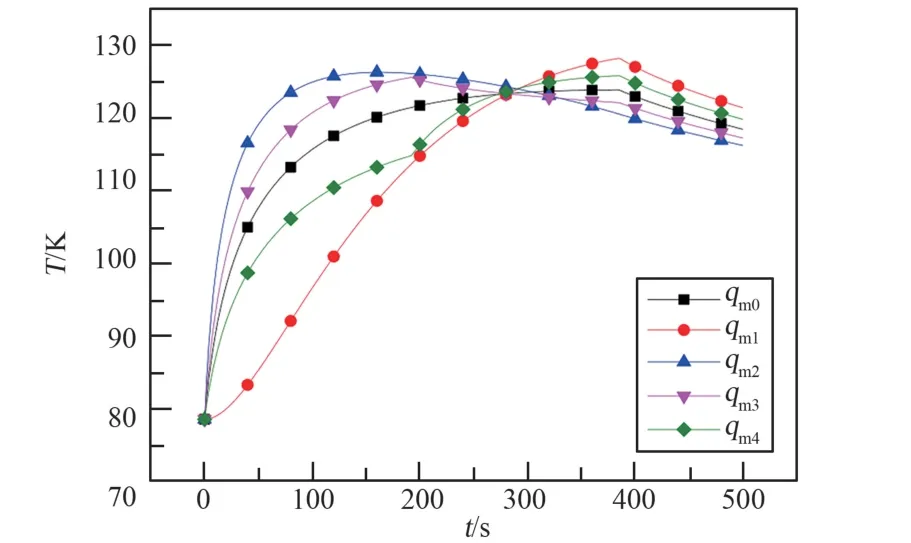
图4 不同充气策略的热容平均温度Fig.4 Average heat capacity temperature for different inflation strategies
图5 为上述5 种充气流速下的罐内压力随时间变化的曲线。 可以看出,先慢后快的充气方式(qm1和qm4)的最高压力最大,达到了6.7 MPa 和6.5 MPa。 这是因为充气集中在后期,内热源较大,且向外换热的时间短,导致温度水平高,影响了吸附效果,更多的氢气以气相的形式存在,使得压力升高。 qm2和qm3正好相反,前期冲入氢气量较大,产生了较大的热量,向外换热的时间长,后期温度水平低,更多的氢气以吸附相的形式存在,最高压力变小,qm2的最高压力最小,为6.1 MPa。值得注意的是,qm2的最大值不是在充气结束时刻取得,而是在大约330 s 时。 之前也分析过,qm2在充气后期的氢气充入量太小,此时虽仍在吸附,但吸附热的产生速率已经小于向环境放热的速率,温度水平开始下降,吸附效果增强,更多的氢气以吸附相的形式存在,使得压力降低。

图5 不同充气速率下的压力变化曲线Fig.5 Pressure curve at different inflation rates
为了探究改变充气速率对实际吸附效果的影响,单纯看绝对吸附量随时间的变化曲线是没有意义的,因为不同充气策略的当前时刻的氢气总量是不同的。 所以本文用绝对吸附量除以当前时刻的氢气总量作为吸附率,以吸附率来反映实际充气过程中的吸附效果,如图6 所示。 绝对吸附量根据D-A 方程计算,当前时刻的氢气量由充气量和初始时刻的气相氢、吸附相氢组成。 qm1在前期充气量太小,压升、温升都不明显,所以吸附率保持不变。 除了qm1,所有曲线的吸附率在一开始很短的一段时间内(0~5 s)都是在上升的,此时随着充气的进行,压力和温度都在升高,压力升高对吸附起的强化作用大于温度升高对吸附起的阻碍作用,使得吸附率上升。 在经过短暂的吸附强化后,温升过高,超过了压力提高带来的增强吸附的收益,所有曲线的吸附率急剧下降,特别是qm2,前期充气量大,温升剧烈使得吸附率下降最快。

图6 吸附率比较图及前30 s 细化图Fig.6 Comparison graph of adsorption rate and detailed graph of the first 30 s
3.2.2 热导率前面所做的模拟都是在MOF-177 的热导率为0.3 W/(m·K)的情况下进行的,较低的热导率会使体系的温度较高并影响氢的吸附。 特别是在罐体中心,热量积存、导热不畅使得温度水平很高。 所以吸附剂的热导率对整个吸附系统的储氢效率有着显著影响,可以通过固化、与金属粉末混合、改性等方式来提高热导率[28]。 本文使用了几个较高的热导率1 W/(m·K)、2 W/(m·K)、3 W/(m·K)和4 W/(m·K)进行模拟,与原始材料对比,对储氢系统的充气过程进行灵敏度分析。
热容平均温度的对比如图7 所示。 通过提高吸附剂的热导率,明显提高了传热效率,使得热容平均温度的最大值从124 K 下降到了113 K。 从图8 充气结束时刻的温度分布云图中也能看出,随着吸附剂热导率的提高,最高温度从184 K 一直下降到了129 K,温度分布越来越均匀,温度水平也越来越低。 此外, 吸附剂的热导率从0.3 W/(m·K)增加到2 W/(m·K)时,最高点温度下降很大,从183 K 下降到了137 K,再继续增大热导率,温度下降得越来越不明显。 热容平均温度具有同样的变化规律,所以随着吸附剂热导率的提高,温降的收益越来越低。
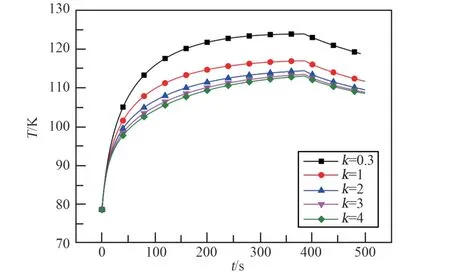
图7 热容平均温度变化趋势Fig.7 The curve of average heat capacity temperature
图9 为5 种吸附剂热导率下的压力变化曲线。 提高吸附剂热导率可以有效降低罐内的温度水平,提高吸附效果,更多氢从气相转化为吸附相,压力随之降低。 所以,随着热导率的提高,压力的升高速度变缓,最大值也变小,从6.3 MPa降到了5.3 MPa。 同样地,热导率提高过大后再继续增加,压降方面的收益也是递减。 总得来说,提高吸附剂的热导率可以明显改善充气过程温升过大、压力过大的问题。
图8 385 s 时刻温度分布云图Fig.8 Temperature distribution cloud map at 385 s

图9 不同k 值下的压力变化Fig.9 Changes of pressure at different k
上述情况是在以同一速率、保证总充气量相同的情况下,对比压力的变化。 还有另一种对比策略:以恒定的流速向罐内充气,当罐内压力达到某一设定值时立即停止充气,对比此时充气量的大小。 在此,考察不同热导率的吸附罐在压力达到5.0 MPa时罐内的充气量。 如图9 中,水平线与压力曲线的第一个交点代表充气压力达到5.0 MPa,此后不再充气。 k =0.3、1、2、3、4 对应的充气结束时刻分别为:322 s、350 s、362 s、366 s、369 s,因为充气速率是恒定的,所以充气时间可以代表总充气量。 通过时间的差值可以看出,提高吸附剂的热导率可以提高规定压力下的充气总量,同样地,总充气量的增益也是随着热导率的增加逐渐变缓。 从压力升高的规律可以看出,当充气压力取5.5 MPa、6.0 MPa 甚至更大时,充气时间的差值会进一步扩大,即充气压力越高,提高吸附剂热导率带来的充气量收益越大。
3.2.3 换热片
从上一节的模拟中可以看到,提高吸附剂的热导率对换热和吸附效果有明显的促进作用。 本节采用另外一种强化传热的方式:在管壁内侧装上一些换热片,增大吸附剂与管壁的接触面积,从而强化传热。 新的几何模型如图10 所示,在内壁上加上了均匀的换热片。 换热片的装入会减小原本的吸附剂体积,进而影响充气完成后冷却到环境温度的平衡压力。 但换热片体积占罐内总体积的份额很小,最终的模拟结果也表明平衡压力相差无几,所以本节仍只对前500 s 进行模拟分析。

图10 带有换热片的几何模型Fig.10 Geometric model with fins
图11 为充气过程中的温度分布云图。 可以看到,随着充气的进行,罐内温度不断升高,高温区不断向底部缩小且靠近换热片的部分明显有温度下降。 对比原模型在385 s 时的温度分布(图8),在添加了换热片之后,入口低温区延伸到了罐体中下部,这种设计使得受入口氢气温度影响的区域变大且罐内高温区的面积减小。 虽然温度的分布相较原模型更加集中,可能会造成高温区的温度更高,但结果表明最高温度仅有167 K,比原模型的184 K 低了很多,说明添加换热片在充气过程中起到了一定强化传热的作用。
图12 为新模型与原模型的压力变化曲线图。罐内加入换热片后,强化了罐内与环境的换热,增强了吸附效果,所以压力升高的趋势比原模型小,充气结束时刻的压力5.6 MPa,也要明显小于原模型的6.3 MPa。 若同样选取充到5 MPa时停止,新模型在充气量上也具有很大优势。

图11 充气过程中的温度分布云图Fig.11 Temperature distribution cloud map during inflation

图12 有无换热片的压力对比Fig.12 Comparison of pressure with or without fins
4 结论
1)从平均温度的温升来说,匀速充气的温升最低,在同样的变速策略下(qm1与qm2比较、qm3与qm4比较),先快后慢比先慢后快的温升低;
2)充气集中在前期能有效降低最高压力,但充气过程中吸附率下降较多;
3)提高吸附剂的热导率能有效降低充气带来的温升和压升,也使得罐内温度分布更加均匀;
4)通过添加换热片的方式能够减小高温区的面积,使得最高温度、平均温度和充气压力都有所下降。
参考文献(References)
[ 1] 邵志刚,衣宝廉.氢能与燃料电池发展现状及展望[J].中国科学院院刊,2019,34(04):469-477.Shao Z G, Yi B L. Developing trend and present status of hydrogen energy and fuel cell development[J].Bulletin of Chinese Academy of Sciences,2019,34(04):469-477. (in Chinese)
[ 2] 肖钢, 陈远明. 发展氢能产业,推进能源生产和消费革命[J]. 国际人才交流, 2019, 345(02):15-16.
Xiao G, Chen Y M. Develop the hydrogen energy industry and promote the revolution in energy production and consumption[J].International Talent,2019,345(02):15-16. (in Chinese)
[ 3] 张娜,陈红,马骁,等.高密度固态储氢材料技术研究进展[J].载人航天,2019,25(01):116-121.
Zhang N,Chen H, Ma X, et al. Research progress of high density solid-state hydrogen storage materials[J]. Manned Spaceflight,2019,25(01):116-121. (in Chinese)
[ 4] Sanyal U, Demirci U B, Jagirdar B R, et al. Hydrolysis of ammonia borane as a hydrogen source: fundamental issues and potential solutions towards implementation[J]. Chem Sus Chem, 2011, 4(12):1731-1739.
[ 5] Wang Z L, Yan J M, Wang H L, et al. Self-protective cobalt nanocatalyst for long-time recycle application on hydrogen generation by its free metal-ion conversion[J]. Journal of Power Sources, 2013, 243(6):431-435.
[ 6] Ahluwalia R K, Peng J K. Automotive hydrogen storage system using cryo-adsorption on activated carbon[J]. International Journal of Hydrogen Energy, 2009, 34(13):5476-5487.
[ 7] Schlichtenmayer M, Hirscher M. The usable capacity of porous materials for hydrogen storage[J]. Applied Physics A,2016, 122(4):379.
[ 8] Langmi H W, Ren J, North B, et al. Hydrogen storage in metal-organic frameworks:a review[J]. Electrochimica Acta,2014, 128:368-392.
[ 9] Broom D P, Webb C J, Hurst K E, et al. Outlook and challenges for hydrogen storage in nanoporous materials[J]. Applied Physics A, 2016, 122(3):151.
[10] Furukawa H, Miller M A, Yaghi O M. Independent verification of the saturation hydrogen uptake in MOF-177 and establishment of a benchmark for hydrogen adsorption in metal-organic frameworks[J]. Journal of Materials Chemistry, 2007,17(30):3197-3204.
[11] Schlichtenmayer M, Streppel B, Hirscher M. Hydrogen physisorption in high SSA microporous materials-A comparison between AX-21_33 and MOF-177 at cryogenic conditions[J].International Journal of Hydrogen Energy,2011,36(1):586-591.
[12] Voskuilen T G,Pourpoint T L, Dailly A, et al. Hydrogen adsorption on microporous materials at ambient temperatures and pressures up to 50 MPa[J]. Adsorption, 2012, 18(3-4):239-249.
[13] Wang L L, Wang L, Zhao J, et al. Adsorption of selected gases on metal-organic frameworks and covalent organic frameworks: A comparative grand canonical Monte Carlo simulation[J]. Journal of Applied Physics, 2012, 111(11):112628.
[14] Balderas-Xicohténcatl R, Schlichtenmayer M, Hirscher M.Volumetric hydrogen storage capacity in metal-organic frameworks[J]. Energy Technology, 2017,5:1-6.
[15] Balderas-Xicohténcatl R, Schmieder P, Denysenko D, et al.High volumetric hydrogen storage capacity using interpenetrated metal-organic frameworks[J]. Energy Technol, 2018,6(3):510-512.
[16] Xiao J S,Li Q,Cossement D,et al. Lumped parameter simulation for charge-discharge cycle of cryo-adsorptive hydrogen storage system[J]. International Journal of Hydrogen Energy,2012, 37(18):13400-13408.
[17] Xiao J S, Yang H, Bénard P, et al. Numerical study of thermal effects in cryo-adsorptive hydrogen storage tank[J]. Journal of Renewable and Sustainable Energy, 2013, 5(2):021414.
[18] Xiao J S, Bénard P, Chahine R. Adsorption-desorption cycle thermodynamics for adsorptive hydrogen storage system[J].International Journal of Hydrogen Energy, 2016, 41(14):6139-6147.
[19] Ubaid S, Zacharia R, Xiao J S, et al. Effect of flowthrough cooling heat removal on the performances of MOF-5 cryo-adsorptive hydrogen reservoir for bulk storage applications[J].International Journal of Hydrogen Energy, 2015, 40(30):9314-9325.
[20] Ortmann J P,Kaisare N S. Modeling of cryo-adsorption of hydrogen on MOF-5 pellets: Effect of pellet properties on moderate pressure refueling[J]. International Journal of Hydrogen Energy, 2016, 41(1):342-354.
[21] Tong L, Xiao J S, Cai Y H, et al. Thermal effect and flowthrough cooling of an adsorptive hydrogen delivery tank[J].International Journal of Hydrogen Energy, 2016, 41(36):16094-16100.
[22] Ouellet M, Goyette J, Xiao J S, et al. A new approach to optimize the performance of a hydrogen reservoir using activated carbon as the storing material[J]. International Journal of Hydrogen Energy, 2017, 42(38):24229-24236.
[23] Dundar E, Zacharia R, Chahine R, et al. Performance comparison of adsorption isotherm models for supercritical hydrogen sorption on MOFs[J]. Fluid Phase Equilibria, 2014,363:74-85.
[24] 胡敏. 多孔材料储氢的有限元模拟与优化[D]. 武汉:武汉理工大学, 2012.
Hu M. Finite Element Simulation and Optimization of Hydrogen Storage in Porous Materials[D].Wuhan: Wuhan University of Technology, 2012.(in Chinese)
[25] Qasem N A A, Ben-Mansour R, Habib M A. An efficient CO2adsorptive storage using MOF-5 and MOF-177[J]. Applied Energy, 2017, 210:317-326.
[26] Leachman J W,Jacobsen R T,Penoncello S G,et al. Fundamental equations of state for parahydrogen, normal hydrogen,and orthohydrogen[J]. Journal of Physical and Chemical Reference Data, 2009, 38(3):721-748.
[27] Xiao J S,Wang J J, Cossement D,et al. Finite element model for charge and discharge cycle of activated carbon hydrogen storage[J]. International Journal of Hydrogen Energy, 2012,37(1):802-810.
[28] 曹文学. 车载吸附储氢系统的设计与研究[D]. 上海:上海交通大学, 2010.
Cao W X. The Design and Characteristics Research of Hydrogen Adsorption Storage Applied to Hydrogen Vehicle[D].Shanghai: Shanghai JiaoTong University,2010.(in Chinese)

