RecQ5表达与骨肉瘤组织恶性程度间的关系分析
支力强,同志超,姚舒馨,卿忠,李萌,马建兵
(1.西安市红会医院关节外科,陕西 西安 710054;2.西安市红会医院骨病肿瘤科,陕西 西安 710054;3.西安交通大学第一附属医院骨科,陕西 西安 710061)
骨肉瘤是一种多发于儿童和青少年的原发性恶性骨肿瘤,其特点为恶性程度高、肺转移率高和易复发。手术切除和辅助化疗等治疗方法虽使骨肉瘤患者的生存期有所延长,生活质量有所提高,但其预后仍无明显改善。最近研究显示,DNA损伤会导致基因的不稳定性而诱发细胞发生恶性转化甚至死亡[1-3]。RecQ解旋酶家族被证实参与DNA复制、修复(包括错配修复、碱基切除修复和直接修复)、损伤检测和端粒维护等众多生物学过程,在维持基因稳定性上发挥着重要作用[4-5]。人类RecQ解旋酶家族成员包括:RecQ1、BLM、WRN、RecQ4和RecQ5。目前多数研究仅仅局限于BLM、WRN和RecQ4这3个基因上,但对于RecQ5基因与肿瘤尤其是骨肉瘤的关系则研究较少,本文拟通过测量RecQ5在骨肉瘤组织不同恶性程度及不同细胞株间的表达,探讨RecQ5表达与骨肉瘤组织恶性程度间的关系。
1 资料与方法
1.1 一般资料 本实验所选病例系西安市红会医院和西安交通大学第一附属医院2015年1月至2017年12月中手术切除的35例骨肉瘤标本和存档中石蜡包埋骨肉瘤标本、骨肉瘤癌旁组织标本20例及正常骨组织标本20例,其中骨肉瘤标本中男20例,女15例;年龄9~56岁,平均(20.3±4.2)岁。纳入标准:经临床、影像学及病理学三者相结合确诊骨肉瘤者,术前均未行放疗。排除标准:排除Paget's病、骨纤维结构不良等影响骨结构病变,并排除其他肿瘤转移病史。正常骨组织取自于全髋关节置换术和股骨头置换术患者的骨组织。
1.2 实验方法 由两名病理科医生独立对染色结果进行判断评分。以2011年第7版中美国癌症联合会(American joint committee on cancer,AJCC)对于骨肉瘤分期系统法为标准对骨肉瘤进行分期评判。
通过SP免疫组化法检测不同组织中RecQ5的表达情况。RecQ5在不同组织中的表达判定标准:以胞核和/或胞浆中出现RecQ5蛋白棕黄色染色为阳性。阳性细胞的百分比为200倍镜下5个视野内的阳性细胞平均数,0分:<10%;1分:11%~25%;2分:26%~50%;3分:>51%;表达强度以着色程度为标准进行计分:未着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。最后将每张切片着色程度得分与着色细胞百分率得分相加为其最后得分:0~1分评定为阴性(-);2~4分弱阳性(+);4~5分中阳性(++);大于6分为强阳性(+++);以PBS代替一抗作为阴性对照。培养人骨肉瘤细胞株hFOB1.19、U2OS和人成骨细胞株MG-63,通过Real-time PCR和Western blot法检测不同细胞株间RecQ5的表达程度。

2 结 果
2.1 RecQ5在不同组织中的表达 本研究采用第7版AJCC分期中关于骨与软组织肉瘤分期系统作为骨肉瘤标本的分期标准,分别选取了骨肉瘤StageⅠ、Ⅱ、Ⅲ期中的部分标本,因Stage Ⅳ期与肿瘤大小无关,故未选取StageⅣ的标本。镜下观察RecQ5的阳性染色主要为细胞核和/或胞质出现的棕黄色颗粒(见图1)。

a 正常骨组织 b 骨肉瘤癌旁组织 c 骨肉瘤组织

d 正常骨组织虚线所框区域的局部放大图 e 骨肉瘤癌旁组织虚线所框区域的局部放大图 f 骨肉瘤组织虚线所框区域的局部放大图
注:RecQ5阳性染色表现为细胞核或细胞质内出现棕黄色的颗粒
图1 不同组织中RecQ5的表达情况(SP免疫组化法,×200)
通过初步分析RecQ5表达的阳性率发现,在正常骨组织中,RecQ5的表达阳性率为100%(20/20),在癌旁组织中的表达阳性率为90%(18/20),而在骨肉瘤组织中,RecQ5表达阳性率为68.5%(24/35)。其中,正常骨组织、癌旁组织与骨肉瘤组织RecQ5表达阳性率之间差异有统计学意义(P=0.008),但正常骨组织与癌旁组织之间的阳性率差异无统计学意义(P>0.05,见表1)。为了进一步分析其表达强度与组织恶性程度之间的关系,我们选取正常骨组织、癌旁组织及不同分期的骨肉瘤组织进行染色发现,RecQ5的表达强度随着组织恶性程度的不断增加而逐渐减弱,差异有统计学意义(P<0.05)。且在骨肉瘤组织中,随着肿瘤分期增加其表达强度也逐渐减弱,差异有统计学意义(P<0.05),即RecQ5表达的强弱与组织的恶性程度呈负相关(见表2,见图2)。

表1 RecQ5表达的阳性率与不同组织间的关系

表2 RecQ5表达强度与肿瘤分期之间的关系

a stage I b stage Ⅱ c stage Ⅲ
图2 不同骨肉瘤AJCC分期中RecQ5的表达情况(SP免疫组化法,×200)
2.2 RecQ5在不同细胞株中的表达 我们检测了RecQ5在人骨肉瘤细胞株MG-63、U2OS和人成骨细胞株hFOB1.19中的表达情况。Real-time PCR及Western blot结果显示,RecQ5在3株细胞中均可稳定表达,但在MG-63和U2OS细胞mRNA及蛋白水平上的表达情况均较hFOB1.19细胞低(P<0.05,见图3),且在MG-63细胞上的表达略低于U2OS细胞。
3 讨 论
RecQ5作为RecQ解旋酶家族的一员,在DNA复制、重组和修复过程中都有着重要作用[6]。与其他RecQ解旋酶只在部分特定组织中表达有所不同的是,RecQ5在人体组织中都存在一定的表达,而目前研究主要集中于WRN、BLM基因上,对RecQ5表达程度与肿瘤之间关系的研究尚少,而在骨肉瘤中的表达情况更少[7]。Lao等[8]研究RecQ家族基因在大肠癌上的表达情况时发现,BLM和RecQ4在大肠癌组织的mRNA水平上的表达程度高于正常组织,而RecQ1、WRN和RecQ5的表达则低于正常组织。且在免疫组化实验中也出现了类似mRNA水平的变化趋势,但未发现这些基因的表达程度与肿瘤分期之间存在相关性。在随后的细胞实验中发现,BLM和RecQ1在mRNA和蛋白水平的表达显著低于正常细胞,RecQ4的表达明显高于正常细胞,其余成员在mRNA水平与正常细胞相比未见明显差异。WRN和RecQ5在蛋白水平的表达程度与mRNA并不一致,其表达强度明显低于正常组织,推断这可能是由于正常组织中RecQ5的启动子并未甲基化,而肿瘤组织中则存在大量异常的RecQ5启动子甲基化所导致的。综合这些蛋白已知的功能可以明确,RecQ5在大肠癌的发生过程中起着抑制的作用,但其具体机制仍未明确。而Arora等[9]在乳腺癌最常见的3种细胞株MM-436、MCF-7及MM-231上发现RecQ5在mRNA水平的表达程度高于在正常乳腺上皮细胞MCF10A。在随后研究中还发现,RecQ5 mRNA的高表达与乳腺癌的病理特征存在密切联系,包括较差的肿瘤分化程度、表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)高表达和三阴性表型的乳腺癌,且其较高的mRNA水平还可明显影响患者的生存时间。因此,其认为RecQ5的mRNA水平不仅可以作为评价乳腺癌细胞增殖能力的指标,而且可以作为判断乳腺癌患者预后的一个独立的影响因素。但其在蛋白水平的检测中出现了与mRNA水平相反的结果,较低的RecQ5蛋白表达水平对应的是肿瘤较差的分化程度等,且并没有显著影响患者的生存时间。故其分析RecQ5可能还受控于一种复杂的转录后调节,具体机制尚不清楚,又或者是因为其表达水平存在一种“阈效应”,而这个阈值暂时无法用mRNA的表达水平来准确测量。
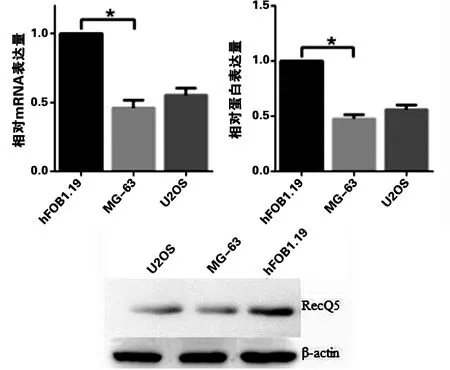
图3 Real-time PCR及Western blot检测RecQ5在不同细胞中的表达情况
在本组的前期研究中,我们发现RecQ5在骨肉瘤与正常骨组织上的表达也存在明显差异,其在骨肉瘤上的表达程度明显低于正常组织。其后又根据Enneking分期法对其表达程度与肿瘤恶性程度进行进一步分析后发现,不同分期的肿瘤组织中RecQ5表达程度也存在着差异,其表达程度与Enneking分期呈负相关[10]。本实验在前期研究的基础上,首次采用新的AJCC分期系统对骨肉瘤进行分级和分期。与以往的Enneking分期系统相比,可更准确地判断出肿瘤的病理学分级和肿瘤分期,从而更早地确定下一步的治疗方案。本实验通过检测RecQ5在骨肉瘤组织、癌旁组织及正常骨组织这3种不同恶性程度样本的表达后发现,RecQ5的表达阳性率在不同恶性程度的组织中存在差异,在正常组织和癌旁组织中RecQ5的表达阳性率都与骨肉瘤组织之间存在显著差异,但在正常组织与癌旁组织之间则未见明显差异,出现这种现象考虑可能是由于本实验的癌旁组织绝大多数取材自距肿瘤边缘3cm以上的部位,而这些“癌旁组织”在行肿瘤切除术时即可认为是手术切除的安全区域[11-14],可基本等同于正常组织,故与正常组织未见明显差异,但也不能排除因癌旁组织样本量较小导致的差异无统计学意义,可在以后的实验中加大样本量再次验证以上结果。随后我们在分析其表达强度与骨肉瘤分期之间的关系时发现,随着肿瘤分期的增加,RecQ5的表达程度逐渐减弱,出现了RecQ5的表达强度随着肿瘤恶性程度增加而逐渐减弱的趋势,即RecQ5的表达程度与骨肉瘤分期呈负相关。这与我们前期研究的结果一致,也与Yiduo等[15-16]的研究结果相似。在随后的细胞实验中,我们利用可以定量分析的Real-time PCR检测RecQ5在不同骨肉瘤细胞株及正常成骨细胞中的表达量,结果显示RecQ5在U2OS和MG-63细胞株mRNA和蛋白水平上的表达程度明显低于hFOB1.19细胞,与免疫组化的趋势相符,也与我们前期实验结果一致。参考以往研究结果可推测RecQ5能够维持细胞基因组的稳定性,其缺失会使细胞在复制过程中的错误不能及时纠正,故使复制错误得以不断累积,继而导致正常细胞功能的改变,使基因组损伤的细胞发生恶性转化。但是,到底是RecQ5的缺失导致骨肉瘤的发生还是骨肉瘤发生后导致RecQ5表达的下降或缺失我们不得而知,为了进一步证实两者间的关系,我们在以后的实验中将继续进行研究。

