雷帕霉素改善血管性痴呆小鼠认知功能的机制*
陈丽,杨帆,赵志红,秦洁
(天津市环湖医院 神经内科,天津 300060)
研究发现,慢性缺血缺氧、低灌注是血管性痴呆(vascular dementia,VaD)的最主要的原因。长期的慢性低灌注改变了脑内的微环境,导致小胶质细胞的激活,一项全基因组关联研究(GWAS)进一步确定了小胶质细胞状态与痴呆的新关联[1-3],提出小胶质细胞导致脑内微环境功能失调可能是痴呆病理生理学基础。在慢性缺血老化的脑组织中,小胶质细胞可表现出多种表型,在维持脑内环境稳态中发挥着双重作用[4-5]。小胶质细胞可以极化成M1前炎症状态,释放前炎症因子如白细胞介素6 (interleukin 6,IL-6) 及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);亦可呈M2抗炎状态,通过IL-4、精氨酸1(arginine-1,Arg-1)、IL-10和转化生长因子β(transforming growth factor-β,TGF-β)缓解炎症和组织修复。雷帕霉素(rapamycin)为免疫抑制剂,可通过抑制mTOR通路达到控制免疫反应的作用,研究表明mTOR可以改变免疫细胞的活化及分化[6-8]。本研究采用双侧颈总动脉缩窄(bilateral common carotid artery stenosis,BCAS)法制作VaD 模型,采用雷帕霉素治疗,探讨雷帕霉素是否可以通过调节长期慢性低灌注脑组织中M1/M2的平衡、重建脑内微环境的稳态,改善认知功能,报告如下。
1 材料与方法
1.1材料
1.1.1实验动物 20只成年健康雄性C57BL/6J小鼠,12周龄,体质量30~35 g,由中国人民解放军军事医学科学院实验动物中心提供。该研究方案提交医学伦理部门审核,符合相关伦理学要求。
1.1.2主要试剂和耗材 CD16/32一抗购自美国Abcam公司,Iba1 一抗购自美国Abcam公司,CD206 一抗购自Millipore公司,荧光标记抗兔二抗购自美国Abcam公司,抗羊二抗购自Invitrogen公司,DAB显色剂购自北京中衫金桥生物技术有限公司,枸橼酸盐缓冲液购自北京中衫金桥生物技术有限公司,4%多聚甲醛购自武汉博士德生物技术有限公司,牛血清白蛋白购自美国Sigma公司,10%水合氯醛购自天津医药集团上海化学试剂公司。
1.2方法
1.2.1实验模型制备 20只小鼠采用BCAS制作VaD模型,用10%水合氯醛(3 mL/kg)腹腔注射将小鼠麻醉,仰卧位,将其固定在解剖手术台上,备皮、消毒;行颈部前正中切口,钝性分离组织,保护迷走神经,暴露两侧颈总动脉,采用内径为0.18 mm微线圈进行BCAS[9],确认无渗血,缝合切口,并消毒;术后注意保温,待动物苏醒后单笼饲养,流质饮食,密切观察。
1.2.2VaD模型的入选标准 考虑到手术本身对小鼠的影响,本研究在预实验中选用成年健康雄性C57BL/6J小鼠两测颈总动脉进行仅穿线不结扎处理作为假手术组,对假手术组和VaD组存活的小鼠进行水迷宫测试,参考文献[10]观察造模情况。结果显示,假手术组小鼠平台逃避潜伏期在第3天~第5天较VaD组明显缩短(P<0.05),提示VaD模型小鼠有认知功能障碍,模型制备成功。
1.2.3给药方法 本研究于建立模型后2周将VaD小鼠随机分成VaD组及治疗组,每组10只,参考文献[11]治疗组给予2.24 mg/kg的雷帕霉素灌胃,VaD组分别给予与治疗组相同体积的PBS灌胃,治疗4周。
1.2.4Morris水迷宫行为学实验 于灌胃4周时,利用Morris水迷宫检测VaD组及治疗组小鼠空间记忆能力。(1)定位航行试验:将小鼠于第1象限入点处面向池壁放入水中,记录小鼠在120 s内寻找并爬上平台的时间,即逃避潜伏期,之后分别从其他3个象限入水点将鼠放入水中,连续训练5 d。(2)空间探索试验:于第6天撤去平台,在第1象限入点处将小鼠放入水中,记录小鼠在60 s内的运动轨迹,计算其在原平台象限游泳时间占总游泳时间的百分比及通过目标象限的次数。
1.2.5组织学观察 Morris水迷宫结束后,麻醉处死小鼠,获得海马组织标本,常规固定、洗涤、脱水、透明、浸蜡、包埋,冠状切片,再脱蜡、水化;苏木素染色5 min,自来水冲洗2 min,盐酸乙醇酸化30 s(提插数下),自来水浸泡15 min或温水(约50 ℃)5 min,置伊红液染色2 min,常规脱水,透明,封片,观察其组织学改变。
1.2.6脑组织切片Tunnel染色 脱蜡、水化,用0.01 mol/L枸橼酸钠缓冲溶液(pH 6.0)至95 ℃加热20 min进行抗原修复,置于冰丙酮溶液中固定破膜7 min,用PBS洗5 min×3次,滴加Tunnel反应混合物50 μL,在湿盒中4 ℃孵育60 min,洗脱,使用DAB显色套装进行显色,观察Tunnel阳性细胞数量。
1.2.7小胶质细胞表型标志性产物基因表达水平 采用逆转录实时定量荧光PCR(RT-qPCR)检测小胶质细胞M1表型标志性产物基因(CD16、iNOS及TNF-α)及M2表型标志性产物基因(IL-10、TGF-β及Arg1)的表达,引物由上海生工生物技术有限公司合成(引物序列见表1),根据操作说明方法用Trizol提取海马组织总RNA,然后用定量逆转录试剂盒(Qiagen,Hilden,Germany)合成cDNA ,用Syber Green 荧光定量 PCR 检测,反应总体系20 μL,PCR 热循环参数为96 ℃ 4 min,94 ℃、30 s,58 ℃、30 s,72 ℃、30 s,行40个循环。以β-actin为内参照基因,得到目的基因表达的相对定量值(RQ值),将RQ值统计分析。

表1 RT-PCR目的基因的引物序列Tab.1 Primer sequences
1.2.8海马mTORC1通路相关蛋白P-Akt和P-p70s6k表达 采用Western blot法检测,称取海马标本200 mg,按1 mg ∶10 μg的比例加入样本和蛋白裂解液,用匀浆30 s、共3次,冰上静置裂解30 min,4 ℃ 12 000 r/min离心20 min,留取上清进行蛋白定量;其余上样、电泳、转膜,用膜封闭液P-p70S6k (1 ∶1 000)、p-Akt (1 ∶1 000及β-actin (1 ∶5 000)一抗,4℃轻摇过夜。用TBST按照1 ∶5 000稀释相应的二抗,以β-actin作为内参照检测P-Akt和P-p70 S6k表达。
1.3统计学分析
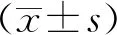
2 结果
2.1行为学实验
结果显示,治疗组小鼠第3~5天的逃避潜伏期时间较VaD组显著缩短,差异有统计学意义(P<0.05),提示雷帕霉素可改善长期慢性脑缺血引起的认知障碍,具有神经保护作用。第6天空间探索实验结果显示,治疗组小鼠穿过目标象限时间及通过目标象限次数显著高于VaD组,差异有统计学意义(P<0.05),提示雷帕霉素对VaD的认知功能具有改善作用。见图1。
2.2海马区HE及Tunnel染色
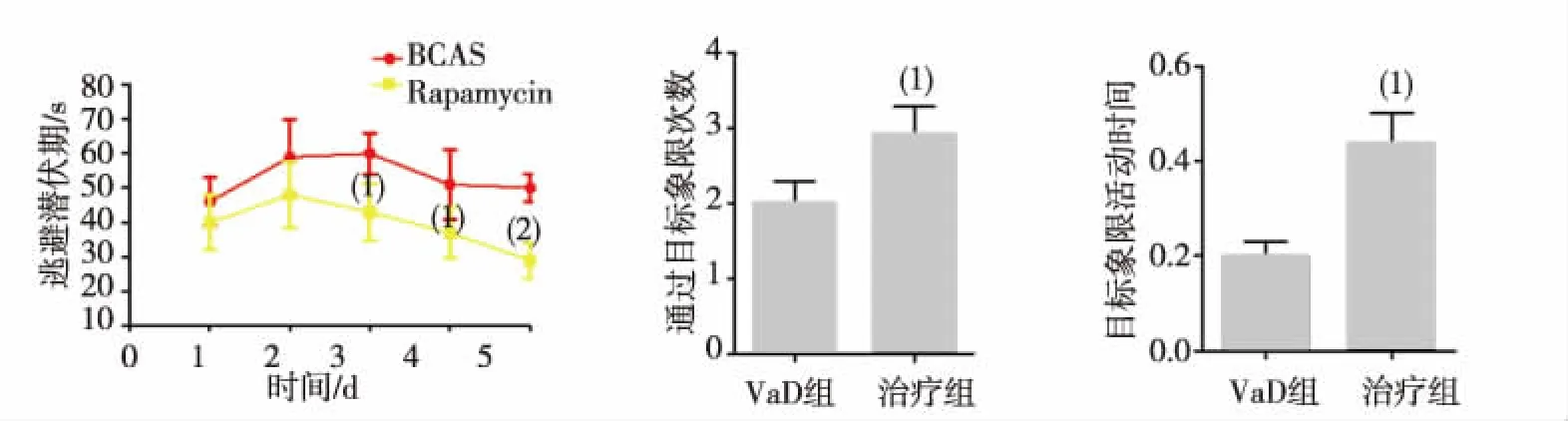
HE染色结果显示,VaD组可见海马区细胞层数及数量减少、细胞排列紊乱、神经细胞呈缺血样改变,可见神经细胞坏死、神经元外形不易辨认,可见核固缩、深染,胞浆内容物减少,结构疏松,伴有细胞坏死及炎性细胞的浸润;治疗组细胞层数及数量基本正常,细胞排列相对清晰,仅少量神经细胞可见核固缩、深染,无明显的空泡样改变;提示雷帕霉素能够改善长期慢性脑缺血引起的脑组织病理变化,对VaD有保护作用(图2A)。Tunnel结果显示,治疗组Tunnel阳性细胞数量较VaD组显著下降,差异有统计学意义(P<0.05,图2B-C),提示雷帕霉素能够明显减少海马区神经细胞的凋亡,可能是改善VaD小鼠的认知障碍的机制。
注:(1)与VaD组比较,P<0.05。图1 2组小鼠水迷宫实验结果Fig.1 The effect of rapamycin on behaviors of mice in two groups
注:A为HE染色,B为Tunnel染色,C为Tunnel染色阳性细胞数;(1)与VaD组比较,P<0.01。图2 2组小鼠海马CA1区HE染色及Tunnel染色结果(200×)Fig.2 The effect of rapamycin on cellular structure and apoptosis in CA1 area of mice in two groups(200×)
2.3小胶质细胞表型标志性产物基因表达
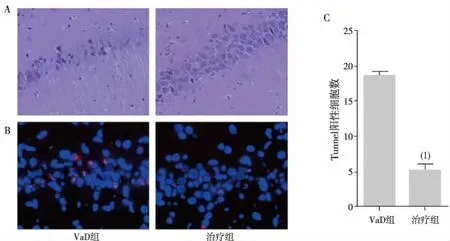
RT-qPCR结果显示,与VaD组比较,治疗组小鼠海马组织M1表型标志性产物基因(CD16、iNOS及TNF-α)表达显著降低,M2表型标志性产物基因(IL-10、TGF-β及Arg1)表达显著升高,差异有统计学意义(P<0.05);提示雷帕霉素抑制了海马组织的前炎症反应,促使海马区炎症因子内环境由M1向M2转变。见图3。
2.4mTORC1通路相关蛋白表达
Western blot结果显示,与VaD组比较,治疗组小鼠海马区P-Akt蛋白的表达水平显著升高、P-p70s6k蛋白表达水平显著减少,差异有统计学意义(P<0.05);提示雷帕霉素抑制P-p70s6k的表达,同时反馈性地降低了对P-Akt的抑制。见图4。
3 讨论
本研究从行为学、形态学和分子生物学3个不同角度,验证了雷帕霉素通过减轻微环境中的炎症反应和调节小胶质细胞M1/M2的平衡对脑缺血损伤长期慢性低灌注导致VaD起保护作用。为了研究认知功能,本研究采用水迷宫试验对VaD组及治疗组进行比较,发现雷帕霉素能明显改善VaD小鼠的认知功能。研究报道,BCAS能导致小鼠颅内三分之一的血流量减少[12],尤其是海马CA1区[13],于是本研究通过HE染色观察发现雷帕霉素能够改善长期慢性脑缺血引起的脑组织的病理变化,进一步通过Tunnel染色发现雷帕霉素能够明显减少海马区神经细胞的凋亡,从而改善VaD小鼠的认知障碍。VaD疾病的病理过程极为复杂,其发病机制涉及多个环节,其中小胶质细胞的活化在认知障碍的发病机制中起着越来越重要的作用[5,14]。小胶质细胞M1代表促炎状态,诱导组织内神经元损伤扩大;相反,M2 具有较强的吞噬和清除坏死或凋亡神经元碎片的能力,以避免继发性炎症反应,促进组织再生[15-16]。于是实验采用CD16、iNOS及TNF-α作为M1标记,用IL-10、TGF-β及Arg1作为M2标记进行研究,结果发现治疗组M1炎症标记物产物基因相对表达量较VaD组显著下调,M2炎症标记物产物基因相对表达量显著上调,提示雷帕霉素抑制了海马组织的前炎症反应,促使海马区炎症因子内环境由M1向M2转变。小胶质细胞在脑缺血应激的极化分型对减轻VaD的炎症反应及促进神经细胞的修复起着重要的作用,适当调控小胶质细胞M1/M2的平衡对脑缺血损伤的预后具有保护作用。大量研究表明mTOR通路在细胞生长、分化、转移和存活中起着核心地位,对生长因子、营养物质及机体能量状态等产生应答,从而调节细胞生长、增殖、自噬、代谢及调控细胞周期等[17],此外,mTOR还具有调节免疫细胞分化、活性和功能的作用[18-19],抑制mTOR通路可以调控小胶质细胞M1/M2的极化状态,从而维持内环境的稳态[7]。雷帕霉素作为mTOR的抑制剂,可以延长寿命,减缓许多与衰老相关的疾病,比如阿尔茨海默病、帕金森病及运动神经元病等[20-22]。本研究证实了雷帕霉素对VaD的发病及进展也具有一定的延缓作用。值得注意的是,有研究表明通过抑制mTORC1可以降低Akt,从而选择性抑制IRE1α/JNK/NF-κB途径,有效降低炎症反应[23-25],本研究进一步印证了mTORC1-Akt这一反馈环路,雷帕霉素通过抑制mTOR信号通路从而降低下游产物P-p70S6K的表达,P-p70S6K的减少又反馈性促进p-Akt的激活,从而抑制的炎症,使M1向M2转化。
注:与VaD组比较,(1)P<0.05,(2) P<0.01。图3 2组小鼠海马区M1/M2表型标志性基因表达Fig.3 The effect of rapamycin on the mRNA expression levels of M1 and M2 markers of mice in two groups
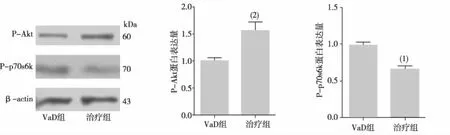
注:与VAD组比较,(1)P<0.05,(2) P<0.01。图4 2组小鼠海马区mTORC1通路蛋白表达Fig.4 The effect of rapamycin on P-Akt and P-p70S6k expression of mice in two groups
综上所述,本研究发现,长期慢性缺血缺氧状态下所致的VaD小鼠海马区小胶质细胞激活,打破了M1/M2平衡,导致大量神经元坏死,从而降低了小鼠的学习和记忆能力,雷帕霉素通过抑制mTORC1通路调节M1/M2稳态,从而有效减轻慢性脑灌注不足引起的认知功能障碍,这为VaD的治疗提供了一定的实验依据。
——雷帕霉素

