大鼠骨髓源内皮祖细胞的分离与鉴定*
Nganguem Nzalle Yranney Brice,林慕之,毛善永,张蓓,周海燕,胡柏龙,王艺明,况春燕,刘兴德,6***
(1.贵州医科大学附院 心血管内科,贵州 贵阳 550004;2.贵州省人民医院 心血管内科,贵州 贵阳 550002;3.贵州医科大学附院 超声科,贵州 贵阳 550004;4.贵州医科大学附院 麻醉科,贵州 贵阳 550004;5.贵州医科大学附院 心理科,贵州 贵阳 550004;6.贵州中医药大学第二附属医院 心血管内科,贵州 贵阳 550025)
内皮祖细胞(endothelial progenitor cells,EPC)是内皮细胞的前体细胞,虽然其在外周血液循环中所占比例较小,但能促进缺血性组织的血管修复和新生[1]。前期研究表明,骨髓源内皮祖细胞(EPCs)在缺血性疾病的治疗中起到关键作用,例如在急性心肌梗死[2-3]、不稳定心绞痛[4-5]、中风[6]、糖尿病微血管病[7]、肺动脉高压[8]及动脉粥样硬化[3,9]等疾病中。因此,研究EPC的生长、迁移及其他生物学特性,可为缺血性疾病的治疗提供实验基础。文献从骨髓[10-11]、心脏血[12]、或胎鼠肺[13-14]中均可提取EPCs,本课题组建立从SD大鼠骨髓中获取单个核细胞,分离、培养并鉴定EPCs的方法,该方法稳定、经济且有效避免细胞污染,为今后探索EPCs的生物学特性奠定了实验基础。
1 材料与方法
1.1材料
SD大鼠购自贵州医科大学,雄性,约8周龄,体质量(150±20) g。DMEM低糖培养基购自Gibco公司,胎牛血清购自四季青公司,CD34-PE抗体购自Abcam公司,CD133-DyLight 488抗体购自Novus公司,VEGFR2-FITC抗体购自Abcam公司。
1.2方法
1.2.1EPCs的分离 SD大鼠麻醉后用颈椎脱臼法处死,将大鼠固定于操作台上,酒精常规消毒3次;取下并分离大鼠双侧股骨及胫骨,用含10%胎牛血清的PBS冲洗3遍;两端剪除少许骨骺端,暴露骨髓腔,用5 mL注射器抽取大鼠脏器组织淋巴细胞分离液试剂盒中的匀浆冲洗液冲洗大鼠股骨及胫骨骨髓腔,获得含骨髓细胞的冲洗液置于50 mL离心管中,将冲洗液用200目的细胞筛网过滤,得到细胞悬液;3 000 r/min,离心10 min,弃上清,用样本稀释液重悬细胞,并将细胞浓度调整为2×105~1×106个/L,取15 mL离心管,加入6 mL大鼠脏器组织淋巴细胞分离液,并将获得的骨髓细胞悬液缓慢加入离心管中;2 000 r/min,离心30 min,离心完毕可以观察到3层细胞,底层为红细胞和粒细胞层,中层为白膜层、此层为单个核细胞层,最顶层为血浆层。用吸管轻轻吸取中层细胞。
1.2.2EPCs的培养 将分离细胞以3×102个/L密度接种于细胞培养板中,置于37 ℃、5% CO2恒温培养箱中进行贴壁培养,48 h后更换20%新鲜完全培养基(DMEM低糖培养基含20%胎牛血清,青霉素105U/L,链霉素100 mg/L),去除未贴壁的细胞,每5 d换液1次。
1.2.3EPCs的鉴定及检测 收集培养7 d的EPCs,用0.25%胰蛋白酶消化,置于流式上样管中,将消化所得细胞用PBS 1 000 r/min离心5 min清洗3次,弃上清;用PBS 100 μL重悬细胞,每管加入LCD34-PE 2 μL和CD133-DyLight 488抗体2 μL,另取一管加入VEGFR2-FITC 2 μL,4 ℃避光孵育30 min、用PBS洗涤离心、使用PBS 400 μL重悬细胞,避光保存待上机检测。
1.3观察指标
1.3.1EPCs细胞观察 倒置显微镜下观察大鼠骨髓来源EPCs细胞培养在48 h、1周及2周时的形态学变化,采用流式细胞仪鉴定EPCs细胞表面标志物CD34、CD133及VEGFR2的表达。
1.3.2生长曲线的测定 分别消化并收集培养2、4、5、7、8、10、14及18 d的EPCs,在血球计数板上计数,每次取3个孔细胞,计算平均值,根据计数结果,绘制生长曲线。
1.4统计学分析
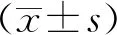
2 结果
2.1EPCs细胞形态
EPCs细胞培养48 h时,大部分悬浮的细胞已经贴壁生长,可见细胞呈多边形、梭形、多角形;培养1周细胞逐渐变大、细胞数增多,呈铺路石样;培养2周的大部分细胞可见明显增多,可见克隆样集落。见图1。
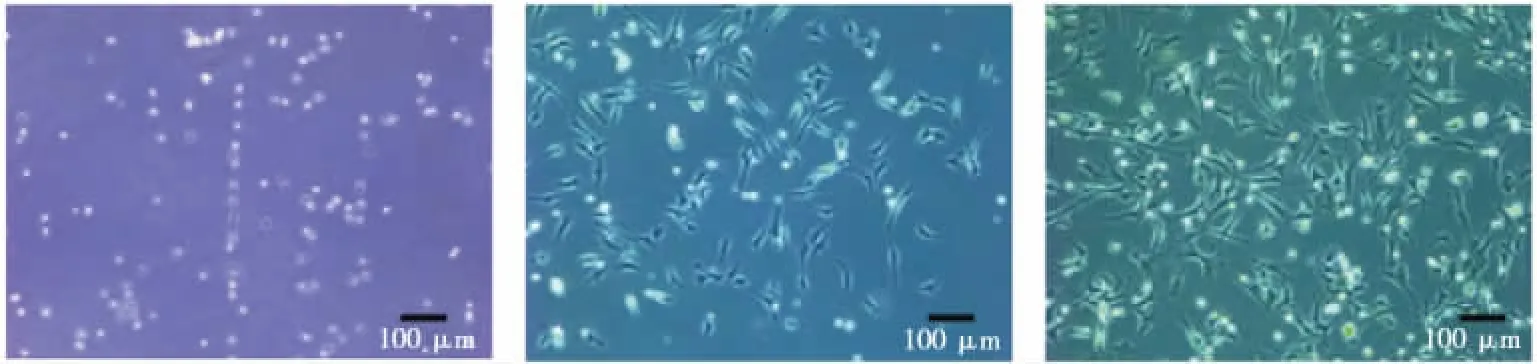
培养48 h 培养1周 培养2周图1 大鼠骨髓来源EPCs形态学观察(40×)Fig.1 The morphology of EPCs isolated from rat bone marrow(40×)
2.2流式细胞仪鉴定EPCs
EPCs培养7 d时,采用流式细胞仪检测共表达CD34-PE和CD133-DyLight 488细胞比例(图2A)。结果显示,CD34+和CD133+双阳性细胞占总体(22.15±1.002)%、CD34+单阳性细胞占(21.32±1.044)%及CD133+单阳性细胞占(28.67±0.711)%;VEGFR2+细胞数量(17.91±1.418)%,较未经染色对照组(1.52±0.129)%显著升高,差异有统计学意义(P<0.05,图2B、C、D)。结果提示,该细胞为EPCs。

注:(1)与Unstain组比较,P<0.05。图2 流式细胞仪鉴定EPCs细胞中CD34、CD133及VEGFR2的表达Fig.2 The expression levels of CD34,CD133 and VEGFR2 on EPCs by flow cytometry
2.3EPCs的生长曲线
血球计数板计数后,制作细胞生长曲线,结果提示,细胞生长的潜伏期在第1~4天;第5~9天时,EPCs增殖迅速,进入指数增生期;第10~13天时,细胞生长进入平台期;第14天以后,细胞逐渐进入衰亡期。见图3。

图3 EPCs细胞生长曲线Fig.3 The growth curve of EPCs
3 讨论
自1997年Asahara等[15]首先发现骨髓来源的EPCs细胞后,EPC在心血管健康中的重要作用日益被人们所认识。成熟内皮细胞的再生能力有限,因此,研究者对循环的内皮祖细胞日益重视,特别是对其可维持内皮完整性、功能及产后新生血管的作用[16]。研究表明,EPCs不仅可恢复损伤后的内皮功能,而且还可参与血管生成,为新的治疗带来希望[17-18]。越来越多的证据表明,在心血管疾病的情况下,EPCs功能会下降和受损[19-20]。因此,目前在临床中应用EPCs对缺血性心脏病进行治疗成为研究热点。随着研究深入,各课题组分别从骨髓、心脏及胎鼠肺等提取EPCs。研究证实,骨髓中EPCs是外周血的15倍[21],因此,从骨髓中提取EPCs是一种高效的方法。本课题组分离大鼠双侧股骨及胫骨,可获得约4×107左右细胞,可以满足后续实验需求。此外,在本实验中发现约8周龄SD大鼠适合提取EPCs,周龄过大或者过小对于骨髓来源的EPCs的数量提取都会产生较大影响。
现有一系列不同的方法鉴定EPCs,传统上EPCs被定义为表达内皮细胞标志物(VEGFR2)和标记祖细胞标志物(CD34/CD133)的细胞,然而围绕这个定义有相当多的争论,因为这些标记都不是完全特异性的[22-23]。相关研究报道,CD34+、CD133+及VEGFR2+细胞是造血性细胞,实际上可能不是真正的EPCs[24]。随着研究深入,目前研究表明,EPCs细胞表面的标志物并不是固定的,而是一个动态演变的过程,随着内皮祖细胞向内皮细胞演变的过程中,其干性逐渐丢失[25],干细胞的标志物CD133也逐渐降低直至丢失,但确定为内皮祖细胞至少能表达干细胞特征CD133、CD34或者内皮细胞的特征VEGFR2[26-27]。Schemidtlucke等[28]研究也阐明将流式细胞仪鉴定CD34和VEGFR2双阳性且CD45弱阳性的细胞定义为EPCs。根据本课题组研究表明,课题组选用CD34、CD133及VEGFR2表达阳性的鉴定内皮祖细胞,结果提示所培养的细胞确实为EPCs细胞。
综上所述,本课题组建立了一系列从大鼠骨髓细胞中分离,培养及鉴定内皮祖细胞的方法,该方法便捷、高效、经济,为进一步探索EPCs细胞的分化、增殖、迁移及其他生物学特性奠定了坚实的实验基础。

