摇瓶法培养甲烷氧化菌吸附甲烷氧化菌素的研究
张 帅,郝 雪,王 悦,辛嘉英
(哈尔滨商业大学 黑龙江省普通高等学校食品科学与工程重点实验室,哈尔滨 150076)
甲烷氧化菌(Methanotroph)是广泛存在于自然界中的一种能够以甲烷、甲醇等单碳化合物为碳源来进行生长的微生物[1],它对于改善大气中甲烷的平衡具有重要意义,可以预防并阻止日趋严重的温室效应.此外,大量研究表明,甲烷氧化菌在生物可降解塑料、单细胞蛋白的合成、食品抗氧化剂、食品安全检测、三氯乙烯等有机成分的降解以及提供清洁能源等方面也表现出了相当大的潜力[2~5].甲烷氧化菌的代谢主要依靠一种叫甲烷单加氧酶(Methane monooxygenase,MMO)的物质,甲烷在它的作用下被催化氧化而生成甲醇[6].甲醇脱氢酶(Methanol dehydrogenase,MDH)又将生成的甲醇继续氧化成甲醛,依赖于甲醛脱氢酶(Formaldehyde dehydrogenase,FDAH)和甲酸脱氢酶(Formate dehydrogenase,FDH)的作用最终使甲醛彻底氧化分解为CO2和H2O,同时通过丝氨酸循环或磷酸戊糖途径完成细胞合成,为细胞代谢提供还原物质[7].
在甲烷氧化菌的研究中发现存在一种小分子的荧光肽,它以分泌物的形式存在于甲烷氧化菌细胞外,同时又可以进入细胞内膜参与颗粒性甲烷单加氧酶的形成[8].2004年这种荧光肽的结构数据被发表,由7个氨基酸组成,包含2个咪唑N和2个硫酰S的硫酰咪唑基团,可以与铜离子发生络合[9].2008年该结构又被进行了部分修正,原来的羟咪唑基团更改为酮咪唑基团,异丙酯结构更改为甲基丁酰基结构.从此以后,该物质也就被命名为甲烷氧化菌素(methanobacin, mb)[10].甲烷氧化菌素对铜具有较强的亲和性,2004年Kim等人在研究甲烷氧化菌素结合铜的机理时,发现低浓度Cu有利于促进甲烷氧化菌素的积累.当提供大量的Cu时,会促使甲烷氧化菌素与pMMO结合在细胞内膜上[11].另外,甲烷氧化菌素∶Cu=1∶1时,甲烷氧化菌素促进甲烷氧化菌的生长.同时,颗粒性甲烷单加氧酶一旦与甲烷氧化菌素分离,颗粒性甲烷单加氧酶会丧失活性,生长受到抑制.分析其原因,甲烷氧化菌可能会像其他能分泌嗜铁素(siderophore)用于捕获环境中铁的细菌一样具有捕获铜的能力,而这种能力就来源于甲烷氧化菌素[12].此后,Choi等发现甲烷氧化菌细胞外的甲烷氧化菌素在结合铜后返回细胞内膜,参与颗粒性甲烷单加氧酶的催化氧化过程.加快了反应中电子的流动性.甲烷氧化菌素还具有过氧化物酶和超氧化物歧化酶(SOD)活性,说明甲烷氧化菌素在颗粒性甲烷单加氧酶的催化氧化过程中将NADH等电子供体向颗粒性甲烷单加氧酶传递,清除氧化反应过程中产生的超氧阴离子自由基,对细胞起到保护作用[13].通过改变摇瓶法培养甲烷氧化菌的条件,采用大孔树脂法对甲烷氧化菌素的静态吸附及动态吸附后分离纯化甲烷氧化菌素,找到最佳吸附甲烷氧化菌素效果,有望为甲烷氧化菌OB3b应用提供理论参考.
1 仪器与材料
1.1 仪器
立式高压灭菌器(上海申安LDZX-50KB型);恒温振荡器(哈尔滨东联电子HZQ-D型);紫外-可见分光光度计(日本岛津UV-2550型);高速离心机(德国贺默公司Z-366);RV8V旋转蒸发仪(德国IKA公司).
1.2 实验材料
甲烷氧化菌OB3b(Methylosinus trichosporium OB3b),由清华大学邢新会教授赠送;NMS培养基参照文献[14]方法配制;甲烷(北京海普气体有限公司);大孔树脂;甲醇,K2HPO4,KH2PO4·7H2O,NH4Cl,KNO3,硫酸铜等均为分析纯(天津市天力化学试剂有限公司).
1.3 实验方法
1.3.1 摇瓶法培养甲烷氧化菌
培养基选用甲烷氧化菌OB3b培养基的配制方法培养甲烷氧化菌OB3b,定容至3 L的容量瓶.用纱布和报纸包扎瓶口,将上述物品放入高压灭菌锅中灭菌,121 ℃灭菌20 min后,置于无菌操作台上冷却.按照10%接种量接种,用带棉花的玻璃管胶塞封口.以甲烷作为碳源培养,采用真空抽气法抽气后置入甲烷.温度30 ℃,180 r/min,空气浴摇床中培养5 d,每24 h通入一次甲烷.
1.3.2 甲烷氧化菌素的制备分离纯化
离心取上清液,柱层析前对大孔树脂进行活化,过柱后用60%甲醇洗脱大孔树脂中吸附的甲烷氧化菌素,将装有甲烷氧化菌素提取液的烧瓶40 ℃,130 r/min旋转蒸发,旋蒸多余的甲醇样品冷冻干燥获得甲烷氧化菌素.
1.3.3 不同装液量对大孔树脂静态吸附培养甲烷氧化菌生长的影响
分别于3 L玻璃摇瓶中配制装液量为1.2、1.3、1.4、1.5、1.6 L的不同体积的甲烷氧化菌OB3b培养基,加入等量已处理好的大孔树脂.121 ℃灭菌20 min后按照10%接种量接种.30 ℃,180 r/min,空气浴摇床中培养5 d,每24 h通入一次甲烷,每隔一天取出3 mL菌液,用紫外可见分光光度计测菌液600 nm吸光值.
1.3.4 不同装液量对大孔树脂动态吸附培养甲烷氧化菌生长的影响
分别于3 L玻璃摇瓶中配制装液量为1.2、1.3、1.4、1.5、1.6 L的不同体积的甲烷氧化菌OB3b培养基,不加入大孔树脂.121 ℃灭菌20 min后按照10%接种量接种.30 ℃,180 r/min,空气浴摇床中培养5 d,每24 h通入一次甲烷,每隔一天取出3 mL菌液,用紫外可见分光光度计测菌液600 nm吸光值.
1.3.5 大孔树脂静态吸附法对吸附甲烷氧化菌素的影响
分别配制5瓶1.5 L的甲烷氧化菌OB3b培养基,每个培养基各加入等量已处理好的大孔树脂,按照10%接种量接种甲烷氧化菌OB3b,30 ℃,180 r/min空气浴摇床中培养,每24 h通入一次甲烷,每隔一天取出1瓶菌液对其产生甲烷氧化菌素进行分离纯化,用紫外分光光度计扫描全波长,计算甲烷氧化菌素的浓度.
1.3.6 大孔树脂动态吸附法对吸附甲烷氧化菌素的影响
分别配制5瓶1.5 L的甲烷氧化菌OB3b培养基,按照10%接种量接种甲烷氧化菌OB3b,30 ℃,180 r/min空气浴摇床中培养,每24 h通入一次甲烷,每隔一天取出1瓶菌液对其发酵液进行分离纯化产生甲烷氧化菌素,用紫外分光光度计扫描全波长,计算甲烷氧化菌素的浓度.
2 实验结果与讨论
2.1 不同装液量对大孔树脂静态和动态吸附下甲烷氧化菌的生长结果
如图1、2所示,1.2、1.3、1.4、1.5、1.6 L五种不同装液量的培养基,在相同的培养条件下,分别进行1~5 d的培养后,可以看出1.2、1.3 L装液量的甲烷氧化菌OB3b吸光值增加并不明显,说培养基装液量不足导致营养物质不能满足甲烷氧化菌OB3b的生长需求而生长缓慢;而1.4、1.5 L随着装液量的升高,菌体生长加快;1.6 L时,菌体生长反而下降,说明装液量过多,导致留给菌体进行有氧呼吸的空间被缩小,抑制了菌体生长.故当培养基用量为1.5 L时,甲烷氧化菌OB3b的生长情况最好.另外,对比大孔树脂静态和动态吸附下培养甲烷氧化菌的生长结果发现,大孔树脂静态吸附的培养方式也优于动态吸附.
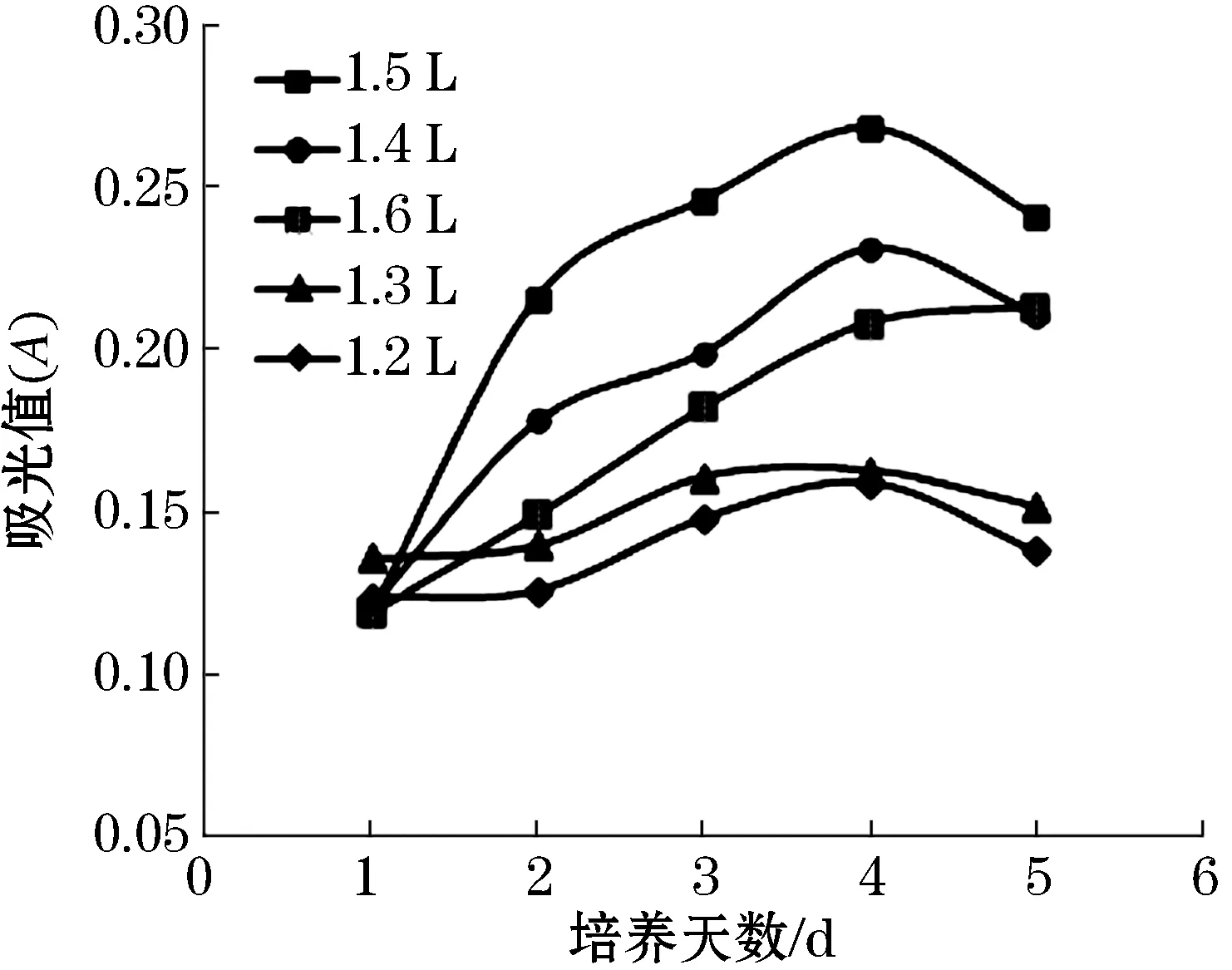
图1 不同装液量在大孔树脂静态吸附方式培养甲烷氧化菌的生长曲线

图2 不同装液量在大孔树脂动态吸附方式培养甲烷氧化菌的生长曲线
2.2 大孔树脂静态吸附法对吸附甲烷氧化菌素的影响结果
如图3、4所示,1.5 L的培养基,在相同的培养条件下,分别进行1~5 d的培养后,可以看出,培养1~4 d所得到的甲烷氧化菌素进行紫外分光光度计的全波长扫描后,随着培养时间的增加,甲烷氧化菌素在394 nm最大吸收峰对应增加,说明随着甲烷氧化菌OB3b的生长速度加快,菌体数量增多,其向胞外释放的甲烷氧化菌素量也逐渐增多,随即很快就被培养基中的大孔树脂所吸附.培养4 d后,甲烷氧化菌素开始减少,可能是由于在发酵液中甲烷氧化菌数量已达到最大值,部分菌体出现死亡,部分甲烷氧化菌素发生裂解破碎而无法被检测到.故选择4 d为甲烷氧化菌OB3b最佳吸附甲烷氧化菌素的培养时间.
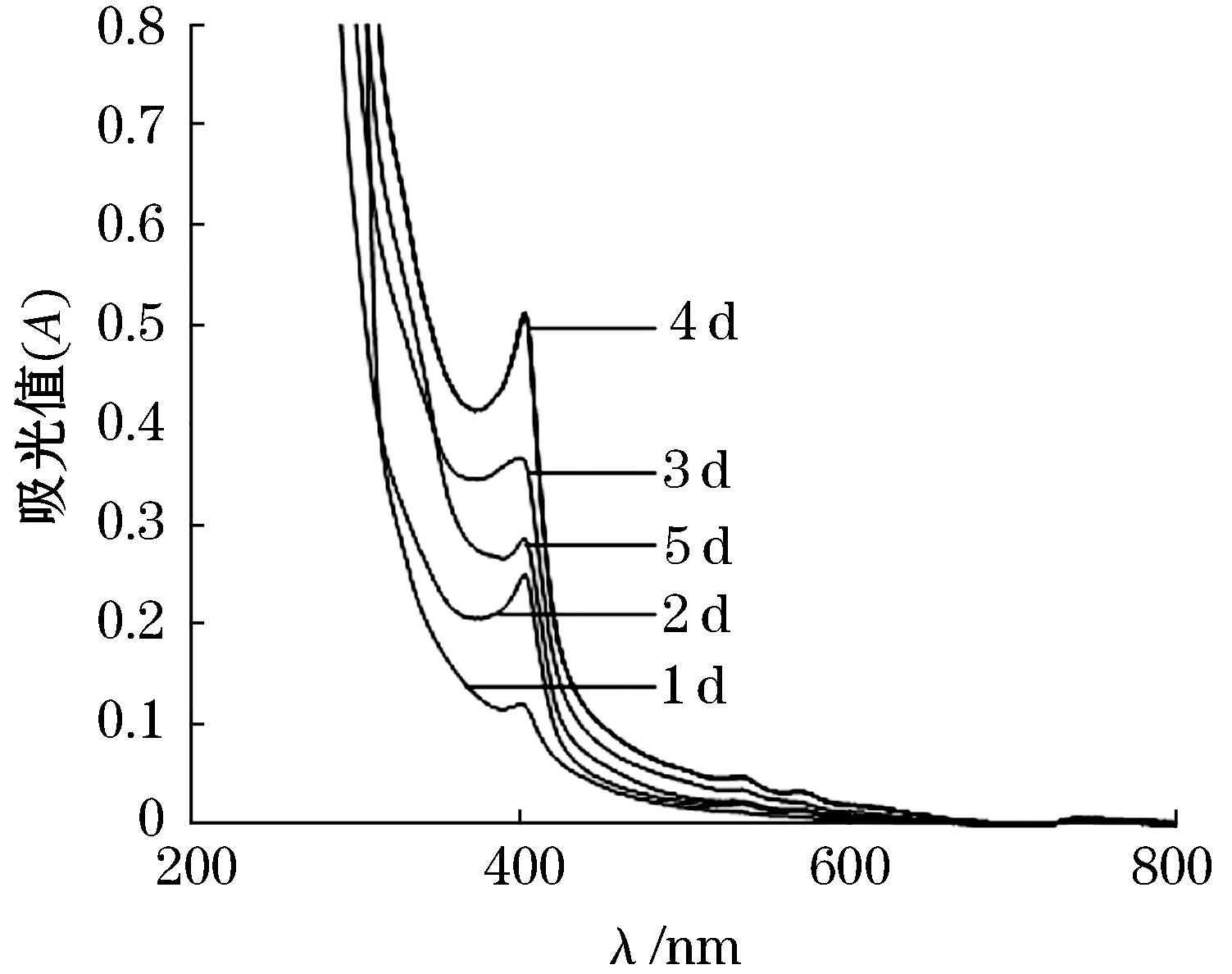
图3 大孔树脂静态吸附甲烷氧化菌素的全波长扫描
通过静、动态两种吸附方式比较发现,静态吸附培养时,随着时间的递增,甲烷氧化菌素的394 nm吸收峰明显.而在相同培养条件下动态吸附没有明显的吸收峰,说明静态吸附培养条件下,更多的甲烷氧化菌素被吸附进入大孔树脂而最后被分离出来.因此从紫外分光光度计检测甲烷氧化菌素含量的角度来说,静态吸附要优于动态吸附.
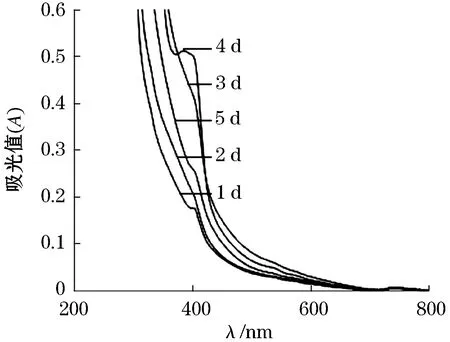
图4 大孔树脂动态吸附甲烷氧化菌素的全波长扫描
3 结 语
本实验分别对甲烷氧化菌OB3b在大孔树脂静态和动态吸附法的培养方式下,考察不同装液量对菌体生长的影响,大孔树脂静态吸附和动态吸附法对吸附甲烷氧化菌素的影响.结果表明,培养基装液量为1.5 L时,培养4 d,大孔树脂静态吸附的培养方式对甲烷氧化菌OB3b的生长较好.同时,静态吸附下,大孔树脂静态吸附甲烷氧化菌素的量也更多,为今后提高甲烷氧化菌素的分离能力奠定了科学基础.

