滋阴益气活血方对免疫性卵巢早衰小鼠转化生长因子-β1及PI3K相关蛋白表达的影响
黄姗姗 张韫玉 刘慧萍 张楚洁 陈沙 杨凯麟 肖小芹

摘要:目的 觀察滋阴益气活血方对免疫性卵巢早衰小鼠转化生长因子-β1(TGF-β1)、PI3K、AKT1蛋白表达的影响,探讨其改善卵巢功能的作用机制。方法 取Balb/C雌性小鼠60只,随机选取10只为空白组,其余50只用于造模。用透明带3作抗原,皮下多点注射制作免疫性卵巢早衰动物模型。成模后实验小鼠随机分为模型组、阳性对照组和滋阴益气活血方低、中、高剂量组,各给药组给予相应药物,连续给药30 d。HE染色观察小鼠卵巢组织病理形态,免疫组化检测小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表达。结果 与空白组比较,模型组小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表达明显降低(P<0.01);与模型组比较,各给药组小鼠卵巢内成熟卵泡数量均明显增多,闭锁卵泡数量相对减少,滋阴益气活血方中、高剂量组和阳性对照组小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表达明显升高(P<0.01)。结论 滋阴益气活血方可改善模型小鼠卵巢功能,其机制可能与升高TGF-β1、PI3K、AKT1蛋白的表达相关。
关键词:滋阴益气活血法;卵巢早衰;卵巢组织;转化生长因子-β1;PI3K;AKT1;小鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2020)01-0033-06
DOI:10.3969/j.issn.1005-5304.201906253
Effects of Ziyin Yiqi Huoxue Prescription on Expressions of TGF-β1 and PI3K Related Proteins in Premature Ovarian Failure Mice
HUANG Shanshan, ZHANG Yunyu, LIU Huiping, ZHANG Chujie,CHEN Sha, YANG Kailin, XIAO Xiaoqin
Hunan University of Chinese Medicine, Changsha 410208, China
Abstract: Objective To observe the effects of Ziyin Yiqi Huoxue Prescription on the expressions of transforming growth factor-β1 (TGF-β1), PI3K and AKT1 proteins in immune premature ovarian failure mice; To explore its mechanism of action to improve ovarian function. Methods With 10 mice as blank group, fifty Balb/C female mice were subcutaneously injected with zona pellucida 3 as antigen to establish an animal model of immune premature ovarian failure. The model mice were randomly divided into model group, positive control group, Ziyin Yiqi Huoxue Prescription low-, medium-, and high-dosage groups. Administere groups were given the corresponding medicine. The medicine was administered continuously for 30 days. Pathological morphology of mouse ovary tissue was detected by HE staining. The expressions of TGF-β1, PI3K and AKT1 were detected by immunohistochemistry. Results Compared with the blank group, the expressions of TGF-β1, PI3K and AKT1 protein in ovarian tissue of model group decreased significantly (P<0.01); Compared with the model group, the number of mature follicles in ovaries in each administration groups increased significantly, and the number of atresia follicles decreased relatively. The expressions of TGF-β1, PI3K and AKT1 protein in Ziyin Yiqi Huoxue Prescription medium- and high-dosage groups and the positive control
group increased significantly (P<0.01). Conclusion Ziyin Yiqi Huoxue Prescription can improve the ovarian function of model mice, and its mechanism may be related to the increase of expressions of TGF-β1, PI3K, AKT1 protein.
Keywords: Ziyin Yiqi Huoxue Prescription; premature ovarian failure; ovarian tissue; TGF-β1; PI3K; AKT1; mice
卵巢早衰(premature ovarian failure,POF)是指在青春期发育之后到40岁以前的女性,由于多种原因导致而出现的卵巢储备功能衰竭的一类妇科疾病,表现为闭经、不孕,并可能伴有围绝经期症状[1]。常规检查表现为垂体促性腺激素指标升高、雌激素指标降低。人类卵母细胞中PI3K通路中各信号分子异常表达会导致原始卵泡生存和发育的缺陷,造成卵巢的病理状态[2]。AKT1作为AKT的亚型之一,在身体各个组织均有表达[3],参与细胞的生存和生长调控[4]。转化生长因子(TGF)-β亚型之一TGF-β1是多种免疫细胞的自分泌和旁分泌因子,参与各种疾病的发生发展,是维持卵泡正常发育所必须的细胞调控因子,通过多种途径在卵泡的生长、发育过程中发挥重要调节作用[5]。滋阴益气活血方为湖南中医药大学尤昭玲教授经验方,长期用于妇科临床,其治疗遵循“未病先防、既病防变”原则,提倡早发现、早治疗,用药多以补肾为主,兼顾疏肝、健脾、活血,促使月经来潮,恢复卵巢排卵功能。本实验采用小鼠透明带3(ZP3)作抗原,進行皮下多点注射建立免疫性POF小鼠模型[6-7],观察滋阴益气活血方对模型小鼠TGF-β1、PI3K、AKT1蛋白表达的影响,为临床治疗POF提供依据。
1 实验材料
1.1 动物
健康雌性Balb/C小鼠60只,SPF级,8周龄,体质量18~22 g,动物许可证号SCXK(湘)2016-0002。饲养于湖南中医药大学实验动物中心SPF级实验室,分笼喂养,温度20~25 ℃,相对湿度50%~60%,光照12 h明暗交替,自由摄食饮水。
1.2 药物
滋阴益气活血方(熟地黄15 g,黄精12 g,枸杞子12 g,山萸肉12 g,当归15 g,白芍12 g,川芎9 g,丹参12 g,桃仁9 g),饮片由湖南中医药大学第一附属医院药剂科提供;戊酸雌二醇片,1 mg/片,拜耳医药保健有限公司,批号20181205。
1.3 主要试剂与仪器
小鼠透明带多肽溶液:小鼠ZP3第330~342个氨基酸序列(NSSSSQFQIHGPR),分析纯度>90%,杭州中肽生化有限公司,批号P00105;弗氏完全佐剂,美国Sigma公司,批号F5881;弗氏不完全佐剂,美国Sigma公司,批号F5506;兔抗小鼠TGF-β1抗体(BA0290)、PI3K抗体(bs-0128R)、AKT1抗体(bs-0115R)和PV-9000通用型二步法检测试剂盒,北京中杉金桥生物技术有限公司,批号K173301A。LEICA DMLB2型双目显微镜,LEICA RM2235全自动轮转式切片机,LEICA HI1210摊片机,Motic BA410生物显微镜,MIAS医学图像分析系统,METTLER TOLEDO PL203型电子天平。
2 实验方法
2.1 造模
取ZP3透明多肽粉6 mg,加入6 mL双蒸水配成溶液,与弗氏完全佐剂按1∶1比例配制成免疫试剂,与弗氏不完全佐剂按1∶1比例配制成免疫强化试剂。按文献[8]方法,每只小鼠给予0.15 mL免疫试剂注射双后脚掌处及腹腔皮下,14 d后给予免疫强化试剂0.15 mL再次注射双后脚掌处及腹腔皮下加强免疫,建立免疫性POF模型。空白组小鼠则予0.15 mL生理盐水注射相同部位。小鼠适应性喂养1周后开始造模,小鼠出现动情周期紊乱表示模型制作成功。
2.2 分组及给药
随机选取10只小鼠为空白组,其余50只小鼠用于造模。将成模小鼠随机分为模型组、阳性对照组和滋阴益气活血方低、中、高剂量组(中药低、中、高剂量组),每组10只。中药给药剂量按人和动物体表面积换算成临床成人用药浓度1、2、4倍,低、中、高剂量分别为0.54、1.08、2.16 g/mL;戊酸雌二醇片按每人每日1 mg计算,根据小鼠与人体表面积进行换算,配成每1 mL含药0.01 mg溶液。成模后小鼠常规饲养1周开始给药,空白组和模型组均给予生理盐水0.3 mL灌胃,阳性对照组给予戊酸雌二醇水溶液0.3 mL灌胃,中药低、中、高剂量组分别给予等体积药液0.3 mL灌胃。连续30 d。
2.3 体质量和动情周期测定
定期记录小鼠体质量。从注射免疫试剂第8日开始,每日9:00对所有小鼠进行阴道脱落细胞涂片HE染色,镜下连续7 d观察小鼠动情周期。
2.4 卵巢组织病理观察
取卵巢组织,称重,置于4%多聚甲醛溶液固定,脱水、透明、浸蜡,石蜡包埋、切片、脱蜡,常规HE染色,制成病理切片。镜下观察卵巢内正常卵泡和闭锁卵泡的形态学变化。
2.5 免疫组化检测小鼠卵巢组织转化生长因子-β1、PI3K、AKT1蛋白表达
将固定好的卵巢组织,脱水、透明、浸蜡,完成石蜡包埋、切片、脱蜡,采用免疫组化检测卵巢组织TGF-β1、PI3K、AKT1蛋白表达。采用免疫组化半定量分析方法,镜下选取阳性表达区域进行图片拍摄,运用MIAS医学图像分析软件分析图片,取5个视野,测量平均灰密度值。
3 统计学方法
采用SPSS22.0统计软件进行分析。实验数据以±s表示,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
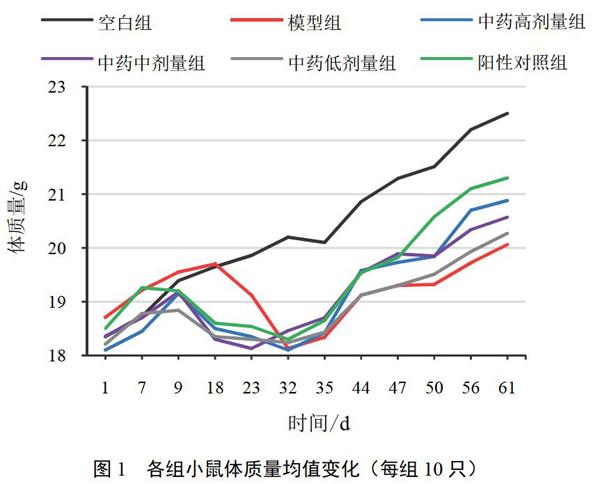
4.1 滋阴益气活血方对模型小鼠体质量和动情周期的影响
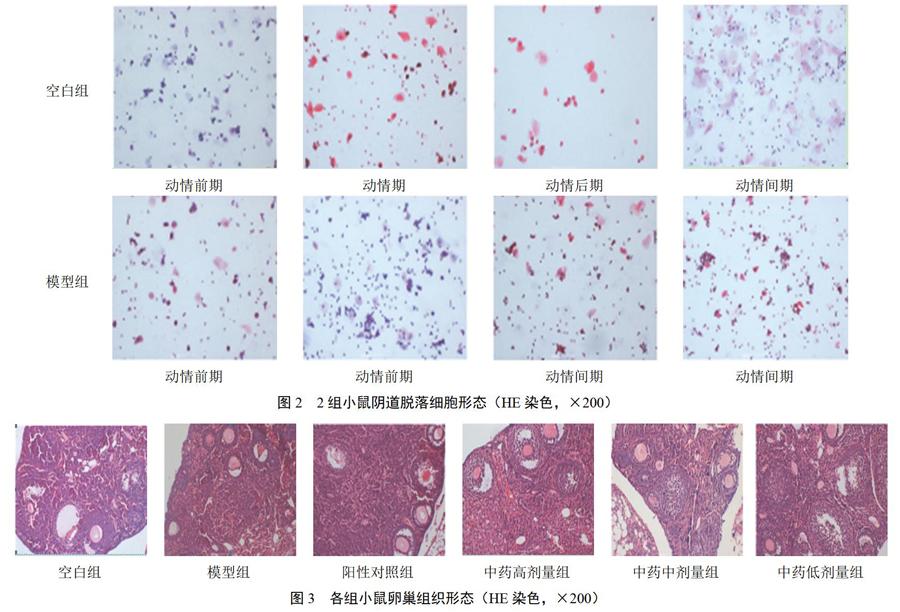
免疫强化试剂注射后,模型组小鼠体质量下降,给药后中药高剂量组和阳性对照组小鼠体质量增长速度最快,中药中、低剂量组小鼠体质量增长幅度变化较大,模型组小鼠体质量增长速度相对缓慢,见图1。HE染色结果显示,空白组小鼠有完整的动情周期(动情前期、动情期、动情后期和动情间期),与空白组比较,模型组小鼠动情周期紊乱,并一直处于动情前期或动情间期,见图2。
4.2 滋阴益气活血方对模型小鼠卵巢组织形态的影响
空白组小鼠卵巢发育正常,组织结构清晰,可见正常卵泡;模型组小鼠卵巢组织结构相对紊乱,卵巢内成熟卵泡数量明显减少,可见少量初级卵泡,闭锁卵泡数量明显增多;阳性对照组小鼠卵巢组织形态明显改善,初级卵泡数量增多,可见少量闭锁卵泡;中药高剂量组小鼠卵巢组织结构相对正常,可见大量初级卵泡,闭锁卵泡数量明显减少;中药中剂量组小鼠卵巢组织初级卵泡和成熟卵泡数量相对增多,闭锁卵泡数量相对减少;中药低剂量组小鼠卵巢组织形态有改变,可见多个闭锁卵泡。中药高剂量组和阳性对照组小鼠卵巢组织形态更接近空白组。见图3。
4.3 滋阴益气活血方对模型小鼠卵巢组织转化生长因子-β1、PI3K、AKT1蛋白表达的影响
与空白组比较,模型组小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表达明显下降(P<0.01);与模型组比较,各给药组小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表達明显升高(P<0.05,P<0.01)。见图4、表1。
5 讨论
有研究显示,POF发病多与遗传、自身免疫功能、妇科手术、放化疗等因素有关[9]。卵巢从形成到发育,其中任何一个环节的异常都可能导致POF,被发现时卵巢很可能已经处于衰竭状态[10-11]。有研究表明,卵泡发育生长期间,通过诱导PI3K,可使AKT激活,将其运输到卵巢颗粒细胞胞质或胞核中,引起下游相关信号因子活化,促进颗粒细胞增殖[12]。有研究人员通过使用多种基因修饰小鼠,或对大鼠进行造模,在卵巢相关的生理和病理过程中对PI3K/AKT信号通路进行一系列实验研究,发现各信号分子异常表达可导致原始卵泡生存和发育缺陷,表明其不仅参与卵泡发育、排卵,还参与其他卵巢相关疾病[13]。通过针刺疗法对POF模型大鼠进行研究,发现PI3K/AKT/mTOR信号通路mRNA和蛋白表达均升高,雌二醇分泌水平也相应提升,卵巢分泌激素功能恢复至正常水平,同时成熟卵泡数量增加,原始卵泡和大量初级卵泡功能恢复,表明PI3K/AKT信号通路对卵泡的生长和成熟起至关重要的作用[14]。通过对TGF-β1与卵巢相关疾病的研究发现,TGF-β1在卵巢的不同发育阶段均有表达,当表达正常时,对卵泡的发育及黄体的形成都有很好的促进作用,反之,会影响卵泡发育甚至排卵[10,15-16]。TGF-β1不仅参与卵母细胞的成熟、颗粒细胞的增殖调节卵巢功能,还可能通过增强卵巢颗粒细胞对低剂量促卵泡激素刺激的敏感度[17],推进卵泡的生长及分化[18],这对维持卵巢内环境的稳定有重要作用[19]。在研究卵巢发育、卵泡生长过程中,发现经PI3K/AKT信号通路能刺激卵泡,使其加速生长,提高排卵率[20-21]。在对女性生殖系统疾病研究中发现,TGF-β1可诱导人宫颈癌HeLa细胞获得间质细胞特征,并且作用于HeLa细胞后,激活PI3K/AKT信号通路,诱导上皮间质转化,促进其迁移和侵袭,表明TGF-β1可介导PI3K/AKT信号通路对女性相关疾病发挥一定的作用[22]。TGF-β1除能通过经典的TGF-β/Smad蛋白信号传导途径或丝裂原活化蛋白激酶等途径对卵巢的颗粒细胞产生增殖和分化的调节作用,还能通过PI3K/AKT信号传导途径起到相应的调节作用[23]。
POF可归属中医学“血枯”“不孕”等范畴。治法主要是滋阴益气活血。肾主藏精,其先天之精是生长发育生殖的物质基础。肾精充,则肾气足。卵巢功能退化也可归结于肾虚精亏。肾气虚,其激化作用减退,可致生殖之精无法化生导致精亏,人体生殖机能发生衰退。目前西医治疗本病多以雌激素为主,长期使用不良反应大。中医药有着多系统、多环节的整体调节作用。现代药理研究表明,熟地黄、黄精等补肾药有类雌激素作用,能改善POF引起的雌激素分泌不足,以此提高子宫内膜的容受性,改善宫颈黏液的分泌,提高人体免疫力;川芎、桃仁等活血化瘀药能改善盆腔微循环,增加子宫及卵巢的供血,使雌激素水平得到改善。课题组前期研究发现,相关组方可通过调节Bcl-2/Bax系统平衡,调节免疫反应及细胞毒性淋巴细胞功能,促进B细胞、抑制外周血抗透明带抗体等抗卵巢抗体聚集,减轻卵巢免疫炎性反应,改善卵巢功能[24]。从免疫学的角度研究和总结了相关免疫细胞与POF的关系[25]。
本研究发现,与空白组比较,模型组POF小鼠卵巢组织TGF-β1、PI3K、AKT1蛋白表达明显降低(P<0.01),卵泡闭锁情况明显增多。给予中药治疗后,TGF-β1、PI3K、AKT1蛋白表达上升,其中,中药中、高剂量组蛋白表达明显升高,差异有统计学意义(P<0.01),阳性对照组表达最明显,且优于中药中、高剂量组,但差异均无统计学意义(P>0.05)。说明滋阴益气活血方可能通过影响TGF-β1、PI3K、AKT1蛋白的表达来改善卵巢功能。有研究表明,TGF-β1诱导的自噬能通过TGF-β受体、Smad通路调控[26],敲除Smad2/3或Smad4后TGF-β诱导的自噬被抑制,但TGF-β也可通过PI3K/AKT激活mTOR通路,使自噬被激活[27],而且TGF-β1抑制或推动细胞的生长或凋亡,均与特定细胞存在的内环境有关[28]。在POF的内环境,TGF-β1蛋白通过何种机制刺激或调控卵巢内细胞自噬,我们将进一步研究和探索,也希望通过滋阴益气活血方对相关蛋白表达作用的研究,为改善卵巢内环境及POF的治疗提供思路。
参考文献:
[1] 王冰,王旭东.中医药对不同卵巢早衰模型治疗的研究进展[J].医学综述,2016,22(6):1156-1159.
[2] 杨蕾,陶仕英,王继峰,等.PI3k/Akt通路参与二仙汤抑制顺铂所致卵巢颗粒细胞凋亡的作用[J].世界科学技术-中医药现代化,2016,18(8):1362-1367.
[3] 赵艳梅,张建康,蔡兆斌,等.Akt抑制剂的临床研究进展[J].中国现代应用药学,2017,34(4):625-630.
[4] WANG Q, YU W N, CHEN X, et al. Spontaneous hepatocellular carcinoma after the combined deletion of Akt isoforms[J]. Cancer Cell,2016,29(4):523-535.
[5] KNIGHT P G, GLISTER C. TGF-beta superfamily members and ovarian follicle development[J]. Reproduction,2006,132(2):191-206.
[6] RHIM S H, MILLAR S E, ROBEY F, et al. Autoimmune disease of the ovary induced by a ZP3 peptide from the mouse zona pellucida[J]. J Clin Invest,1992,89(1):28-35.
[7] SMITH S, HOSOD S. Premature ovarian failure associated with autoantibodies to the zona pellucida[J]. Int J Fertil Menopausal Stud,1994,39(6):316-319.
[8] 付莉,赵怡璇,李守柔.卵巢早衰实验动物模型的建立[J].生殖医学杂志,2006,15(3):179-183.
[9] 李茜西,吕德欣.卵巢早衰的病因及治疗研究进展[J].中国医药导报,2014,11(30):165-167.
[10] NILSSON E E, DORAOSWAMY V, SKINNER M K. Transforming growth factor-beta isoform expression during bovine ovarian antral follicle development[J]. Mol Reprod Dev,2003,66(3):237-246.
[11] 黃姗姗,刘慧萍,张韫玉,等.卵巢颗粒细胞自噬与PI3K/AKT/FOXO3a 信号通路的相关性[J].湖南中医药大学学报,2019,39(6):775-780.
[12] ASSELIN E, WANG Y, TASNG B K. X-linked inhibitor of apoptosis protein activates the phosphatidylinositol 3-kinase/Akt pathway in rat granulosa cells during follicular development[J]. Endocrinology,2001,142(6):2451-2457.
[13] 杨静,梁嘉丽,秦佳佳.PI3K/Akt信号通路与卵巢早衰相关性的研究进展[J].现代妇产科进展,2016,25(2):156-158.
[14] 张毅敏,于斌,陈佳,等.针刺治疗对卵巢早衰大鼠PI3K/Akt/mTOR信号通路的影响[J].中国针灸,2015,35(1):53-58.
[15] 王月平,郭洁,宋殿荣.转化生长因子β1与多囊卵巢综合征发病的关系[J].国际妇产科学杂志,2017,44(1):108-112..
[16] SIROTKIN A V. Cytokines:signalling molecules controlling ovarian functions[J]. Int J Biochem Cell Biol,2011,43(6):857-861.
[17] 谢江燕,何畏,赵俪梅,等.卵巢早衰患者CD4+CD25+调节性T细胞的变化及干扰素-γ、转化生长因子-β1的表达[J].华西医学,2013,28(3):377-379.
[18] WAN Y Y, FLAVELL R A. TGF-β and regulatory T cell in immunity and autoimmunity[J]. J Clin Immunol,2008,28(6):647-659.
[19] MYERS M, PANGAS S A. Regulatory roles of transforming growth factor beta family members in folliculogenesis[J]. Wiley Interdiscip Rev Syst Biol Med,2010,2(1):117-125.
[20] 龙旭.基于PI3K/AKT信号通路研究新加归肾丸调节大鼠卵巢颗粒细胞增殖、凋亡的分子机制[D].成都:成都中医药大学,2015.
[21] ZHANG M J, SU Y Q, SUGIUA K, et al. Granulosa cell ligand NPPC and its receptor NPR2 maintain meiotic arrest in mouse oocytes[J]. Science,2010,330(6002):366-369.
[22] 谭松红.经TGF-β1介导PI3K/Akt信号通路诱导宫颈癌Hela细胞发生EMT机制的探讨[D].衡阳:南华大学,2017:19.
[23] PANGAS S A. Regulation of the ovarian reserve by members of the transforming growth factor beta family[J]. Mol Reprod Dev, 2012,79(10):666-679.
[24] 刘慧萍,尤昭玲,雷磊,等.补肾活血方对免疫性卵巢早衰小鼠卵泡凋亡调控基因(Bcl-2/Bax)蛋白的影响[J].中华中医药学刊,2010,28(5):1036-1038.
[25] 刘慧萍,肖艺,李玲,等.补肾活血方对卵巢早衰小鼠颗粒细胞凋亡的影響[J].中国中医药信息杂志,2015,22(4):47-50.
[26] 卫新荣,王志莲,郝敏,等.自噬、TGF-β1在宫颈癌中的研究进展[J].世界最新医学信息文摘,2018,18(18):78-81.
[27] CHAO Z, XIN Z, RAN X, et al. TGF-β2 initiates autophagy via Smad and non-Smad pathway to promote glioma cells invasion[J]. J Exp Clin Cancer Res,2017,36(1):162.
[28] 喻婧,毕敏,李冰.TGF-β调节的自噬与肾纤维化[J].中国中西医结合肾病杂志,2016,17(4):371-373.
(收稿日期:2019-06-17)
(修回日期:2019-07-07;编辑:华强)
基金项目:湖南省中医药科研计划项目重点项目(201801、201815);湖南省自然科学基金面上项目(2018JJ2299);湖南省教育厅创新平台项目(18K069);国家级大学生研究性学习与创新性实验计划项目(201810541001);湖南省大学生研究性学习与创新性实验计划项目(2016-281、2018-400);湖南省中医方证研究转化医学重点实验室资助项目(2018TP1021)
通讯作者:刘慧萍,E-mail:1074983953@qq.com

