喉鳞状细胞癌中PI3K抑制剂对HMGA1基因表达的影响
张云龙,宋晓飞,段云静,赵辉明,赵瑞力,曹云云
(1.石家庄市第一医院 a.重症医学科三病区; b.耳鼻喉科,河北 石家庄050011;2.河北省人民医院 耳鼻喉科;3.河北医科大学第四医院 耳鼻喉科)
喉部原发性恶性肿瘤中主要为鳞状细胞癌,是耳鼻咽喉各部恶性肿瘤中常见类型之一。原癌基因广泛存在于人类真核细胞基因组中,在正常情况下不表达或只低表达,当受到致癌因子激活后可发生癌基因的活化、点突变,引起过度表达或表达异常产物,致细胞癌变。PI3K生长因子信号通路在胚胎发育和许多生理过程中起着重要作用,如免疫反应的产生。此通路经常在癌组织中激活,可加速细胞分裂并参与其他信号通路活化,如MAPK、JAK-STAT、 TGFβ,从而在促进肿瘤生长、转移和增加治疗抵抗行为中发挥作用[1]。原癌基因HMGA1为一结构转录因子,通过调节转录调控蛋白与DNA相互作用,重组染色质结构促进肿瘤发生,在宫颈癌、乳腺癌、甲状腺癌等多系统肿瘤中均可发现此基因过度表达[2]。喉鳞状细胞癌中此两种基因相互活化、共同促进表达增加的分子生物学机制未见有文献阐明。本课题组对癌组织及癌旁正常组织,分别用免疫组织化学SP法检测PI3K、HMGA1的表达情况,另采用RT-PCR分组比较ERK抑制剂应用人喉癌Hep2细胞后HMGA1表达情况,并分析HMGA1基因的表达和多种临床病理参数之间的关系。
1 材料与方法
1.1 材料
选取石家庄市第一医院耳鼻咽喉头颈外科2012至2017年行喉癌手术切除标本,经HE染色后严格筛选,留取标本中喉鳞状细胞癌47例,癌旁正常组织21例。其中:病理分级依据2005WHO肿瘤分型标准[3],高分化(G1、G2)37例,低分化(G3)10例;根据(UICC)TNM分类标准[4];临床分期(Ⅰ、Ⅱ)18例,(Ⅲ、Ⅳ)29例;淋巴结转移分组:N+(有淋巴结转移)26例,N0(无淋巴结转移)21例;吸烟分组参考Zuo JingJing吸烟与喉癌风险关系[5],以烟龄(年)×每日吸烟量(支)计数,阳性(≥400)38例,阴性(<400)9例;解剖分区:声门上区21例,声门区26例。
Hep2细胞为人喉癌细胞株,取于石家庄市第一医院科研中心,将Hep2细胞接种于含10%胎牛血清DMEM培养基(其中含青霉素、链霉素100 U/ml),置37℃,5%CO2环境培养,观察细胞长势2至3天更换培养液,3至5天传代1次。细胞融合度70%-80%时更换为无血清培养基12小时后分组备用。
1.2 试剂
免疫组化使用到的关键试剂: PI3K、HMGA1均为鼠抗人单克隆抗体(型号分别为20584-1-AP、Sc-8982);均为美国Santa Cruz Biotechnology 生产。SP-9002二抗免疫组化试剂盒以及ZLI-9032 DAB显色液生产厂家为北京中杉金桥生物公司。
RT-PCR 关键试剂:PI3K抑制剂wortmannin(9951s)购自美国Cell Signaling Technology Company,用于提取RNA的TRIzol为美国SBS Co.,ltd生产,RT-PCR 试剂盒生产厂家为美国Promega Co.,ltd,DNA Marker购自北京索来宝科技有限公司,PCR 引物: HMGA1上游引物为(5’→3’) CGGGGCCGACCAAAGGGAAG,下游引物为(5’→3’) CGGTGGGAGCGGAGCAAAGC。GAPDH内参:上游引物(5’→3’)AGGTGAAGGTCGGAGTCAACG,下游引物(5’→3’)AGGGGTCATTGATGGCAACA。均购自上海生工生物工程有限公司。
1.3 方法
免疫组化SP法:将收集组织标本制作蜡块并切片,经脱蜡、水化、抗原修复、除酶、血清封闭后孵育、冲洗、加一抗、再冲洗后滴加二抗、反复冲洗后滴加辣根酶工作液、再孵育冲洗后加DAB显色,后经复染、酚化、氨水返蓝,再次脱水、加二甲苯后封片观察;PBS液做对照实验。RT-PCR方法:将已培养人喉癌Hep2细胞随机分为A、B组,A组为实验组,将200 nmol/L wortmannin置细胞无血清培养液中共同培养24 h。B组为对照组,所选细胞置无血清培养液继续培养24 h;按时收取细胞,分别提取实验组与对照组中RNA,随后按逆转录试剂盒说明书要求,将所得产物逆转录成cDNA,在进行PCR扩增:95℃8分,95℃45秒, 66℃30秒,72℃25秒,共35次循环后,置72℃延伸7分钟。所得的产物放置2%琼脂糖凝胶进行电泳后观察并与Marker对照,HMGA1所获得的产物分别为229 bp,GAPDH是104 bp。
1.4 结果判定
免疫组化结果参照Fromowitz评分方法[6]:染色强度(intensity,I)分类,其中无染色为0级,弱染色(浅黄)为1级,中染色(棕黄)定为2级,强染色(棕褐) 定为3级;阳性细胞百分率(percentage,P)分级,阳性细胞P<5%为0级; 5%≤P<25%为1级,25%≤P<50%为2级,P≥50%为3级。组织学评分(histologiescore,H)=I×P。若同一标本不同区域存在差别,则取均值评分。当分值为0至3分记阴性,为低表达;分值为4至6分记阳性,为中度表达;分值为7至9分记强阳性,为高表达。RT-PCR结果应用Gel work-2ID软件分析光亮度值,相对表达量为两目的基因条带光密度值与对应GAPDH光密度值的比值。
1.5 统计方法

2 结果
2.1 免疫组化结果
PI3K蛋白阳性染色相对较深,呈棕褐色,以细胞质为主,少量分布在细胞核(图1)。在LSCC组织中阳性率70.2%(33/47),癌旁组织中,阳性率 33.3%(7/21)。表明PI3K基因在LSCC组织中的阳性表达率高于癌旁组织,差异有统计学意义(χ2=8.150,P<0.05)(参见表1)。HMGA1蛋白表达对应的颜色为棕色,散在分布于细胞质以及细胞核当中(图2)。在癌组织当中,阳性率53.2%(25/47),在癌旁组织当中,阳性率23.8%(5/21)。组间存在显著差异,具有统计学意义(χ2=5.083,P<0.05)(表1)。

图1 PI3K基因在癌旁正常组织及LSCC组织中表达

图2 HMGA1基因在癌旁正常组织及LSCC组织中表达
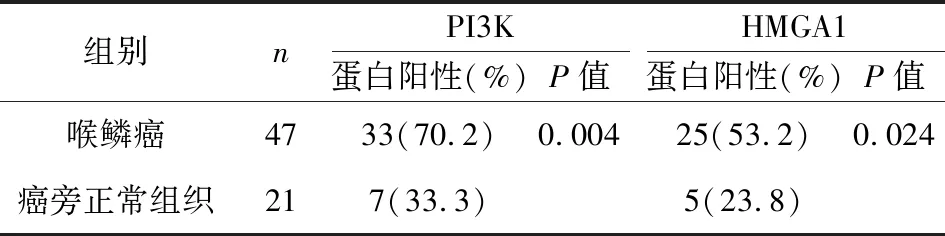
表1 LSCC及癌旁正常组织中PI3K、HMGA1蛋白表达
2.2 RT-PCR 检测结果
在人喉癌Hep2细胞中分别检测加用PI3K抑制剂的实验组及不加抑制剂的对照组中HMGA1 mRNA水平表达(图3),表达量实验组为(0.59±0.27);对照组为(0.18±0.17),实验组与对照组对比差异有显著统计学意义(P<0.01) (表2)。

图3 RT-PCR检测实验组与对照组中HMGA1mRNA水平表达电泳图像,其中单数(1、3、5、7)为实验组电泳图,双数(2、4、6、8)为对照组电泳图
2.3 LSCC组织中HMGA1基因蛋白表达在多个临床病理参数组内对比情况(表3)
临床分期组内对比分析差异有显著统计学意义(P<0.05),另外淋巴结转移及吸烟组内对比分析差异有统计学意义(P<0.01);但年龄、病理分级、解剖分区组内对比,差异无统计学意义(P>0.05)。
3 讨论
磷脂酰肌醇3激酶为脂质激酶家族中的一类,其通过在细胞内传递级联信号调控多种生物过程。在癌组织中PI3K可通过多种机制被激活,PI3KCA基因编码p110α亚基自身突变,激活的受体酪氨酸激酶如EGFR、HER2和PDGFR参与PI3K通路,直接与RAS通路结合互相活化,PTEN(一种与PI3K功能相反,并能降解PI3K产物的激酶)磷酸化失活等。因此推测PI3K信号通路为癌症发生和发展的关键核心通路之一[7]。HMGA1为一种癌胚基因,高表达于组织胚胎时期,沉默于不再发育的成年细胞中,但多种恶性肿瘤中表达再次活跃。此基因为一种结构转录因子,能重组染色质结构,促进不同组织中转录调控蛋白和DNA之间相互作用,诱导细胞增殖、侵袭、凋亡抑制等行为,并能够参与EGFR、Hippo、Ras/ERK、Akt等多个通路激活促进细胞恶性转化[8]。

表2 实验组与对照组中HMGA1 mRNA的表达

表3 LSCC中HMGA1蛋白表达与各临床病理参数的关系
本实验发现在LSCC组织中PI3K、HMGA1蛋白水平表达相比癌旁组织均明显升高,经对比分析,差异存在统计学意义。提示PI3K、HMGA1在肿瘤的发生过程中发挥一定作用。Liu等[9]发现上皮-间质转化(EMT)在卵巢癌中普遍存在。EMT是肿瘤侵袭和转移的早期事件,钙相关信号通路PI3K/Akt激活是癌症进行过程中EMT发挥作用的关键步骤,而瞬时受体电位离子通道(TRPM7)对二价阳离子有高度渗透性,可提高如钙离子、镁离子水平。由此推测TRPM7可通过调节钙离子水平激活PI3K/Akt信号通路,导致卵巢癌侵袭和转移增加。Md.Zahid Akhter等[10]应用抗癌药物ADM(阿霉素)处理的实验细胞,c-myc mRNA表达水平呈时间依赖性下调,进一步证实ADM处理的宫颈癌HeLa细胞系中HMGA1蛋白和mRNA水平表达下降,提示HMGA1过表达与细胞恶变、癌症进展有关。
Jing Zhong等[11]在进行甲状腺癌细胞中TGF-β1对HMGA1表达影响的实验中,发现应用RNA isolation和RT-PCR方法检测PI3K/Akt通路抑制剂(wortmannin)处理的甲状腺癌SW579细胞中HMGA1转录降低,免疫荧光染色方法对比分析显示PI3K/Akt通路(wortmannin)可阻止TGF-β1诱导的HMGA1表达增强,由此可推测甲状腺癌SW579细胞中TGF-β1通过刺激PI3K/Akt通路活化诱导HMGA1表达,进而促进癌细胞侵袭和转移。Liau等[12]将PIRES-HMGA1质粒转染的胰腺导管癌MiaPaCa2细胞与不同浓度的PI3K抑制剂组合行软琼脂实验,结果显示:加入PI3K抑制剂后,与未转染的空白pIRES-puro3对照组相比,实验组中,接受转染的MiaPaCa2细胞复制水平显著降低。表明PI3K可调控HMGA1促进肿瘤发生。这些结论均与本实验研究结果“应用PI3K通路抑制剂后检测喉癌细胞HMGA1mRAN表达量明显减少”一致。
LSCC组织中HMGA1在表达蛋白水平:淋巴结转移(N+组与N0组对比组间的差异有显著统计学意义)、临床分期(Ⅰ、Ⅱ期与Ⅲ、Ⅳ期分组组间对比差异有统计学意义),吸烟(阳性组与阴性组对比组间的差异有显著统计学意义)。而病理分级组内对比差异无统计学意义。Mendez等[13]针对乳腺癌分子机制研究时发现三阴乳腺癌(TNBC)细胞中HMGA1过表达,并且HMGA1从细胞核向细胞质定位的改变预示着TNBC原发性肿瘤的侵袭性增强。应用HMGA1阻断抗体后,体外实验中TNBC肿瘤的侵袭性减弱,免疫实验中癌细胞的转移率降低。实验结论强烈建议将HMGA1作为预测TNBC远处转移的生物标志物。另外Qin[14]研究发现相比永生化的人类泌尿上皮细胞系SV-HUC-1,膀胱癌细胞株T24和5637中表达低水平的let-7i和高水平的HMGA1,应用let-7i质粒转染的T24和5637细胞系中,检测HMGA1蛋白和mRNA表达水平明显下调,并表现出细胞增殖和迁移明显降低。结果表明:以抑制HMGA1靶基因表达为目的,上调let-7i,可减弱人类膀胱癌细胞株T24和5637的增殖和迁移。综合以上两篇文献正反方面研究,结合本实验结果可推断HMGA1在促进喉鳞癌浸润、转移中发挥作用。本实验结果:吸烟(阳性组高于阴性组),差异有显著统计学意义。提示HMGA1在吸烟促进喉癌发生中起到一定作用。相关文献为Credico等[15]对汇总了国际头颈癌流行病学联盟(INHANCE)的18260例头颈恶性肿瘤(包括喉癌)和29844例对照病例行33项病例对照研究,评估吸烟强度、吸烟时间和头颈癌之间的量效关系,结果表明:吸烟与喉癌风险之间在剂量-反应和时间-反应上的显著正相关性。结合本研究结果目前认为喉癌的主要危险因素是吸烟,吸烟与喉癌发生关系更为密切一致。
人们在研究肿瘤的致病因素过程中逐渐意识到PI3K、HMGA1这两种基因的重要性。本次研究结果显示,PI3K以及HMGA1在喉鳞癌组织当中的基因发生了明显的表达升高,并且它们之间的激活也呈现出正相关性,表明此两种基因能够利用类似的方法并相互影响对喉鳞状细胞癌发生、发展产生一定促进作用,对PI3K、HMGA1表达水平的检测可以为喉癌的诊断、进展及预后提供重要参考价值,同时也可为基因靶向治疗提供可参考靶点。

