sPD-L1在肺癌患者血清及胸膜腔积液中水平差异及相关性分析
赵 爽,熊 芳
(重庆三峡中心医院 1.健康管理中心;2.重症医学科,重庆404000)
非小细胞肺癌(NSCLC)是常见的恶性肺部肿瘤病变,其主要病理类型类为腺癌和鳞癌,由于缺乏有效的早期检查手段,确诊时78%-80%患者已属晚期,临床晚期NSCLC患者约80%伴有恶性胸膜腔积液[1]。目前,针对程序性细胞死亡配体1(programmed cell death legend1,PD-L1)/程序性细胞死亡受体1(programmed cell death-1,PD-1)的治疗已成为肺癌治疗的重要研究方向[2,3]。PD-1/PD-L1通路是机体免疫检查点之一,其生理作用是维持机体的免疫耐受和避免过度的免疫反应对正常组织造成损害。然而肿瘤细胞可利用PD-1/ PD-L1通路产生抑制性的肿瘤微环境获得免疫逃逸[4]。肿瘤细胞产生的PD-L1包括膜表达型(mPD-L1)和可溶型(sPD-L1)。mPD-L1常在细胞和组织中被检测到,而sPD-L1则可通过病人的外周血液和体腔积液被检测。已有研究显示肺癌病人外周血液中的sPD-L1和胸腔积液中的sPD-L1水平均升高,且对患者预后和对免疫治疗的反应性具有指示作用[5,6]。但不同病理类型的肺癌发病的机制和肿瘤细胞生物学行为不同,提示患者体内sPD-L1分布可能不同,为了进一步确证不同病理类型肺癌患者体内的sPD-L1表达特征,以便后续研究更准确的探索其临床价值,我们在分析了64例伴随胸腔积液的肺癌患者的临床资料的基础上,分别检测患者外周血液和胸腔积液中sPD-L1水平,并进行相关性分析。
1 材料与方法
1.1 材料
1.1.1研究对象 收集2016年12月至2018年5月在我院重症医学科收治的64例肺癌病人的血液标本和胸膜腔积液标本,所有患者均经病理学检查明确诊断为NSCLC(肺腺癌或鳞癌),所有患者均有详细的病历资料,包括:性别、年龄、吸烟情况、肿瘤大小、TNM分期、远处转移情况、病理类型等。入选患者中男性47例,女性17例,年龄35-83岁,肺腺癌38例、肺鳞癌26例,根据第八版肺癌TNM分期Ⅰ期3例, Ⅱ期7例,Ⅲ期20例,Ⅳ期34例。本研究经我院伦理委员会同意并得到批准,所有入组患者均签署知情同意书。
1.1.2研究主要试剂和设备 人细胞程序性死亡蛋白1配体1(PDCD1LG1)ELISA检测试剂盒:USCN000518,美国;酶标仪:Bio-Rad美国。
1.2 方法
1.2.1标本采集 采集病人外周血3 ml并置于抗凝管中,1 000×g 离心10 min后取上层液体分装后置于-80℃冰箱中冷冻保存。行胸腔穿刺术抽取病人胸腔积液30 ml,在低温离心机中以1 000×g离心10 min后收集上清并分装保存于-80 ℃冰箱内,用于测定sPD-L1水平。
1.2.2sPD-L1的检测 采用ELISA法检测外周血和胸腔积液sPD-L1水平,操作步骤根据“人细胞程序性死亡蛋白1配体1(PDCD1LG1)ELISA检测试剂盒”说明书进行,简要步骤如下:首先吸去酶标板内的液体;清洗液洗涤3次后分别加入样品或标准品100 μl,1孔只加稀释液作为对照;37℃反应90 min后用弃去酶标板内的液体;清洗液洗涤2次后加入生物素化人ANG抗体工作液各100 μl,37℃反应60 min;清洗液清洗3次后各加入100 μl ABC工作液,37℃反应30 min;清洗液洗涤5次,加入显色液轻微震荡混匀,避光孵育20 min,每孔加入100 μl终止液终止反应,并在30 min之内使用酶标仪在450 nm波长下测量各孔的吸光度值,根据吸光度值计算外周血和胸腔积液sPD-L1的水平。
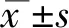
2 结果
2.1 外周血及胸腔积液sPD-L1水平与临床病理因素的关系
病人年龄多数大于60岁( 68.8%),且多为男性(73.4%),约77%的患者有吸烟史;肿瘤病灶最长径之和大于7 cm者38例,占59.4%;根据第七版肺癌TNM分期,Ⅰ/Ⅱ期共10例,Ⅲ/Ⅳ期共54例;48例患者确诊时已发生淋巴结转移。进一步分析sPD-L1水平与临床病理因素间关系发现,患者年龄、性别、吸烟状况与sPD-L1水平均无关系(P>0.05),而在肿瘤大小、TNM分期、是否有淋巴结转移间差异有统计学意义(P<0.01),肿瘤>7 cm者胸膜腔积液内sPD-L1水平较肿瘤≤7 cm者高,Ⅲ/Ⅳ期及有淋巴结转移的患者胸腔积液和外周血中sPD-L1水平均较高。 见表1。
2.2 肺腺癌、肺鳞癌患者外周血和胸腔积液中sPD-L1水平的比较
肺腺癌中外周血sPD-L1水平为(1.71±0.13)ng/mL,胸腔积液中sPD-L1水平为 (1.26±0.11)ng/mL;肺鳞癌中外周血sPD-L1水平为(1.86±0.30)ng/mL,胸腔积液中sPD-L1水平为(0.89±0.14)ng/mL。无论肺腺癌或肺鳞癌,外周血中sPD-L1均高于胸腔积液中sPD-L1水平(P<0.05)。见表2。
2.3 患者外周血和胸腔积液中sPD-L1水平的相关性分析
分析患者外周血和胸膜腔积液中sPD-L1水平的相关性,发现肺腺癌患者外周血和胸腔积液中sPD-L1水平存在相关性(P<0.01,r=0.63),而肺鳞癌患者外周血sPD-L1水平和胸腔积液中sPD-L1水平不相关(P>0.05,r=0.12)。见图1。
表1 肺癌患者外周血和胸腔积液sPD-L1水平与临床病理因素的关系

表2 64例肺癌患者外周血和胸腔积液中sPD-L1水平

图1 肺腺癌和肺鳞癌患者外周血sPD-L1水平和胸腔积液中sPD-L1水平的相关性
3 讨论
阻断PD-1/PD-L1通路使肺癌的治疗迈入了一个新的台阶。多项试验表明,免疫检查点抑制剂在PD-L1高表达的肺癌患者中疗效更显著[7]。但目前对患者体内PD-L1表达水平仍缺乏准确统一的检测和分析方法,临床上使用的仍为传统的免疫组织化学法,但现有研究表明同一患者在不同的抗体、不同的检测平台、不同的判读标准下所检测出的PD-L1表达水平存在差异[8],故而探寻更为科学有效的PD-L1表达情况检测方法是目前临床肺癌治疗及检验学科亟需解决的命题。机体免疫系统中PD-L1分别以细胞膜型和可溶性分子两种形式存在,且sPD-L1的含量与mPD-L1的表达强度相关,二者具有相似的生物学功能,均能在抗肿瘤免疫中起负调控作用[9]。提示sPD-L1可能作为肺癌诊断、治疗监测及判断预后的一个良好指标,且sPD-L1可在体液中被检测,取材方便,因此,深入研究sPD-L1在肿瘤患者体内的表达情况有望成为提高PD-L1检测水平、方便PD-1/PD-L1高表达患者的治疗监测及判断预后的有效方法,最终服务于肿瘤患者接受更精准的治疗。
本研究在不同病理类型肺癌中分析患者血清及胸膜腔积液中sPD-L1的表达水平及差异,结果显示虽然肺腺癌及肺鳞癌外周血中sPD-L1均高于胸腔积液中sPD-L1水平,但肺鳞癌患者外周血内sPD-L1水平高于肺腺癌患者,而胸膜腔积液内sPD-L1水平却是肺腺癌患者高于肺鳞癌,说明不同病理类型的NSCLC患者体液内sPD-L1的分布存在差异。提示不同病理类型的肿瘤检测sPD-L1的标本来源或参考基线值应该不同。分别对肺腺癌和肺鳞癌患者外周血和胸腔积液中sPD-L1水平行相关性分析,结果显示仅肺腺癌患者外周血和胸腔积液中sPD-L1含量存在相关性,提示肺腺癌患者的胸膜腔积液中sPD-L1水平对患者肿瘤组织中PD-1/PD-L1表达具有更重要的提示作用。目前,已经有研究者发现肿瘤患者的血液循环内的sPD-L1来自肿瘤细胞分泌的外泌体[10],故而不同病理类型患者体内sPD-L1水平分布不同可能与肿瘤细胞自身的生物学功能相关,其中更深层次的原因还有待进一步研究。
总而言之,目前因缺乏统一有效的检测和分析方法,加大了国内外学者研究sPD-L1在肿瘤发生发展过程中的作用的难度。但其作为一个重要的PD-1/PD-L1通路相关分子,有必要对其进行深入研究。作为阻断PD-1/PD-L1通路治疗的重要受益者,肺癌患者尤其是不同病理类型的肺癌患者体内sPD-L1表达特征及水平差异,或提示不同病理类型的肿瘤患者其PD-1/PD-L1表达水平的检测方法或可不同。

