一株猪粪降解菌的筛选、评价及鉴定
俞洁雅,倪梦萍,丁良长,胡洲铭,肖建中,郑 强,*
(丽水学院 a. 教师教育学院; b. 生态学院,浙江 丽水 323000)
我国是禽畜养殖大国,畜牧业已成为我国农业经济的支柱产业。同时,畜禽养殖过程中产生的大量粪便对环境造成的严重污染引发社会的广泛关注,是我国畜牧业可持续发展中迫切需要解决的重大问题[1]。根据《第一次全国污染源普查公报》显示,畜禽粪便中化学需氧量(chemical oxygen demand,COD)、总氮、总磷的产生量分别为1 268万t、106万t和16万t,分别占农业污染源产生量的96%、38%、65%[2],畜禽粪便的无害化处理迫在眉睫。
常用的禽畜粪便处理方法包括化学处理法、物理处理法与微生物发酵法等[3]。化学处理法对猪粪的除臭与分解效率高,但设备运行及维护成本高昂[4];物理处理法存在前期投入成本巨大、处理效率较低、易造成二次污染等缺点[5]。微生物发酵法是利用土壤中微生物或添加的外源微生物的作用,将畜禽粪便中复杂的、不稳定的物质转化成简单、稳定的有机质,同时释放出速效养分供作物利用的方法,尤其是基于微生物发酵床的处理模式,具有高效、清洁、安全、维护方便及运行成本低廉等优点[6-7]。微生物发酵床是以谷壳、秸秆、锯糠、椰糠等农业副产品作为垫料层,禽畜养殖于其上,垫料与猪粪尿等排泄物混合后经微生物发酵,从而消纳粪便、去除异味,实现无害化养殖的新型环保养猪技术[8]。微生物发酵床垫料中的微生物消纳处理畜禽粪便,细菌在降解过程中起重要作用。目前常用的发酵菌剂主要源于进口[9],其使用成本高;国内自主培育的菌剂商品化程度不高,且普遍表现出除臭不彻底、猪粪腐熟缓慢等缺点,从而导致发酵床的处理容量低、周期长、难以实现零污染排放[10]。
本研究采用氨选择培养基从土壤中筛选出能够利用氨作为唯一氮源的菌株,通过监测猪粪发酵过程中NH3与H2S的释放量对其实际除臭效果进行评价,并采用种子发芽指数评价筛选菌株对促进猪粪堆肥腐熟的效果。
1 材料与方法
1.1 材料
1.1.1 样品来源
土壤样品采自浙江省丽水市莲都区白云山森林公园,选择落叶覆盖的富含腐殖质的土样。猪粪采自丽水某规模化养猪场,自然风干。
1.1.2 培养基
参考文献[11-13],配制以下培养基。牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂16.0 g,蒸馏水1 000 mL。NH3选择性液体培养基:蔗糖50.0 g,氨水10.0 mL,KH2PO42.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.1 g,1% ZnSO45.0 mL,NaCl 2 g,蒸馏水1 000 mL。NH3选择性复筛液体培养基:葡萄糖5.0 g,NaCl 1.0 g,(NH4)2SO40.6 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.05 g,蒸馏水1 000 mL。沙氏液体培养基(培养真菌):蛋白胨10 g,葡萄糖40 g,蒸馏水1 000 mL。马丁氏培养基(保存真菌):孟加拉红粉末36 g,蒸馏水1 000 mL。高氏培养基(分离、保存放线菌):可溶性淀粉20.0 g,KNO31.0 g,NaCl 0.5 g,K2HPO40.5 g,MgSO40.5 g,FeSO40.01g,蒸馏水1 000 mL。
1.1.3 主要试剂
DNS试剂购自青岛捷世康生物科技有限公司,对氨基二甲基苯胺盐酸盐购自淮南市科迪化工科技有限公司,其他试剂购自国药集团上海化学试剂有限公司。
1.2 方法
1.2.1 菌株分离
在超净工作台中称取10 g土壤样品,放入盛有90 mL无菌水的锥形瓶中,室温下150 r·min-1摇床振荡30 min,然后静置20 min,制得10-1的土壤悬液。取土壤悬液进行梯度稀释,依次制成10-2、10-3、10-4、10-5和10-6等不同稀释倍数的土壤悬液。吸取各土壤悬液200 μL分别涂布于高氏1号固体培养基、牛肉膏蛋白胨琼脂培养基和沙氏琼脂培养基上,30 ℃培养72 h,观察细菌形态,选择形态不同且长势优良的菌落进行分离纯化。
1.2.2 除氨微生物的筛选
将分离的菌种接入NH3选择性液体培养基进行初筛,摇床培养,若菌液浑浊则说明该菌种能利用NH3,反之则不能。将初筛得到的菌种摇瓶培养,制备菌悬液,按10%的接种量接入含有100 mL NH3选择性复筛液体培养基的大试管中,加入1 mL质量浓度为0.898 g·mL-1的浓氨水,大试管内悬挂一个装有10 mL的1%硼酸的小容器吸收氨气,对照组(NC)加入等量无菌水。将大试管置于30 ℃培养箱中恒温培养7 d后检测硼酸吸收液中的NH3含量及大试管中残留的NH3含量。每个处理3个重复,结果取3个重复的平均值。根据以下公式计算氨氮降解率:
氨氮降解率(%)=(初始氨氮含量-残余氨氮含量)÷初始氨氮含量×100%。
1.2.3 猪粪NH3与H2S释放量测定
将筛选到的菌株接入装有400 g新鲜猪粪的大烧杯中,猪粪表面放入一只装有20 mL 2%硼酸的小烧杯,用于吸收释放的NH3。对照组(NC)不接种菌株。用保鲜膜将杯口密封,置于50 ℃恒温培养箱培养。NH3释放量按照凯氏滴定法[14]进行测定。进行H2S释放量测定,小烧杯中放入20 mL的锌胺络盐溶液,按照锌胺络盐吸收比色法[15]测定H2S释放量。
1.2.4 种子发芽试验
称取10 g接菌发酵后的猪粪,加入90 mL蒸馏水搅拌均匀,200 r·min-1摇床振荡30 min,经纱布过滤后,3 000 r·min-1离心10 min,收集上清液,取15 mL上清液倒入底部铺垫滤纸的培养皿中,均匀放入20粒花菜种子。样品置于20 ℃、黑暗条件下培养48 h后,测定花菜种子发芽率和根长,同时用未接菌猪粪滤液作阳性对照,蒸馏水作阴性对照[16-17]。种子发芽指数(germination index,GI)计算公式为:
GI(%)=(处理种子发芽率×处理种子根长)/(对照平均发芽率×对照种子根长)×100%。
1.2.5 分离株鉴定
分离株形态观察和生理生化特性测定按《一般细菌常规鉴定方法》和《常见细菌系统鉴定手册》进行。参考GB20287—2006《农用微生物菌剂》和QB/T 1803—1993《工业酶制剂通用试验方法》对分离菌株进行鉴定,蛋白酶活力和α-淀粉酶活力采用紫外分光光度法测定,糖化酶活力采用硫代硫酸钠标准溶液滴定法测定,脂肪酶活力采用酸碱滴定法测定,纤维素酶活力按照DNS法测定。
提取分离株DNA,利用通用引物扩增菌株16S rDNA,PCR扩增产物用1.5%琼脂糖电泳进行检测,并送至上海生工生物工程有限公司测序。根据测序结果,使用Blast搜索程序与NCBI数据库中已有序列进行BLAST同源检索,从而在分子水平上对菌株进行种属鉴定。
2 结果与分析
2.1 除NH3微生物初筛
利用NH3选择性培养基共筛选到菌株49株,其中细菌(X)13株、真菌(Z)18株、放线菌(F)18株,NH3降解率33.8%~74.1%(图1)。研究发现,X3、X7、Z6、Z10、Z16、F6和F18对NH3的降解率分别为72.0%、74.1%、70.9%、72.4%、71.2%、70.7%和74.0%。由于NH3选择性培养基以NH3作为唯一氮源,因此上述7株菌理论上具有消化氨氮、减少猪粪发酵过程中NH3释放的功能。
2.2 除NH3微生物复筛
将7株菌分别接种至含水量约为50%的猪粪中,培养2周后,测定氨气累积释放量(图2)。如图所示,与不接菌对照组(NC)相比,7株菌接种处理后猪粪NH3释放量均下降,Z10接种猪粪后NH3释放量下降最多,释放量为35.66 mg·kg-1。
2.3 Z10菌株除臭效果评价
猪粪臭气源主要成分是NH3和H2S,对Z10菌株除臭效果评价见图3。如图所示,处理21 d内,Z10处理组NH3和H2S累计排放量均低于对照组。处理21 d后,对照组NH3和H2S累计排放量分别为131.57、4.45 mg·kg-1,Z10处理组NH3和H2S累计排放量分别为80.71、2.22 mg·kg-1,较对照组显著降低。

图1 分离菌株NH3降解率Fig.1 Degradation rate of NH3 in isolated strains
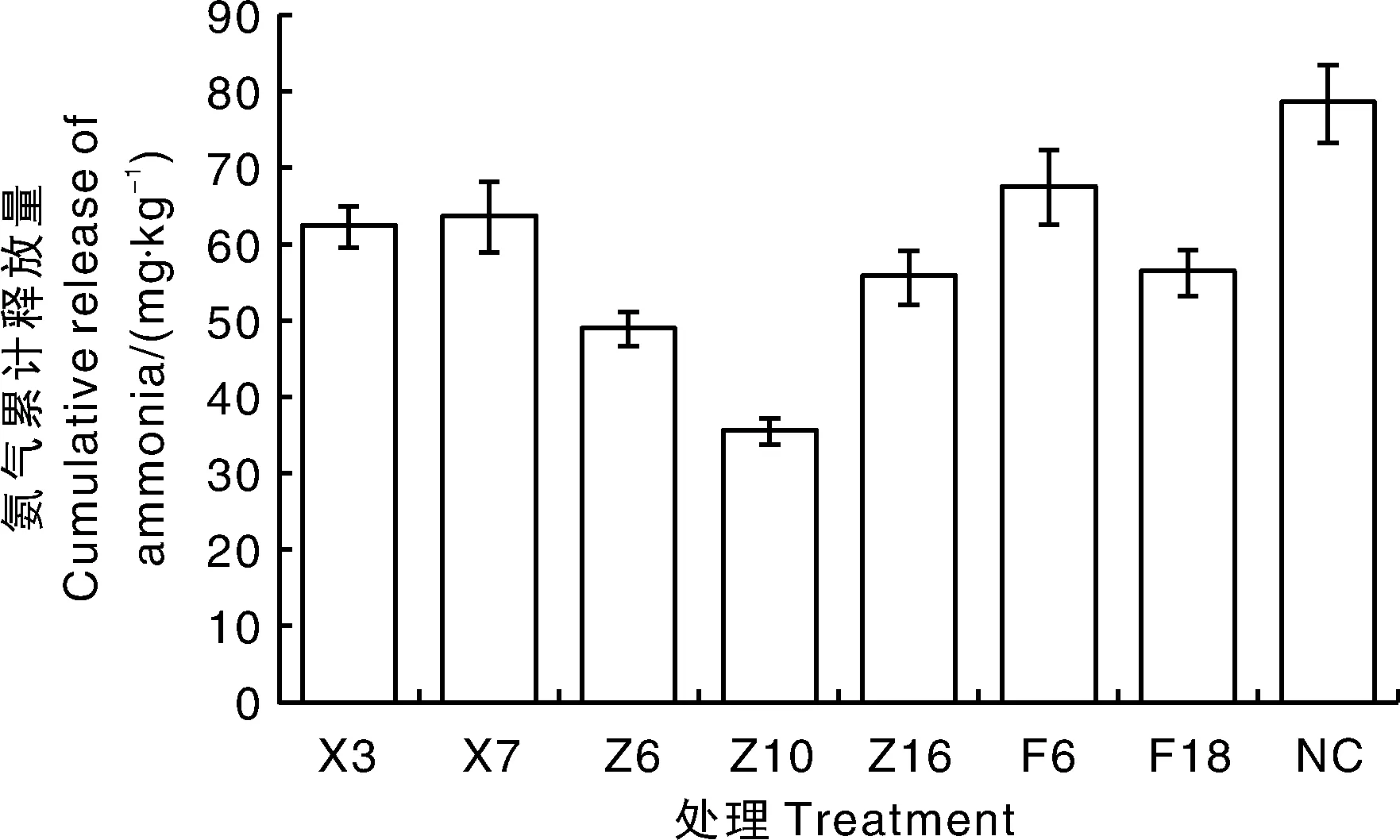
图2 氨气累积释放量Fig.2 Cumulative release of ammonia

图3 Z10菌株除臭效果评价Fig.3 Evaluation of deodorant effect of Z10
2.4 种子发芽试验
种子发芽指数是目前评价堆肥腐熟度及植物毒性的最可靠的指标[16]。从图4可知,猪粪未接菌处理的对照组发芽率与发芽指数分别为68.35%、59.12%,说明不接菌发酵时,21 d发酵无法达到腐熟、无害化的要求,植物毒性较大,对种子发芽率有较大的抑制。Z10组发芽率与发芽指数分别为83.33%、88.55%,由于发芽率超过80%可认为猪粪对种子基本无毒害,可见Z10菌株接种处理对猪粪腐熟及无害化具有显著的促进作用。
2.5 分离株生化性质及鉴定
为了进一步揭示Z10菌株降解猪粪的生化性质,分别测定了其蛋白酶、α-淀粉酶、糖化酶和纤维素酶的活力。研究发现,3种蛋白酶活性未检测到,α-淀粉酶、脂肪酶、糖化酶和纤维素酶活性分别为3.902、19.261、27.062、232.543 U·mL-1。由此可知,Z10菌株的猪粪分解能力主要基于其较强的纤维素酶活性,淀粉酶、脂肪酶、糖化酶活性可能发挥了一定程度的作用。通过BLAST搜索,将Z10菌株与NCBI数据中收录的同源性较高的菌株进行同源性比对,同源菌株名称及GenBank注册号见表1。分子鉴定结果显示,Z10菌株为烟曲霉菌(Aspergillusfumigatus)。

图4 种子发芽试验Fig.4 Seed germination experiment
表1 同源菌株比对
Table 1 Homologous strain alignment

菌株名称Name同源性 homology/%注册号GenBankNo.Aspergillus fumigatus strain MS13.1100MK329206.1Aspergillus fumigatus isolate RS_20100MK267099.1Aspergillus fumigatus strain TZT-18-24100MH919847.1Aspergillus fumigatus strain MF22509100MH911420.1Aspergillus fumigatus strain MF22415100MH911416.1Aspergillus fumigatus strain MF22480100MH911400.1Aspergillus fumigatus strain MF22397100MH911397.1Aspergillus fumigatus strain MF22500100MH911384.1Aspergillus fumigatus strain MF22502100MH911377.1Aspergillus fumigatus strain MF22449100MH911361.1
3 讨论
微生物发酵床具有降解粪污的作用,其中的微生物起到能量转化的作用,将粪污转化为无植物毒性的有机养分[18]。添加的菌株必须在猪粪除臭与促进猪粪腐熟两个方面发挥作用,这样才可能真正做到低排放及保证发酵床的粪污消纳量。
本研究利用NH3选择性培养基,从土壤中筛选能够利用氨作为唯一氮源的微生物,获得的菌株具有一定的转化猪粪中氨氮从而降低氨气释放量的潜力。由于猪粪中有机氮转化过程较为复杂,涉及铵态氮与硝态氮等不同氨氮类型,同时还有氨氧化细菌、硝化细菌及反硝化细菌等其他不同类型菌株参与[19],菌株对培养基中无机氮的利用能力与对猪粪中有机氮的吸收转化能力之间的相关性并非线性,因此在实际应用中,培养基筛选出的X7与F18菌株除臭效果低于Z10。
NH3与H2S是猪粪恶臭气味的主要来源,是猪粪中含氮化合物及含硫化合物在厌氧条件下由杂菌作用产生[20]。通过监测猪粪发酵过程中NH3与H2S的释放量可真实地评估猪粪发酵菌株的除臭效果。不同的猪粪发酵菌株对NH3与H2S的抑制效果差异显著。许启有等[21]筛选的短杆菌株、副球菌株对NH3与H2S的去除率分别为46.6%、6.8%与5.6%、54.4%;陈丽园等[22]筛选的菌株使猪粪NH3和H2S的释放量降低67.95%和26.6%,其抑制NH3释放的效果较明显,但对H2S的作用效果不佳。张生伟[10]筛选的菌株BX3对NH3与H2S的去除率分别达到80.07%和76.92%,对两者的抑制效果都很显著。本研究中,筛选的Z10菌株使猪粪NH3与H2S的释放量分别降低38.66%与50.03%。
粪便发酵过程受到有机物含量、碳氮比、水分含量和氧气供给量等多种因素的影响,添加的外源微生物接种剂对发酵有良好的促进效果。研究发现,畜禽粪便发酵后,GI值达到50%时,发酵粪便的植物毒性较弱,当GI值超过80%时,发酵粪便的植物毒性基本消除[23]。本研究中,Z10菌株处理猪粪后,种子发芽率与发芽指数与不接菌的阴性对照相比都有了较为显著的提高,说明添加的Z10菌株能够加速猪粪中植物毒性物质的分解与转化,加快猪粪的腐熟与无害化进程;Z10组GI值甚至高于阳性对照,推测微生物分解有机物质过程中产生了一些生理活性物质,刺激了胚根的生长。
本研究中筛选得到的Z10菌株最终鉴定为烟曲霉菌(Aspergillusfumigatus)。Z10菌株具有极强的纤维素酶活力,可有效降解猪粪中的粗纤维,加速猪粪腐熟作用,抑制NH3与H2S的释放。烟曲霉菌是自然界广泛存在的一种真菌,目前尚未发现国内外关于烟曲霉菌用于猪粪发酵的相关报道,烟曲霉对猪粪的除臭及促腐熟效果的评价也较少。研究发现,烟曲霉分泌的烟曲霉素对多种病原微生物具有较好的防治作用,可广泛应用于水产、养殖领域[25],推测烟曲霉菌在猪粪发酵过程中分泌的烟曲霉素对某些产生臭味物质杂菌的滋生起到一定的抑制作用,从而减少了臭气的释放。该菌株可能为开发新型的猪粪发酵复合菌剂提供备选菌株。然而,目前鲜有分泌抗生素的菌株用于发酵床的安全性评估研究。因此,该菌株是否能真正应用于发酵床,以及如何进行相应的安全性评价有待进一步研究。

