ERLIN2蛋白高表达与结肠腺癌患者不良预后的相关性
李 冰,陈 靖,于素香,闫江鹤,朱凤池
(1.保定市第四中心医院 肛肠外科,河北 保定 072350;2.天津市肿瘤医院 胰腺肿瘤科,天津 300060;3.保定市第四中心医院病理科,河北 保定 072350;4.保定市第二医院肛肠外科,河北 保定 071000)
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤, 对人类的健康和生命构成了严重威胁.早期结肠癌患者通常能够通过手术治愈,而晚期患者通常需要手术、放疗等多种方式联合治疗[1-2].原发性局部晚期肠癌经过根治性切除后,仍有11%的病人会出现复发和转移[3-5].因此,寻找新型的预后因子对于提高临床医生的诊断及预测预后水平十分重要[6].
ERLIN2 属于拥有共同的进化保守结构域SPFH(stomatin/prohibitin/flotillin/HflK/C)的家族蛋白成员之一.虽然包含的SPFH 蛋白位于不同的膜结构上,但是拥有共同特点,如这些蛋白的氮端序列为亚细胞定位和膜附着过程所必需,碳端序列上的卷曲螺旋结构域可介导高分子量复合体的装配[7].Zhang 等[8]研究发现,ERLIN2 在人乳腺癌组织中异常高表达, 参与调节人乳腺癌相关的细胞周期进程.Cubillos-Ruiz 等[9]通过敲低和过表达ERLIN2 研究其在乳腺癌发生过程中的生物学行为,结果显示,ERLIN2 通过促进肿瘤发生相关的细胞压力下的保护作用,给予乳腺癌细胞选择性生长优势.Giulietti 等[10]认为,与内质网相关的ERLIN2可能会成为新型的区分胰腺导管腺癌高危和低危患者的生物标记物.
本研究通过免疫组化染色分析ERLIN2 在结肠腺癌样本中的表达水平, 结合临床数据分析ERLIN2 在结肠腺癌患者中的临床意义.在体外水平利用shRNA稳定敲低ERLIN2 在结肠癌细胞系中的表达水平,通过MTT、克隆形成以及Western Blot 实验检测ERLIN2与结肠癌细胞系增殖的关系,以期为探究ERLIN2 与结肠腺癌发生和转移的关系提供实验依据.
1 材料与方法
1.1 实验材料
1.1.1 主要仪器与试剂
RM2235 通用型石蜡切片机,日本Leica 公司;光学显微镜,日本Olympus 公司.
ERLIN2(ab233440)、 Ki67(ab16667) 和 PCNA(ab92552),美国 Abcam 公司;β-Actin(BM0627),武汉博士德生物工程有限公司;通用型二抗PV6000,北京中杉金桥生物技术有限公司;DAB(DA1010)、苏木精(G1120)和 MTT(M1025),北京索莱宝科技有限公司.
结肠癌细胞系HCT116 和HT29,购自中国科学院细胞培养库, 使用体积分数为10%的胎牛血清混合RPMI-1640 培养基在37 ℃下进行培养.
1.1.2 临床资料
收集河北省保定市第四中心医院和保定市第二医院肛肠外科2012 年1 月至2018 年12 月接受结肠癌根治性切除术治疗的患者82 例,所有患者均无术前放射治疗和化疗史,所有标本经H&E 染色后,经过病理科证实为结肠腺癌.患者临床数据(年龄、性别、肿瘤T 分期、分化水平、临床分期和淋巴结转移)通过查阅病案科病历资料获得.以上过程均遵照本院伦理委员会发布的伦理学规范,患者本人及家属均签署了知情同意书.
1.2 方法
1.2.1 免疫组化染色及评分方法
利用免疫组化染色法评估ERLIN2 在结肠癌组织中的表达情况.将石蜡包埋标本切成5 μm 切片,室温晾干,75 ℃下充分脱蜡1 h, 二甲苯浸泡20 min.脱蜡完全后,梯度浓度酒精(体积分数依次为100%、95%、85%、75%)进行水化.将切片浸泡在枸橼酸盐溶液中,高火煮沸进行抗原修复.滴加过氧化物酶阻断剂充分阻断过氧化物酶的作用, 继续滴加抗ERLIN2 抗体(稀释比例 1 ∶500),4 ℃下孵育过夜.次日, 滴加二抗常温孵育1 h,滴加DAB 显色,之后用苏木素染色.脱水透明处理后, 中性树胶封片.显微镜下观察组织着色部位以及着色强度.
根据阳性细胞所占比例与染色强度评分之和对ERLIN2 的蛋白表达水平进行半定量评估.根据阳性细胞比例评分:<5%为 0 分;5%~50%为 1 分;>50%为2 分.染色强度评分:无着色或者轻微着色为0 分;中等着色为1 分; 强着色为2 分.两者评分之和代表ERLIN2 表达水平:0~2 分为低表达组;3~4 分为高表达组.
1.2.2 shRNA 敲低 ERLIN2 表达
结肠癌细胞系HCT116 和HT29 分别被shRNA感染.以 Lipofectamine 2000(Invitrogen, 11668069, 美国)为转染试剂,利用Western Blot 验证转染效率.具体操作:通过SDS-PAGE 电泳分离蛋白质样品并转移到PVDF 膜上,用脱脂牛奶与Tris 缓冲液加Tween-20在室温下封闭膜1 h,然后与一抗和辣根过氧化物酶络合的二抗一起温育,使用成像仪观察结果.一抗稀释比例:ERLIN2(1 ∶2 000),Ki67(1 ∶800),PCNA(1 ∶800),β-Actin(1 ∶3 000).
1.2.3 MTT 实验
将处于对数生长期的细胞以2.0×104/孔的密度接种在96 孔培养板, 培养4 d 后评估细胞活力.向结肠癌细胞中加入10 μL 的MTT,孵育4 h,吸出液体培养物并加入200 μL 的二甲基亚砜,在570 nm 处记录吸光度.每个实验重复3 次.
1.2.4 克隆形成实验
将细胞以6×102/孔的密度接种在六孔培养皿中,培养7 d 后, 用PBS 洗涤细胞, 室温下用体积分数为4%的多聚甲醛固定10 min.再次用PBS 洗涤细胞后,用质量分数为0.1%的结晶紫染色, 对菌落进行计数,计算对照组和实验组中的平均菌落数.所有实验重复3 次.
1.3 统计分析
使用SPSS 22.0 软件进行数据分析.利用卡方检验比较ERLIN2 高、 低表达组的患者对应的相关临床数据的差异,利用Kaplan-Meier 方法比较2 组的总生存期(overall survival time)和疾病无病生存期(diseasefree survival time), 双尾 P < 0.05 具有统计学意义.利用GraphPad Prism 6 软件作图.
2 结果与分析
2.1 ERLIN2在结肠腺癌和癌旁组织中的表达水平
利用免疫组化染色评估结肠腺癌组织以及癌旁组织的ERLIN2 表达水平,结果如图1 所示.
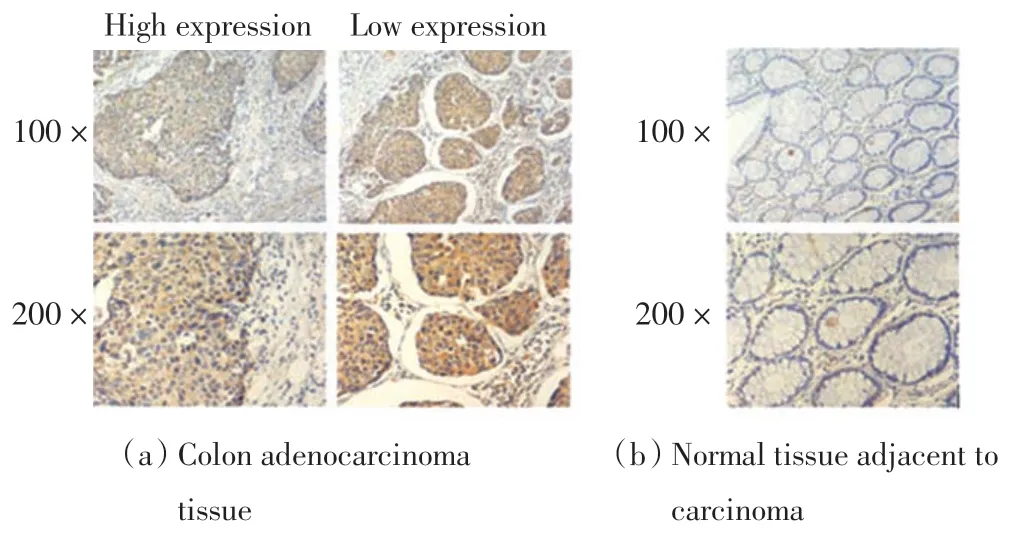
图1 ERLIN2 在结肠腺癌和癌旁正常组织中的表达Fig.1 Expression of ERLIN2 in colon adenocarcinoma and normal paracancer tissues
由图1 可以看出,ERLIN2 主要定位于细胞胞浆.通过评分分析可知, 结肠腺癌组织中共有40 例样本为ERLIN2 高表达, 癌旁组织样本中没有ERLIN2 的高表达,均为阴性或者低表达.这些结果表明,与癌旁组织相比,ERLIN2 蛋白在结肠腺癌中的表达水平明显升高.
2.2 ERLIN2的表达水平和患者临床指标的关系
ERLIN2 的表达水平与结肠腺癌围手术期临床指标的相关性分析结果如表1 所示.由表1 可以看出,82 例接受结肠腺癌根治性切除术的患者中,ERLIN2高表达与较高的结肠腺癌T 分期以及较高的临床分期相关,相关性具有统计学意义(P < 0.05).ERLIN2 的表达水平与患者年龄、性别、肿瘤分化水平以及淋巴结转移无明显相关性(P >0.05).
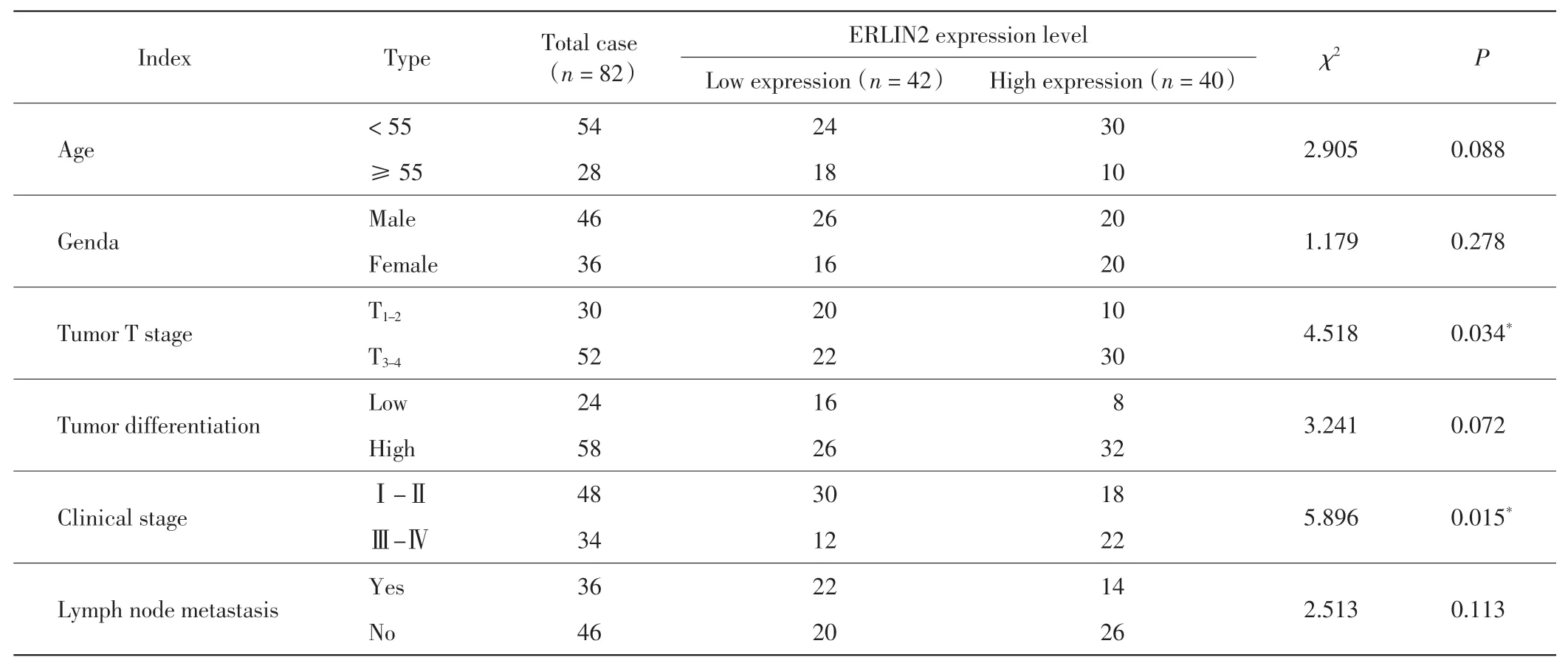
表1 ERLIN2 的表达水平与结肠腺癌围手术期临床指标的相关性Tab.1 Correlation between ERLIN2 expression level and perioperative clinical indicators of colon adenocarcinoma
2.3 ERLIN2表达水平与患者疾病总生存率和无进展生存率的关系
疾病无进展生存率是接受结肠癌根治性切除术后的患者评价预后最重要的临床指标之一.因此,本研究利用Kaplan-Meier 方法分析了ERLIN2 的高表达与不良预后的相关性, 结果如图2 所示.由图2 可以看出, 与ERLIN2 低表达组相比,ERLIN2 高表达组患者疾病的总生存期和无进展生存期更短,差异具有统计学意义(χ2=4.869,P=0.021;χ2=6.021,P=0.017).
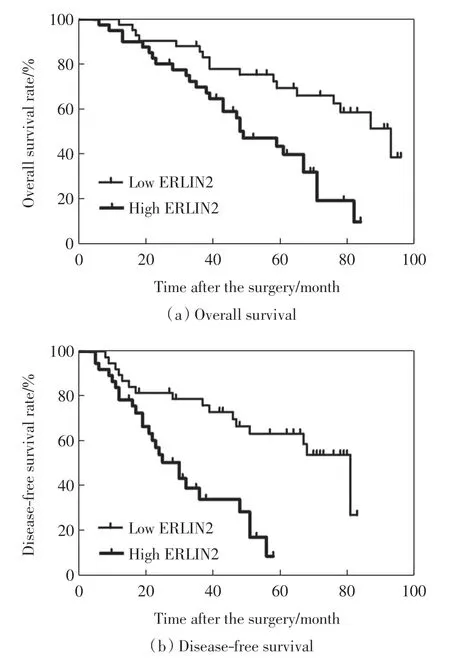
图2 结肠腺癌患者高、低ERLIN2 表达组的生存分析Fig.2 Survival analysis of high and low ERLIN2 expression in the patients of colon adenocarcinoma
2.4 敲低ERLIN2表达对结肠癌细胞增殖能力的影响
利用shRNA 分别稳定敲低结肠癌细胞系HCT116和HT29 中 ERLIN2 的表达,Western Blot 检验结果证实, 本研究成功建立了2 株稳定敲低ERLIN2 的结肠癌细胞系.MTT 实验结果如图3(a)和图3(b)所示,与对照组相比, 敲低ERLIN2 后2 株细胞系的增殖能力均显著下降(P < 0.05).克隆形成实验结果如图3(c)和图3(d)所示,敲低ERLIN2 后2 株细胞系的集落形成数目明显减少(P < 0.05).Western Blot 检测增殖相关蛋白 Ki67 和 PCNA 表达水平的变化,结果如图3(e)~图3(h)所示,与对照组相比,2 种蛋白在 2 株细胞系中的表达均显著下降(P < 0.05).
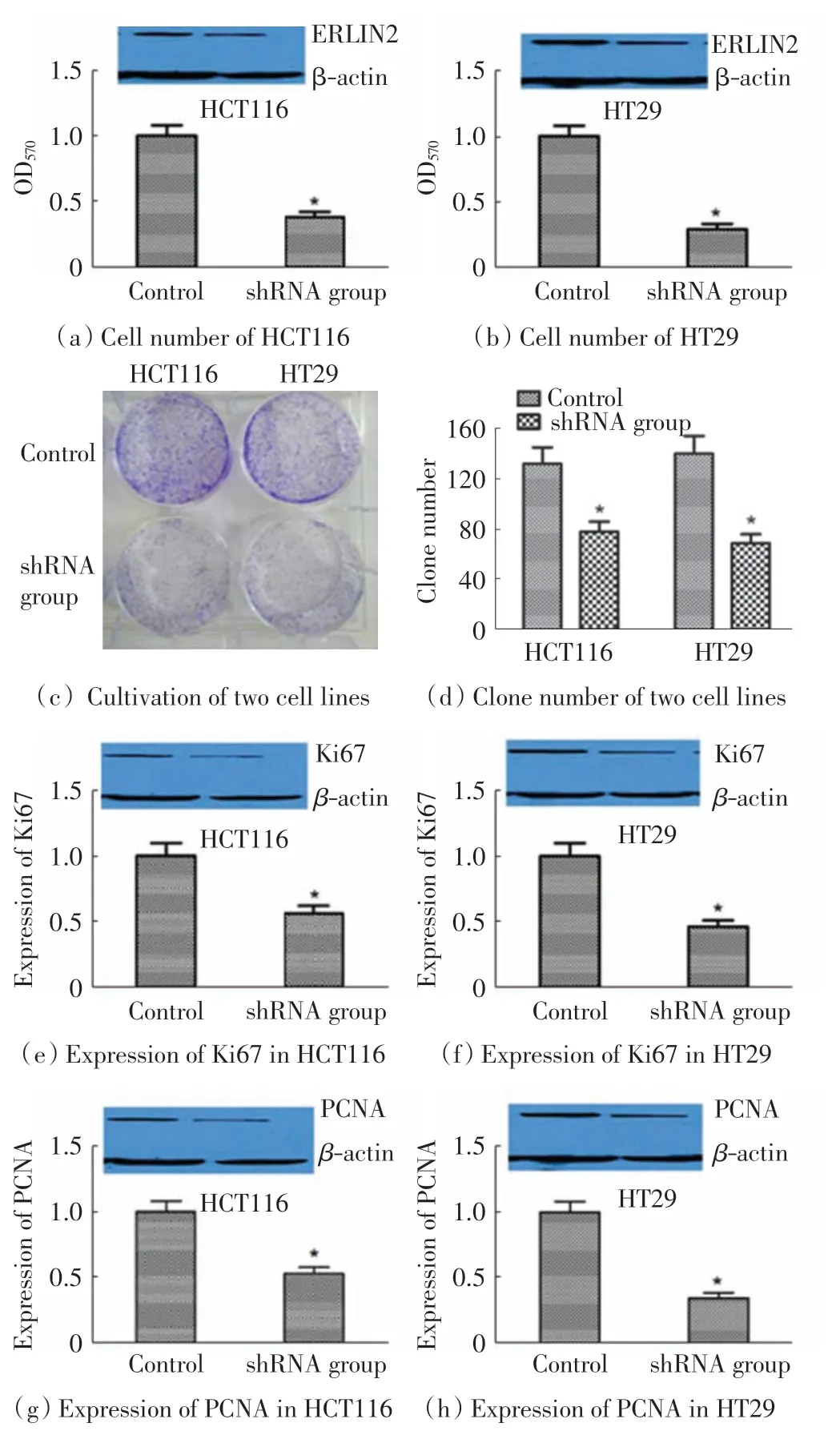
图3 结肠癌细胞系中敲低ERLIN2 表达对细胞增殖和相关蛋白表达的抑制Fig.3 Inhibition on cell proliferation and associated protein expression by the knockdown of ERLIN2 expression in colon cancer cell lines
3 讨论与结论
结肠癌是全世界主要的公共卫生问题之一,有许多风险因素与结肠癌的发生相关, 如炎症综合征、遗传因素、环境因素等[11].尽管目前可以通过一些肿瘤标记物如CEA、CA199 和CA125 等检测到部分结肠癌患者[12],但复发和转移仍然会威胁到术后结肠癌患者的生命健康.为了更好地理解结肠癌转移过程中的机制,开发针对结肠癌的分子靶向药物和准确评估患者预后,对于与结肠癌细胞增殖、迁移和侵袭相关的基因和蛋白的研究至关重要.
ERLIN2 是SPFH 家族蛋白成员之一,基因位于染色体8p11.2 上,该区域除经常在乳腺癌中发生改变以外,与常染色体隐性运动神经元疾病和中晚期尿路上皮肿瘤的发生也相关[13].本研究通过免疫组化染色方法评估82 例结肠腺癌样本及癌旁组织中ERLIN2 蛋白的表达水平, 发现对比癌旁组织, 结肠腺癌标本中ERLIN2 的表达明显升高.ERLIN2 高表达组患者的肿瘤T 分期和临床分期更高,而疾病无进展生存期更短.这些结果均表明ERLIN2 在结肠腺癌发生发展过程中可能起到重要作用,可作为一个潜在的新型预测结肠腺癌患者预后的因子.
Cheng 等[14]研究发现,在乳腺癌细胞系中,过表达ERLIN2 能够通过支持细胞生长和保护细胞免受内质网诱导的细胞凋亡来增强乳腺上皮细胞的适应能力.ERLIN2 在肿瘤形成过程中,针对多种细胞间压力为乳腺癌细胞提供保护作用,并给予其选择性生长优势[13].乳腺癌细胞中ERLIN2 的过表达会对胰岛素或者不饱和脂肪酸做出反馈,促进细胞内脂滴的累积,同时调节肿瘤细胞中脂肪生成的关键调节因子SPEBP 的活化,从而说明ERLIN2 以通过调控细胞溶质成分的方式来促进肿瘤细胞的生长.本研究在体外水平利用shRNA敲低结肠癌细胞系HCT116 和HT29 中ERLIN2 的表达,结果发现,敲低ERLIN2 后2 个结肠癌细胞系的增殖水平、 集落形成数以及细胞增殖相关蛋白Ki67 和PCNA 的表达水平均明显下调.由此推测,ERLIN2 可能是通过调控细胞增殖来促进结肠癌的发展,有潜力成为治疗结肠癌的分子靶点,具体调控机制有待进行深入探究.

