大黄对脂多糖致RAW264.7细胞炎症模型mTOR/HIF-1α/VEGF信号通路的影响
董伟 杨爱东 李小茜 吴中华 符胜光


摘要:目的 觀察大黄对脂多糖致RAW264.7细胞炎症模型mTOR/HIF-1α/VEGF信号通路的影响,探讨其作用机制。方法 实验细胞分为正常组、模型组、雷帕霉素组和大黄低、中、高剂量组,MTT法检测细胞毒性后,ELISA检测白细胞介素(IL)-6、IL-1β和肿瘤坏死因子-α(TNF-α)含量,实时荧光定量PCR检测缺氧诱导因子-lα (HIF-1α)、p70S6K1和eIF4E mRNA表达,Western blot检测雷帕霉素靶蛋白(mTOR)、HIF-1α、血管内皮生长因子(VEGF)蛋白表达。结果 与正常组比较,模型组细胞TNF-α、IL-6、IL-1β含量明显升高(P<0.05,P<0.01),HIF-1α、eIF4E和p70S6K1 mRNA表达明显升高(P<0.05,P<0.01),HIF-1α和VEGF蛋白表达明显升高(P<0.05);与模型组比较,大黄各剂量组细胞TNF-α、IL-6和IL-1β含量降低,HIF-1α、p70S6K1和eIF4E mRNA表达降低,HIF-1α、VEGF蛋白表达降低。结论 大黄可下调炎症因子水平,其机制可能与其下调HIF-1α、VEGF蛋白表达及HIF-1α、eIF4E、p70S6K1 mRNA表达水平有关。
关键词:炎症;大黄;mTOR/HIF-1α/VEGF信号通路;细胞
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2020)02-0038-05
DOI:10.3969/j.issn.1005-5304.201906319
Effects of Rhei Radix et Rhizoma on mTOR/HIF-1α/VEGF Signal Pathway in Cell RAW264.7 Inflammation Model Induced by LPS
DONG Wei, YANG Aidong, LI Xiaoqian, WU Zhonghua, FU Shengguang
School of Basic Medical Sciences, Shanghai University of Traditional Chinese Medicine,
Shanghai 201203, China
Abstract: Objective To observe the effects of Rhei Radix et Rhizoma on mTOR/HIF-1α/VEGF signal pathway in cell RAW264.7 inflammation model induced by LPS. Methods Experimental cells were divided into normal group, model group, rapamycin group and Rhei Radix et Rhizoma low-, medium-, and high-dosage groups. After MTT inspection for cytotoxicity, the levels of TNF-α, IL-1β and IL-6 were measured by ELISA; Expression of HIF-1α, p70S6K1, eIF4E mRNA were detected by PCR; Expression of mTOR, HIF-1α and VEGF protein detected by Western blot. Results Compared with the normal group, the levels of TNF-α, IL-6 and IL-1β in the model group significantly increased (P<0.05, P<0.01); the mRNA expressions of HIF-1α, EIF4E and p70S6K1 in the model group significantly increased (P<0.05, P<0.01); the protein expressions of HIF-1α and VEGF in the model group significantly increased (P<0.05). Compared with the model group, the levels of TNF-α, IL-6, and IL-1β in Rhei Radix et Rhizoma groups decreased; the mRNA expressions of HIF-1α, p70S6K1 and eIF4E decreased; the protein expression of HIF-1α and VEGF decreased. Conclusion Rhei Radix et Rhizomacan decrease the levels of inflammatory factors, and the mechanism may be related to down-regulating the protein expressions of HIF-1α and VEGF and mRNA expressions of HIF-1α, eIF4E, and p70S6K1.
Keywords: inflammation; Rhei Radix et Rhizoma; mTOR/HIF-1α/VEGF signal pathway; cells
炎症是由各种炎性细胞分泌的炎症介质和细胞因子共同介导的综合防御体系。然而,当炎症过度或调控不当时,会引起各种病理表现,如间质性肺炎、纤维素性心包炎等。研究表明,哺乳动物雷帕霉素靶蛋白(mTOR)与炎症、损伤、增生、组织修复、纤维化及肿瘤发生发展等一系列重要的病理生理过程密切相关。缺氧诱导因子-lα(HIF-1α)在脂多糖(LPS)诱导的炎症反应中起重要作用。血管内皮生长因子(VEGF)可被炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6等诱导和调控[1]。大黄味苦,性寒,归脾、胃、大肠、肝、心包经,有泻下攻积、清热泻火、凉血解毒、逐瘀通经和利湿退黄功效。目前对大黄调控炎症的机制还未明确,本研究通过建立LPS诱导RAW264.7细胞炎症模型,探讨大黄对LPS诱导细胞炎症模型mTOR/HIF-1α/VEGF信号通路的影响,为临床上大黄治疗炎症提供实验依据。
1 实验材料
1.1 细胞及培养
小鼠巨噬细胞RAW264.7,中国科学院上海细胞库提供。细胞加入DMEM高糖培养基,置于5%CO2、37 ℃细胞培养箱中培养1~2 d。当细胞融合80%~90%进行传代。传代后吸弃DMEM高糖培养基,PBS冲洗2遍,再加入新鲜常温胎牛血清,轻轻沿一个方向吹打细胞,传代比例为1∶4,实验用对数生长期的RAW264.7细胞进行。
1.2 药物及制备
大黄,购于上海同济堂药业有限公司,批号170401。取大黄126 g置于煎药壶内,加药物体积8倍量水,浸泡30 min,武火煮沸后文火煎煮30 min,过滤,再加6倍量水继续煎煮30 min,过滤,合并滤液,浓缩至300 mL,将浓缩液分装在不同的塑料瓶内,高度不超过1 cm,用保鲜膜包裹塑料瓶两层,置于-80 ℃冰箱冻存。使用时将药液从冰箱取出,放入冻干机53 h,得冻干粉7.5 g,得粉率6%。雷帕霉素片,APExBIO,批号A8167。
1.3 主要试剂与仪器
LPS O55:B5(Sigma,057M4013V),BSA试剂盒(上海碧云天),RPMI1640培养液(日本Gibco),TNF-α、IL-1β和IL-6 ELISA检测试剂盒(苏州卡尔文生物科技有限公司),mTOR抗体、HIF-1α抗体、VEGF抗体(美国Abcam),Trizol(Invitrogen),RT试剂盒(TAKARA),无水酒精、甲醇、异丙醇(国药集团化学试剂有限公司)。低温冷冻离心机3K15(美国Sigma),酶标仪680型(美国Bio-Rad),SDS-PAGE电泳仪(MINI Protean2,美国Bio-Rad),BH2显微镜(日本Olympus),实时荧光定量PCR仪(7500fast,美国ABI)。
1.4 内毒素溶液配制
称适量LPS粉末于1.5 mL EP管中,加入无菌PBS溶解配制为10 mg/mL溶液,震荡,使其充分溶解,分装,置于-20 ℃冰箱保存。使用时用无菌PBS稀释至1 mg/mL,加入细胞培养液稀释至终浓度为1 μg/mL。
2 实验方法
2.1 分组、造模和给药
实验分为空白组、模型组、雷帕霉素组和大黄低、中、高剂量组。细胞常规培养,取对数生长期细胞,消化调整细胞浓度至2×105个/mL,接种至6孔板,每孔2 mL;第2日待细胞融合80%~90%,分别加入不同剂量大黄冻干粉(200、400、800 μg/mL)、空白培养液及雷帕霉素药液(30 nmol/L),每组设3个复孔;培养24 h后加入LPS(500 ng/mL),继续培養2 h;每孔完全吸弃培养液后,常温无菌PBS洗涤细胞;每孔完全吸弃PBS后加入200~300 μL RIPA裂解液,使雷帕霉素药液均匀平铺于孔底,然后置于水平摇床,震荡10 min,使细胞与裂解液完全充分接触;吸取6孔板中每孔细胞悬液放入EP管,4 ℃、1500 r/min离心10 min,分离细胞上清液,取新的1.5 mL EP管,吸取细胞上清液,置于-80 ℃冰箱保存。
2.2 Western blot检测雷帕霉素靶蛋白、缺氧诱导因子-lα、血管内皮生长因子蛋白表达
用BCA试剂盒测定蛋白浓度,加入相应上样缓冲液及RIPA裂解液,水浴锅100 ℃,10 min完成蛋白变性。配制6%分离胶,5%浓缩胶,细胞每孔上样量10 μL,经SDS-PAGE垂直凝胶设置80 V、120 min进行电泳,通过恒流350 mA、200 min转膜将蛋白转移至PVDF膜。采用QuickBlock? Western封闭液,将膜放置于水平摇床上室温封闭约10 min后,将膜按分子量位置剪成4段后,分别加用一抗稀释液稀释后的mTOR(289 kD)、VEGF(210 kD)、HIF-1α(120 kD)及β-actin(42 kD)内参抗体,4 ℃摇床孵育过夜。次日洗膜,TBST冲洗3次×10 min,再加相应二抗室温孵育1 h,TBST冲洗3次×10 min,ECL试剂曝光显影。结果用靶蛋白/内参蛋白灰度比值表示。
2.3 ELISA检测肿瘤坏死因子-α、白细胞介素-1β和白细胞介素-6含量
收集细胞培养上清液,1500 r/min离心10 min,取上清液,ELISA测定TNF-α、IL-1β和IL-6含量,严格按照试剂盒说明书进行操作。
2.4 PCR检测缺氧诱导因子-lα、p70S6K1和eIF4E mRNA表达
吸弃培养液,PBS冲洗1次,采用Trizol法提取RNA,分光光度计检测RNA浓度,10 μL Sybr green+2 μL反转录产物+1 μL上游引物+1 μL下游引物+水ddH2O,共20 μL,进行反转录反应。PCR扩增条件:95 ℃、30 s,40个循环(95 ℃、5 s,60 ℃、34 s),引物序列见表1。
3 统计学方法
采用SPSS21.0统计软件进行分析。实验结果以—x±s表示,多组间比较采用方差分析,组间两两比较用ANOVA法。P<0.05表示差异有统计学意义。
4 结果
4.1 MTT细胞毒性结果
大黄浓度1600 μg/mL细胞抑制率为22.27%,大黄浓度800 μg/mL细胞抑制率几乎为0%,大黄浓度与细胞抑制率呈正相关,至大黄浓度200 μg/mL,细胞抑制率基本保持稳定,故选取大黄浓度200、400、800 μg/mL为细胞实验浓度。
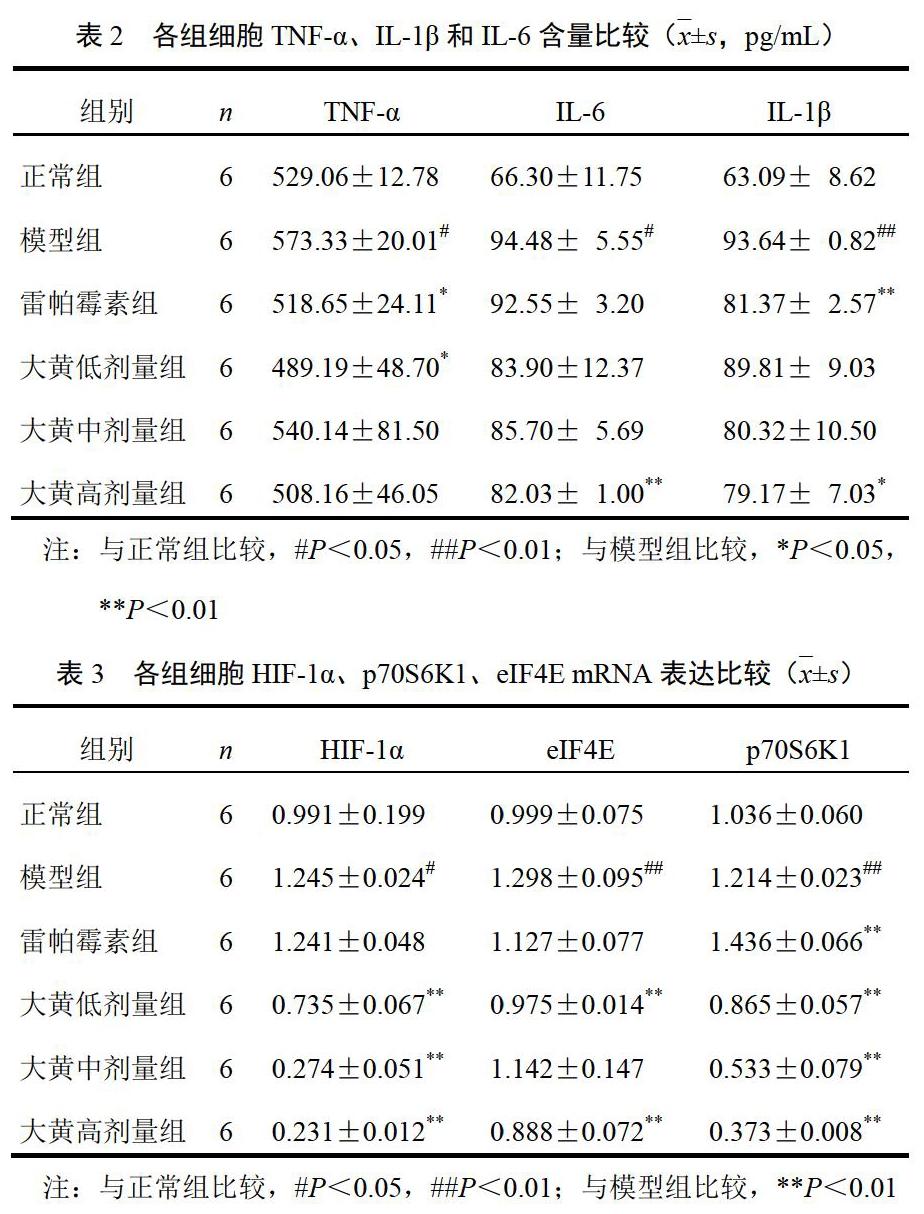
4.2 大黄对细胞模型肿瘤坏死因子-α、白细胞介素-1β和白细胞介素-6含量的影响
与正常组比较,模型组细胞TNF-α、IL-6 和IL-1β含量明显升高(P<0.05,P<0.01);与模型组比较,雷帕霉素组细胞TNF-α、IL-1β含量明显降低(P<0.05,P<0.01),大黄低剂量组细胞TNF-α含量明显降低(P<0.05),大黄高剂量组细胞IL-6、IL-1β含量明显降低(P<0.05,P<0.01)。结果见表2。
4.3 大黄对细胞模型缺氧诱导因子-lα、p70S6K1和eIF4E mRNA表达的影响
与正常组比较,模型组细胞HIF-1α、eIF4E、P70S6K1 mRNA表达明显升高(P<0.05,P<0.01);与模型组比较,雷帕霉素组细胞p70S6K1 mRNA表达明显升高(P<0.01);大黄各剂量组细胞HIF-1α、p70S6K1、eIF4E mRNA表达降低,除大黄中剂量组eIF4E mRNA表达外,差异均有统计学意义(P<0.01)。结果见表3。
4.4 大黄对细胞模型雷帕霉素靶蛋白、缺氧诱导因子-lα、血管内皮生长因子蛋白表达的影响
与正常组比较,模型组细胞HIF-1α、VEGF蛋白表达明显升高(P<0.05);与模型组比较,大黄各剂量组细胞VEGF蛋白表达明显降低(P<0.05,P<0.01),大黄中剂量组细胞mTOR蛋白表达均明显降低(P<0.05),大黄高剂量组细胞HIF-1α蛋白表达明显降低(P<0.05)。结果见图1、图2。
5 讨论
炎症及炎症反应广泛存在于心血管系统、呼吸系统、循环系统和消化系统疾病中。正常炎症反应有助于机体清除致病因素、坏死组织及受损细胞,增强机体再生修复能力,减轻各种炎症因子和介质的合成与释放、控制炎症范围、阻碍炎症损伤的进一步发展,但过度的炎症反应对机体有害,可能导致机体的二次或更严重的病理反应,严重者可产生“瀑布样反应”,最终形成多器官功能障碍综合征[2-4],从而导致死亡。
根据炎症具体临床表现如红、肿、热、痛和其他反应等,可将其归属于中医学“热证”“阳证”“火证”等范畴。《素问·至真要大论篇》“盛者泻之”“留者攻之”。《素问·阴阳应象大论篇》“中满者,泻之于内”“其实者,散而泻之”。疾病的发生主要取决于人体生理功能完整及全身气血正常运行,无论外感还是内伤,病邪侵袭人体各脏腑组织经络时会导致人体气机紊乱,产生有形实邪或无形邪气积聚不去,如火、热毒、痰、瘀等诸邪,“六腑以通为顺”,通过下法可清除这些积滞在人体中的病邪,以使全身气血运行通畅,进而促进人体各生理活动正常进行。
大黄具有泻热毒、破积滞、行瘀血功效。《神农本草经》云其具有“下瘀血,血闭寒热,破癥瘕积聚,留饮宿食,荡涤肠胃,推陈致新,通利水谷,調中化食,安和五脏”之功效。《名医别录》认为其能“平胃、下气,除痰实,肠间结热,心腹胀满”。
mTOR可整合营养、能量及生长因子等多种细胞外信号,与人体炎症、损伤、增生、组织修复、纤维化及肿瘤发生发展等一系列重要的病理生理过程密切相关。mTOR主要通过p70S6K及4E-BP1来调节下游蛋白质翻译[5]。当mTOR磷酸化4E-BP1后,可使其激活。4E-BP1磷酸化可破坏这种结合,从而释放出eIF4E,并使其磷酸化后激活相关蛋白的翻译[6-7],其中包括HIF-1α的蛋白翻译[8]。
HIF-1α是哺乳动物机体在缺氧条件下非常重要的转录调节因子。HIF-1α被认为在LPS诱导的炎症反应中起重要作用。研究表明,核因子-κB可通过HIF-1α依赖性与非依赖性的方式促进巨噬细胞分泌炎症因子[9-10]。限制巨噬细胞HIF-1α介导的炎症反应可能有益于减轻炎症相关的组织损伤。大量研究表明,炎症时HIF-1α被激活,其下游许多经典靶基因如VEGF的表达被上调[11],尤其是HIF-1α可促进炎症因子的产生,如TNF-α、IL-6等。敲除巨噬细胞中HIF-1α能明显减轻LPS导致的败血症与动物的死亡率,降低炎症因子的产生,进一步证明LPS对HIF-1α的诱导作用,提示HIF-1α在炎症反应中的潜在作用[12]。VEGF是强大的血管通透因子,也是组织生长和修复所必需的。研究表明,细胞因子网络对VEGF也有调控作用,IL-6、TNF-α等细胞因子能诱导VEGF合成。
本研究针对不同大黄浓度MTT细胞毒性测试结果表明,大黄浓度越低,细胞抑制率越低,直到大黄浓度为200 μg/mL时细胞抑制率保持稳定。
本实验结果表明,与正常组比较,模型组细胞TNF-α、IL-6和IL-1β含量明显升高,说明成功建立LPS致RAW264.7细胞炎症模型。与模型组比较,大黄各剂量组细胞TNF-α、IL-6、IL-1β含量显降低,且HIF-1α、p70S6K1和eIF4E mRNA表达显著降低,HIF-1α、VEGF蛋白表达明显降低。综上,大黄下调内毒素诱导RAW264.7细胞模型炎症因子的机制可能与其下调HIF-1α、VEGF蛋白及HIF-1α、eIF4E、p70S6K1 mRNA表达有关。
参考文献:
[1] PERSAD R, HUYNH H Q, HAO L, et al. Angiogenic remodeling in pediatric EoE is associated with increased levels of VEGF-A, angiogenin, IL-8, and activation of the TNF-α-NFκB pathway[J]. J Pediatr Gastroenterol Nutr,2012,55(3):251-260.
[2] BHATIA M, MOOCHHALA S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol,2004,202(2):145-156.
[3] PRABHAKARAN P, WARE L, WHITEK, et al. Elevated levels of plasminogen activator inhibitor-1 in pulmonary edema fluid are associated with mortality in acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol,2003,285(8):20-28.
[4] 蒋建新,姚咏明,郑江,等.细菌内毒素基础与临床[M].北京:人民军医出版社,2004:198-200.
[5] GINGRAS A C, RAUGHT B, SONENBERG N. Regulation of translation initiationby FRAP/mTOR[J]. Genes Dev,2001,15(7):807-826.
[6] BERVEN L A, CROUCH M F. Cellular function of p70S6K:a role in regulating cell motility[J]. Immunol Cell Biol,2000,78(4):447-451.
[7] KARNI R, DOR Y, KESHET E, et al. Activated pp60c-Srcleads to elevated hypoxia-inducible factor (HIF)-1 alpha expression undernormoxia[J]. J Biol Chem,2002,277(45):42919-42925.
[8] 陈洪菊,唐彬秩,屈艺,等.mTOR信号通路调节HIF-lα及VEGF[J].生命的化学,2011,31(6):838-840.
[9] LALL H, COUGHLAN K, SUMBAYEV V V. HIF-1 alpha protein is an essential factor for protection of myeloid cells against LPS-induced depletion of ATP and apoptosis that supports Toll-like receptor 4-mediated production of IL-6[J]. Mol Immunol, 2008,45(11):3045-3049.
[10] KNOWLES H J, MOLE D R, RATCLIFFE P J, et al. Normoxic stabilization of hypoxia-inducible factor-1 alpha by modulation of the labile iron pool in differentiating U937 macrophages: effect of natural resistance-associated macrophage protein1[J]. Cancer Res,2006,66(5):2600-2607.
[11] ELSON D A, RYAN H E, SNOW J W, et al. Coordinateup-regulation of hypoxia inducible factor (HIF)-1 alpha and HIF-1 target genes during multi-stage epidermal carcinogenesis and wound healing[J]. Cancer Res,2000,60(21):6189-6195.
[12] 徐敏.HIF-1α在丹参酮ⅡA减轻内毒素性急性肺损伤中的作用及其机制研究[D].西安:第四军医大学,2011.
(收稿日期:2019-06-21)
(修回日期:2019-08-09;编辑:华强)
基金项目:国家重点研发计划(2018YFC1704102);国家自然科学基金面上项目(81673855);上海市进一步加快中医药事业发展三年行动计划[ZY(2018-2020)-CCCX-2001-01];上海中医药大学中医临床基础学科(A1-Z193020109)
通訊作者:杨爱东,E-mail:aidongy@126.com
——雷帕霉素

