纳米微晶纤维素/槲皮素复合物的制备及抗氧化和抗癌性能的研究
刘庆坚 王玉珑,* 韩俊源 刘艳新,2
(1. 长沙理工大学化学与食品工程学院,湖南长沙,410114;2. 中南林业科技大学材料科学与工程学院,湖南长沙,410004)
槲皮素(Quercetin)是一种天然的多酚类化合物,主要以糖苷的形式存在于蔬菜和水果中,如洋葱、胡萝卜、葡萄和苹果等[1-4]。有研究表明,槲皮素具有多种生物活性和药理作用,如抗氧化性[5-6]、抗炎症[7]、抗癌[8]和肝脏保护[9]等。但由于槲皮素水溶性差 (水中溶解度仅为0.165 μg/mL[10])、生物利用度低,限制了其在药物和食品领域中的应用。为了提高槲皮素的水溶性和生物利用度,研究工作者尝试了多种策略,如Gao等[11]将槲皮素包埋在单甲氧基聚乙二醇-聚己内酯(MPEG-PCL)胶束中,提高了槲皮素的水溶性,有效抑制了卵巢癌细胞的增殖;Orum等[12]采用六氯环戊二烯为交联分子,通过自组装沉淀法制备了槲皮素纳米微球,增强了槲皮素的分散性和稳定性(纳米微球粒径为345~434 nm);Hao 等[13]采用β-环糊精作为槲皮素的载体制备了β-环糊精/槲皮素纳米粒子,提高了槲皮素的抗氧化活性。
纳米微晶纤维素(CNC)是从天然植物纤维原料(木材纤维、草类纤维、棉纤维和麻纤维等)中提取的新型棒状纳米材料,长度为几百纳米,宽度为5~50 nm[14-15]。作为一种新型的纳米生物材料,CNC 具有高长径比、大比表面积和高杨氏模量等特性[16-17],在制浆造纸行业展现出广泛的应用前景,如用于改善浆料滤水性,提高造纸生产效率[18];提升再生新闻纸强度性能,减轻掉毛掉粉现象[19];改善纸张涂料性能,提高纸张印刷适性等[20]。由于具有可循环再生、无毒、生物相容性好和生物可降解等优势,CNC在药物载体领域也显示出广阔的应用前景[21-22]。Mohanta等[23]制备了CNC基微胶囊及膜材料,用于负载水不溶性药物姜黄素,提高了姜黄素在水中的溶出速率及生物利用度。Letchford等[24]采用十六烷基三甲基溴化铵(CTAB)对CNC进行疏水改性,并用于负载疏水抗癌药物多西紫杉醇、紫杉醇和依托泊苷,实现了药物的缓释与控释。Tang 等[25]成功将水不溶性的20(R)-人参皂甙Rg3固着于CNC上,提升了20(R)-人参皂甙Rg3的羟基自由基清除率。
本研究以CNC作为纳米载体,以疏水药物槲皮素为模型药物,采用反溶剂重结晶法制备了CNC/槲皮素纳米复合物。利用傅里叶变换红外光谱(FT-IR)、透射电子显微镜(TEM)和X射线衍射分析(XRD)等对CNC/槲皮素纳米复合物进行表征,并分析了纳米复合物中槲皮素的溶出性能、体外抗氧化活性(羟基自由基和1,1-二苯基-2-苦基肼(DPPH)自由基的清除效果)和抗癌性能(HepG2肝癌细胞,MTT比色法),以期提高槲皮素在水体系中的生物利用度。
1 实 验
1.1 材料与试剂
纳米微晶纤维素(CNC)冻干粉末(98%干度),由硫酸水解法制备,长度为100~250 nm,宽度为5~20 nm,Zeta 电位为-45 mV,加拿大 Cellulose Lab 公司;槲皮素(≥98%纯度),合肥基努生物有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),上海伊卡生物公司;水杨酸、FeSO4·7H2O、H2O2、无水乙醇,均为分析纯,国药集团化学试剂有限公司;胎牛血清(FBS),美国Gibco 公司;双抗(青霉素、链霉素)、胰酶消化液,上海碧云天生物技术研究所;DMEM高糖培养基,美国Hyclone 公司;3-(4,5-二甲基噻唑-2) -2,5-二苯基四氮唑溴盐 (MTT),美国 Sigma 公司;HepG2肝癌细胞,中国科学院上海细胞库。
1.2 仪器与设备
TU-1810(PC)型紫外可见分光光度计,北京普析通用仪器有限公司;Nicolet iS5 型傅里叶变换红外光谱仪,美国Thermo fisher公司;FD-1A-50型真空冷冻干燥机,北京博医康实验仪器有限公司;D8 Advance 型X 射线衍射仪,德国Bruker 公司;JEM-2010型透射电子显微镜,日本电子株式会社;直热式二氧化碳培养箱,上海三藤仪器有限公司;低速离心机,上海知信仪器厂;96 孔培养板,美国Corning 公司;ELX-800型酶标仪,美国Bio-Tek公司。
1.3 实验方法
1.3.1 CNC/槲皮素纳米复合物的制备
以CNC作为载体,采用反溶剂重结晶法制备CNC/槲皮素纳米复合物,具体步骤如下:取一定量槲皮素粉末溶于无水乙醇中,经超声波细胞破碎仪分散15 min,制得质量浓度为1 mg/mL的槲皮素乙醇溶液。用去离子水将CNC冻干粉末稀释成浓度为0.05 wt%的CNC悬浮液,经超声波细胞破碎仪分散20 min。准确量取60 mL CNC悬浮液(0.05 wt%)置于烧杯中,在冰水浴中磁力搅拌5 min(转速为100 r/min),随后向CNC悬浮液中逐滴加入3 mL槲皮素乙醇溶液(1 mg/mL),滴加完成后,继续在冰水浴中磁力搅拌10 min,得到CNC/槲皮素纳米复合物,冷冻干燥备用。
对照样品的制备:取3 mL 槲皮素乙醇溶液并逐滴滴加到60 mL 去离子水中,保持其他实验条件一致,制得反溶剂重结晶槲皮素颗粒(无CNC作载体);取3 mg槲皮素粉末置于60 mL去离子水中,经超声波细胞破碎仪分散10 min,制备水分散槲皮素。
1.3.2 CNC/槲皮素纳米复合物的表征
(1)FT-IR分析 取CNC、槲皮素原料和CNC/槲皮素纳米复合物试样,使用Nicolet iS5 型傅里叶变换红外光谱仪对样品进行分析测试,扫描范围400~4000 cm-1,光谱分辨率为4 cm-1。
(2)TEM分析 取CNC、槲皮素原料、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物样品,分别用去离子水稀释至浓度为0.01 mg/mL,将稀释后的样品滴于TEM铜网测试平台上,室温下风干24 h。在加速电压200 kV 条件下,用JEM-2010 型透射电子显微镜对样品的表面形貌进行观测。
(3)XRD 分析 取CNC、槲皮素原料、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物样品进行XRD 分析。测试条件如下:采用D8 Advance 衍射仪,Cu-Kα靶 辐 射 (λ=0.154 nm), 狭 缝 DS=1 mm,RS=8 mm;采用Ni滤波片,管压40 kV,管流25 mA,扫描范围2θ=5°~ 60°,扫描速度0.02°/s。
1.3.3 槲皮素体外溶出实验
参考《中国药典》(2015 年版)附录XC 第二法(桨法)进行体外溶出度测定[26-27]。准确称取含2 mg槲皮素的实验样品,以去离子水(pH值=7.4)为溶出介质,温度为(37±0.5)℃,转速设定为100 r/min。分别在 2、5、10、30、60、90、120 min 时定点取样5 mL,经0.22 μm微孔滤膜过滤得到滤液样品,并立刻补充5 mL 等温去离子水(pH 值=7.4)到溶出介质中,以保持总溶出体积不变。使用紫外可见分光光度计测定滤液样品在375 nm 处的吸光度,利用槲皮素标准曲线(y=0.095x+0.0171,R2=0.9993)计算槲皮素在去离子水中的溶出度,绘制槲皮素体外溶出曲线。按照式(1)计算累计溶出度:

式中,C1、C2、Cn-1和Cn分别为取样点槲皮素的浓度(mg/mL),m为加入的槲皮素的总质量(mg),V1为固定的取样量(mL),V2为溶出介质的总体积(mL)。
1.3.4 槲皮素体外抗氧化活性评价
自由基是人体内代谢的一种产物,具有较强的氧化能力。当人体产生的自由基过多,会造成机体代谢紊乱,进而对机体产生损伤。本研究采用羟基自由基和DPPH自由基清除效果来评价槲皮素的体外抗氧化活性。
(1)羟基自由基清除实验 本实验通过Fenton反应产生羟基自由基,水杨酸作为捕捉剂,采用紫外分光光度法测定样品溶液的羟基自由基清除效果[28]。水杨酸-Fenton 反应体系由 1.8 mmol/L 的 FeSO4溶液2 mL、1.8 mmol/L 的水杨酸-乙醇溶液1.5 mL、H2O2溶液(0.03 wt%)0.1 mL和不同浓度的待测样品1 mL组成。在反应体系中加入H2O2溶液启动反应,震荡摇匀,在37℃的恒温水浴锅中反应30 min,在波长为510 nm处,使用紫外可见分光光度计测量反应体系的吸光度。并按式(2)计算羟基自由基的清除率:
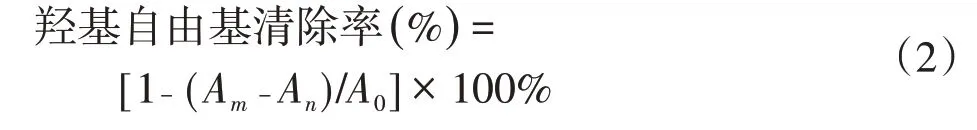
式中,A0表示空白对照样品的吸光度,代表了反应体系中产生的自由基总量;Am表示添加了自由基清除剂后体系的吸光度;An表示Am的对照样品的吸光度。
(2) DPPH 自由基清除实验 参考 Villano 等[29]的方法测定样品溶液的DPPH自由基清除率。移取待测样品溶液2 mL和0.5 mmol/L的DPPH溶液2 mL置于同一试管中混合均匀,避光静置30 min 后,在波长517 nm 处以无水乙醇作为参比测定混合液的吸光度Ai。同时测定2 mL 去离子水和2 mL 0.5 mmol/L 的DPPH溶液混合后的吸光度A0,以及测定2 mL样品溶液与2 mL 无水乙醇混合后的吸光度Aj,根据式(3)计算DPPH自由基清除率。

图1 CNC/槲皮素纳米复合物的制备路线图
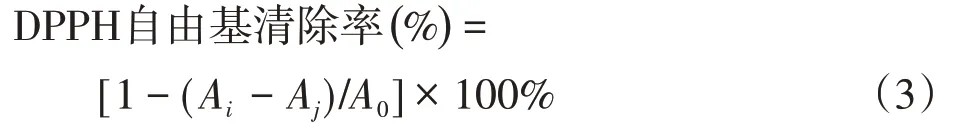
式中,A0表示未添加自由基清除剂的混合液吸光度,代表了反应体系中产生的自由基总量;Ai表示添加了自由基清除剂后的混合液吸光度;Aj表示Ai的对照样品的吸光度。
1.3.5 体外HepG2细胞毒性研究
实验中以HepG2肝癌细胞为研究对象,采用MTT比色法[30]研究了槲皮素对HepG2肝癌细胞的体外毒性抑制效果,实验过程如下:HepG2细胞置于含10%胎牛血清+1%青链霉素的DMEM 高糖培养基中培养,2天换液1 次,待细胞密度达85%后,胰酶消化细胞,一分为二进行传代。取对数生长期的HepG2细胞,胰酶消化细胞铺板(96孔板),每孔约1×104个细胞,于含5% CO2的培养箱中培养24 h。之后加入一系列不同浓度的槲皮素试样,培养48 h 后,每孔加入5 mg/mL 的 MTT 溶液(10 μL/孔),继续孵育4 h,离心吸弃上清液,加入二甲基亚砜150 μL/孔,充分混匀,于Bio-Tek 酶标仪分析490 nm 处吸光度值,并根据式(4)计算相对细胞存活率:

式中,Af表示用含槲皮素的样品处理的细胞培养液吸光度;Au表示未加槲皮素样品的细胞培养液吸光度(对照样)。
1.4 数据处理
实验数据取3次测定的平均值,采用Origin 8.0软件绘制相关图表。采用SPSS 16.0 软件对实验数据进行方差分析(ANOVA,Duncan),并分析数据间的显著性差异(p<0.05:具有显著性差异)。
2 结果与讨论
2.1 CNC/槲皮素纳米复合物的制备路线
CNC/槲皮素纳米复合物的制备路线如图1所示。
传统反溶剂重结晶法(图1(a))中,槲皮素原料预先溶于无水乙醇中,然后逐滴滴入去离子水中(本实验中乙醇为溶剂,去离子水为反溶剂)。在反溶剂(去离子水)中,槲皮素在饱和点形成晶核,并逐渐成长为纳米粒子。由于槲皮素的强疏水性,所形成的槲皮素纳米粒子在去离子水中难以稳定存在和均匀分散,会絮聚成粒径较大的絮团。采用CNC 作为载体(图1(b))后,由于CNC具有极大的比表面积和丰富的羟基,为所形成的槲皮素晶核提供了大量的结合位点(CNC 和槲皮素间主要以氢键作用结合),促使槲皮素颗粒充分纳米化,降低了粒子尺寸。同时,由于CNC 具有极好的亲水特性,所形成的CNC/槲皮素纳米复合物在水体系中具有良好的稳定性和分散性,有效地抑制了附着于CNC上的槲皮素颗粒的过度生长和絮聚。Dalvi 等[31]报道了在反溶剂重结晶法中采用高分子聚合物或表面活性剂,如聚乙烯聚吡咯烷酮、羟丙基甲基纤维素、吐温80 和十二烷基硫酸钠等作为稳定剂以抑制疏水性灰黄霉素药物颗粒的生长。
2.2 FT-IR分析
槲皮素原料、CNC 和CNC/槲皮素纳米复合物的FT-IR 谱图如图2 所示。由图2 可以看出,槲皮素在3346(—OH 伸缩振动)、1670(C=O 的伸缩振动)、1614 和1511 cm-1(苯环骨架伸缩振动)处出现特征吸收峰;Garcia-casas 等[32]也报道了相似的槲皮素的特征吸收峰。CNC 的特征吸收峰出现在3340(—OH伸缩振动)、2908(C—H 伸缩振动)、1060(C2—OH)、1030(C1—OH)和890 cm-1(纤维素异头碳振动),这与Yu 等[33]报道的结果相似。形成CNC/槲皮素纳米复合物后,羟基(—OH)吸收峰增强且略微移动到波数较低的区域(3327 cm-1),1030 和1060 cm-1的伯醇羟基 (C1—OH) 和仲醇羟基 (C2—OH)的吸收峰显著增强,这主要是由于CNC与槲皮素之间发生了非共价相互作用的结果,二者以氢键作用结合形成了稳定的纳米复合物。
2.3 TEM分析

图2 槲皮素原料、CNC和CNC/槲皮素纳米复合物的FT-IR谱图
CNC、水分散槲皮素、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物的TEM 分析结果如图3 所示。从图3 可以看出,CNC 在水体系中分散性较好,呈针状结构(图3(a)),长度为100~250 nm,宽度为5~20 nm。水分散的槲皮素原料处于结晶状态,尺寸较大,宽度接近2 μm(图3(b)),实验中发现槲皮素原料难以润湿,大部分漂浮于去离子水表面。经反溶剂重结晶法处理后形成的槲皮素絮团,粒径在200~500 nm(图3(c))。而形成CNC/槲皮素纳米复合物后,槲皮素絮团被分散成粒径更小的纳米粒子,且均匀地分散在CNC体系中(图3(d))。实验发现,CNC/槲皮素纳米复合物悬浮液的分散性和稳定性良好,室温放置一周无明显团聚和分层现象,因此,以CNC作为载体可以有效提高槲皮素在水中的分散性和稳定性。Sun等[34]采用CNC作为载体,提高了疏水染料的水分散性,从而增强了染料的显色效率和颜色稳定性。
2.4 XRD分析

图3 CNC、水分散槲皮素、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物的TEM图
槲皮素原料、反溶剂重结晶槲皮素颗粒、CNC和CNC/槲皮素纳米复合物的XRD分析结果如图4所示。
从图4 可以看出,槲皮素原料在2θ= 11.19°、12.71°、13.67°、16.77°、21.92°、26.42° 处均出现了强烈的衍射峰(图4(a)),表明槲皮素原料处于高度结晶态。反溶剂重结晶处理形成的槲皮素颗粒在2θ=11.19°、13.67°、26.42° 处出现衍射峰(图4(b)),但与槲皮素原料相比,衍射峰强度显著降低,表明反溶剂重结晶处理降低了槲皮素的结晶度。形成CNC/槲皮素纳米复合物(图4(c))后,并未检出槲皮素的衍射峰,表明槲皮素已经由高结晶态转变为无定形态。经分析认为,CNC负载后槲皮素被充分纳米化是其转变为无定形态的重要原因。研究表明,无定形态药物与其结晶态形式相比,通常具有更快的溶出速率,可以有效改善难溶性药物在水体系中的生物利用度[35]。Yadav 等[36]采用反溶剂沉淀法制备了非晶态结构的姜黄素纳米粒子,提高了姜黄素的体外溶出度。Davidov-pardo等[37]将水不溶性多酚白藜芦醇包封于麦胶蛋白和玉米醇溶蛋白中,得到无定形态的白藜芦醇纳米颗粒,提高了其水分散性和溶出度。
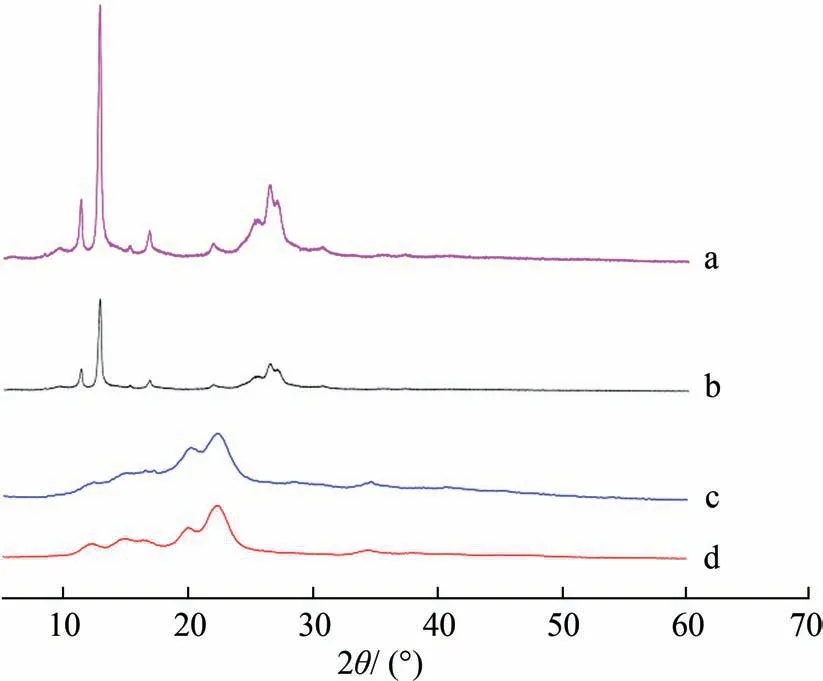
图4 XRD谱图:(a)槲皮素原料;(b)反溶剂重结晶槲皮素颗粒;(c)CNC/槲皮素纳米复合物;(d)CNC
2.5 槲皮素体外溶出性能分析
槲皮素原料、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物的体外溶出结果如图5所示。
从图5可以看出,槲皮素原料在水中的溶出度很低,120 min 时溶出度仅为4.7%。经反溶剂重结晶法制备槲皮素颗粒后,提高了槲皮素的体外溶出度,10 min 时溶出度达到37.4%,120 min 时达到55.6%,这是因为反溶剂重结晶过程中槲皮素被颗粒化,比表面积增大,因而提升了其溶出性能。形成CNC/槲皮素纳米复合物后,槲皮素的溶出度得到显著提升,在10 min 时溶出度达到72.0%,120 min 时溶出度达到92.6%,这主要是因为以CNC 作为载体后,槲皮素在水中被充分纳米化和稳定分散。疏水药物的生物利用度与其在水中的溶出度具有良好的相关性,研究工作者通过提升白藜芦醇、姜黄素、槲皮素[38-40]等疏水药物的溶出性能,从而有效提高了其生物利用度。
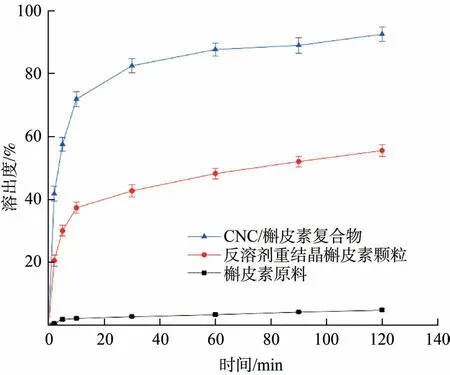
图5 槲皮素原料、反溶剂重结晶槲皮素颗粒和CNC/槲皮素纳米复合物的溶出度
2.6 体外抗氧化活性分析
机体内的自由基是引发多种疾病的原因之一,如心脏病、肝损伤、糖尿病等,而且自由基会损伤机体,是加速机体老化的重要诱因[41-42]。本研究采用羟基自由基和DPPH自由基清除效果评价槲皮素的体外抗氧化活性,结果如图6所示。
由图6(a)可知,水分散的槲皮素原料的羟基自由基清除率很低,当槲皮素浓度为50 μg/mL 时,羟基自由基清除率仅为3.6%。经反溶剂重结晶法形成槲皮素颗粒后,羟基自由基清除率升高,槲皮素浓度为50 μg/mL时,羟基自由基清除率为13.6%。形成CNC/槲皮素纳米复合物后,羟基自由基清除能力显著增强,当槲皮素浓度为10 μg/mL 时,羟基自由基清除率为26.1%,当槲皮素浓度为50 μg/mL时,羟基自由基清除率达到48.4%。从图6(b)可以看出,槲皮素对DPPH 自由基的清除规律与羟基自由基相似。水分散的槲皮素原料和溶剂重结晶槲皮素颗粒的DPPH自由基清除率较低,当槲皮素浓度为20 μg/mL 时,DPPH自由基清除率分别为2.5%和12.0%。相比之下,CNC/槲皮素纳米复合物的DPPH自由基清除率显著提升,当槲皮素浓度为20 μg/mL时,DPPH自由基清除率达到了75.3%。以上结果表明,形成CNC/槲皮素纳米复合物能够有效提升槲皮素的体外抗氧化活性。
2.7 体外HepG2细胞抑制作用评价
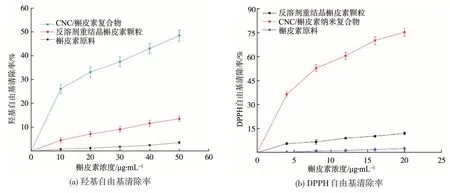
图6 槲皮素原料、反溶剂重结晶槲皮素颗粒、CNC/槲皮素纳米复合物的羟基自由基和DPPH自由基清除率
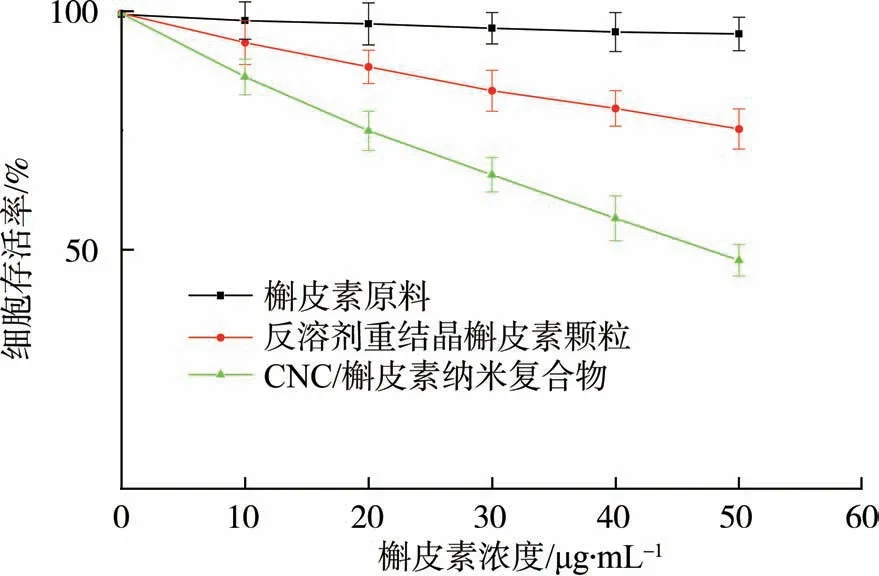
图7 槲皮素原料、反溶剂重结晶颗粒和CNC/槲皮素纳米复合物对HepG2肝癌细胞存活率的影响
实验采用MTT比色法,研究了槲皮素原料、反溶剂重结晶槲皮素颗粒及CNC/槲皮素纳米复合物对HepG2细胞的抑制效果,结果如图7所示。
由图7可以看出,槲皮素原料对HepG2细胞的抑制作用非常低,当槲皮素浓度从0 增至50 μg/mL 时,HepG2 细胞的存活率仅从99.4%降低至95.1%。反溶剂重结晶槲皮素颗粒对HepG2细胞的抑制效果得到改善, HepG2 细 胞 存 活 率 从 99.2% 降 至 75.2% (0~50 μg/mL)。而CNC/槲皮素纳米复合物对HepG2 细胞的抑制效果最显著,HepG2细胞的存活率从99.1%降低到47.7%(0~50 μg/mL),表明形成的CNC/槲皮素纳米复合物可以有效提高抗HepG2细胞的作用。
3 结 论
采用反溶剂重结晶法将疏水药物槲皮素负载于纳米微晶纤维素(CNC)上,CNC与槲皮素分子之间以氢键作用形成稳定的纳米复合物。透射电子显微镜(TEM)和X 射线衍射(XRD)分析结果表明,形成CNC/槲皮素纳米复合物后,槲皮素被充分纳米化,具有更好的分散性,结晶度降低,由结晶态转变为无定形态。基于CNC/槲皮素纳米复合物的形成,槲皮素在水中的溶出度达到了92.3%(溶出时间120 min),而槲皮素原料在水中的溶出度仅为4.7%(溶出时间120 min)。体外抗氧化活性(羟基自由基和DPPH 自由基清除效果)结果表明,CNC/槲皮素纳米复合物的体外抗氧化活性显著增强。由槲皮素体外细胞(HepG2 肝癌细胞)毒性结果可知,CNC/槲皮素纳米复合物可以显著提高槲皮素的抗癌性能。

