不同种植模式对土壤质量及马铃薯生长的影响*
宋佳承,王 天,闫士朋,张俊莲,沈宝云,李朝周†
不同种植模式对土壤质量及马铃薯生长的影响*
宋佳承1,2,王 天1,2,闫士朋1,2,张俊莲2,3,沈宝云4,李朝周1,2†
(1. 甘肃农业大学生命科学技术学院,兰州 730070;2. 甘肃省作物遗传改良和种质创新重点实验室,兰州 730070;3. 甘肃农业大学园艺学院,兰州 730070;4. 甘肃条山农林科学研究所,甘肃景泰 730400)
为探究轮作藜麦、玉米及连作对马铃薯根系生理及根系发育的影响及其机制,比较了3种种植模式(轮作藜麦、轮作玉米及连作)对马铃薯根际土壤微环境、根系生理、根系发育及植株生长的影响,以期为减轻马铃薯连作障碍、筛选较好的轮作模式提供理论依据。结果表明:(1)轮作藜麦、玉米明显降低土壤pH,提高土壤中有机质、碱解氮和有效磷含量,增强土壤肥力相关酶的活性,增加土壤细菌、放线菌数量和细菌与真菌数量比值(B/F),降低真菌数量,改善马铃薯根际土壤微环境,对植株生长发育起到促进作用,表现在马铃薯的株高、茎粗、地上部干重、根干重、单株薯重均有一定程度的增加。(2)轮作藜麦、玉米使得马铃薯根系超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性上升,超氧阴离子产生速率下降,丙二醛(MDA)含量减少,渗透调节物质含量增加,表明通过轮作藜麦和玉米使得连作对马铃薯植株造成的胁迫得到了一定程度缓解。(3)轮作藜麦、玉米显著提高了马铃薯根系总根长、根表面积、根体积、根平均直径和根尖数,说明轮作藜麦及玉米促进了马铃薯根系的生长发育,这与轮作藜麦及玉米改善土壤理化性质、生物学性质及促进马铃薯地上部分的发育相对应。比较轮作藜麦及轮作玉米的整体表现,以轮作玉米调控马铃薯连作障碍的效果较好。
马铃薯;轮作;根际土壤;根系生理;根系形态
藜麦具有完美的氨基酸组成和丰富的矿物质营养[6],不含胆固醇,低脂、低糖、低热量,已成为三高人群、糖尿病患者、孕婴的理想食品[7-8]。近年来,随着人们对藜麦的关注和深入的研究,证明藜麦具有良好的耐寒、耐旱、耐盐碱等特性[9-13],这与甘肃省气候干旱、土壤偏碱性、贫瘠、昼夜温差大的环境条件相适应[14]。玉米是甘肃省重要的第二大经济粮食作物,近年来,全省玉米种植面积和产量连年攀升,2014年全膜玉米面积达到100.87万hm2,总产量达到577.15万t[15],可见藜麦及玉米已成为甘肃重要的粮食和经济作物。已有研究发现,轮作是缓解土壤连作障碍的有效措施:王丽红等[16]和Trabelsi等[17]分别用小麦、豌豆以及菜豆、大豆与连作马铃薯进行轮作,探究其对于连作马铃薯田土壤微生物菌群及酶活性的影响;徐雪风等[18]研究了轮作油葵对马铃薯生长发育及抗性生理的影响,但关于轮作藜麦和玉米对连作马铃薯根际土壤微环境改良作用的研究鲜见报道。国内目前尚无关于轮作藜麦和玉米对马铃薯田土壤与根系互作机制的相关研究。
本试验针对甘肃省景泰县马铃薯大田的生产现状,将藜麦和玉米作为轮作作物用于马铃薯连作的调控措施,通过测定马铃薯根际土壤与根系生理的相关指标,探究轮作藜麦、玉米对马铃薯生长发育的影响机制,以期为减轻马铃薯连作障碍、筛选较好的轮作模式提供理论依据,进一步优化马铃薯田间管理技术。
1 材料与方法
1.1 供试材料
试验用马铃薯(L.)品种为“大西洋”;藜麦(Willd.)品种为“条藜2号”;玉米(L.)品种为“正德305”。试验地土壤类型为灰钙土。
1.2 试验设计
试验田于2015年、2016年种植马铃薯。2017年将试验田分为3块,分别连作马铃薯、轮作藜麦和轮作玉米。马铃薯播种的株距35 cm,每垄行距40 cm,垄宽20 cm,播种密度约为每公顷56 250株;藜麦播种密度每公顷6 kg;玉米定苗后的密度在每公顷60 000株左右。采用相同的施肥措施和大田管理方法,通过滴灌及土壤水分检测系统自动补水,将土壤含水量控制在适宜范围内。于2018年4月底全部种植马铃薯种薯,种植及管理与2017年连作马铃薯相同。连作马铃薯记做“M”;前茬轮作藜麦记做“L”;前茬轮作玉米记做“Y”,通过滴灌控制土壤含水量在相同水平,正常施肥,直至生长发育期结束。连作马铃薯、前茬藜麦、前茬玉米均设3个小区,小区面积4 m×8 m=32 m2。
1.3 土样及植株样品采集
于2018年4月底播种种薯前,在连作马铃薯、轮作玉米、轮作藜麦的各小区同时取土样,各小区随机选5个取样点,采用分层取样法,各取3个土层0~15 cm、15~30 cm、30~45 cm,测定土壤理化性质及生物学性质。
2018年7月中旬取各处理马铃薯植株,各小区分别取6株带回实验室,测定根系的生长发育指标以及根系生理指标。收获前测定马铃薯株高、茎粗、分支数及块茎产量。
1.4 土壤理化性质测定
参照鲍士旦[19]的方法,土壤pH采用酸度计法测定;土壤有机质采用重铬酸钾容量法测定;碱解氮采用碱解扩散法测定;土壤有效磷采用碳酸氢钠浸提—钼蓝比色法测定。
1.5 土壤肥力相关酶活性及土壤微生物数量测定

海克斯康制造智能隶属于海克斯康,海克斯康是全球领先的信息技术提供商,在地理信息和工业企业应用领域驱动品质和生产力的提升。海克斯康制造智能帮助工业制造商开发当今突破性的技术和改变未来生活的产品。作为领先的计量与制造方案专家,海克斯康制造智能专长于感知、解析和行动——测量数据的收集、分析和有效利用——在提高产品品质的同时,为客户带来生产速度提升和生产力加速的自信。
土壤微生物数量测定参照文献[21]的方法,微生物数量计算公式:菌数/土重=(同一稀释度N次重复的菌落平均数×稀释倍数)/土干重。
1.6 根系生理、根系形态及植株生长发育指标测定
参照Spychalla和Desborough[22]的方法,测定超氧阴离子产生速率、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性,以及脯氨酸、可溶性蛋白和可溶性糖含量。
使用根系扫描仪(EPSON Perfection V700 Photo/V750 Pro,日本)和Win-RHIZOTM2008a根系图像分析软件对各处理的根系分别进行扫描和形态指标的分析[23]。
在收获时进行以下生长发育指标测定:株高采用卷尺测量;茎粗采用游标卡尺测量马铃薯近地面处地上茎的直径;地上部及根系干物质量(以单株计算)、块茎产量以电子天平称量。
1.7 数据处理
利用SPSS 19.0统计分析软件进行数据差异显著性进行分析,采用邓肯(Ducan)法进行各指标间差异的显著性比较;采用Excel 2013软件处理数据并绘图。
2 结 果
2.1 不同种植模式对土壤理化性质的影响
由表1可知,3种处理下的土壤pH随土层加深呈增大趋势,连作马铃薯土壤pH整体上高于轮作藜麦和玉米。轮作藜麦、玉米在一定程度上增加了土壤中有机质、碱解氮和有效磷含量。3个土层中,有机质和有效磷含量在15~30 cm土层最高,在轮作藜麦、玉米处理下有机质含量较连作分别增加了3.67%、5.39%,有效磷含量在轮作藜麦、玉米处理下分别较连作增加了3.05%、18.69%;碱解氮含量在0~15 cm土层最高,轮作藜麦、玉米较连作分别增加了7.02%、17.06%。整体上,轮作玉米的效果最佳。

表1 不同种植模式下的土壤理化性质
注:表中“M”表示连作马铃薯处理,“L”、“Y”分别表示轮作藜麦、玉米;不同小写字母表示相同土层下不同轮作处理间指标差异显著(<0.05),不同大写字母表示相同轮作处理不同土层间指标差异显著(<0.01)。下同。Note:In the table,“M” stands for mono-cropping of potato,and “L” or “Y” for rotation of potato with quinoa or maize. Different lowercase letters in the table indicate significant differences between the treatments in the same soil layer(<0.05)and different uppercase letters does significant difference between soil layers(<0.01)under the same rotation pattern. The same below.
2.2 不同种植模式对土壤生物学性质的影响
轮作藜麦、玉米均提高了马铃薯土壤中碱性磷酸酶、脲酶、蔗糖酶及过氧化氢酶活性(图1a)~图1d)),整体上,除了连作马铃薯时蔗糖酶活性随着土壤深度加深持续降低,4种土壤酶在3个土层均为先升高后降低的变化趋势,在15~30 cm土层活性最高。在15~30 cm土层中,轮作藜麦、玉米处理的碱性磷酸酶活性较连作处理分别提高了15.29%、47.78%(图1a));轮作藜麦、玉米处理的脲酶活性较连作提高了42.54%、73.75%(图1b));轮作藜麦、玉米处理的蔗糖酶活性较连作提高了48.87%、164.2%(图1c));轮作藜麦、玉米处理的过氧化氢酶活性分别较连作提高了26.89%、64.99%(图1d))。整体上,轮作玉米对4种土壤酶活性的促进效果最明显。
由表2可知,相较于连作马铃薯,轮作藜麦及轮作玉米处理下土壤根际细菌数量和放线菌数量均有明显增加。三种不同处理下,细菌、放线菌数量皆在15~30 cm土层有最大值。15~30 cm土层中,细菌、放线菌数量在轮作藜麦处理中较连作马铃薯分别提高了97.35%、34.01%;轮作玉米处理的细菌和放线菌数量较连作分别提高了201.8%、58.50%。从表中可知,轮作藜麦及玉米整体降低了土壤真菌数量,且在15~30 cm土层降低幅度最大,轮作藜麦和玉米处理的真菌数量较连作马铃薯分别降低了29.63%、48.15%。土壤肥力大小可用细菌与真菌的比值(B/F)表示,从表2可以看出,随着土层加深,B/F值呈先升后降趋势,三种处理均在15~30 cm土层达到峰值,在此土层中,轮作藜麦、玉米处理B/F值分别为连作的2.80倍、5.82倍。整体上,轮作玉米处理对于连作马铃薯土壤的改善作用最好。
2.3 不同种植模式对马铃薯根系生理代谢的影响

注:图中不同小写字母表示相同土层下不同轮作处理间指标差异显著(P<0.05),不同大写字母表示相同轮作处理不同土层间指标差异显著(P<0.01)。下同。Note:Different lowercase letters in the figure indicate significant differences between the treatments in the same soil layer(P<0.05),and different uppercase letters does significant difference between soil layers(P<0.01)under the same rotation treatment. The same below.

表2 不同种植模式下土壤微生物数量

图2 不同种植模式下马铃薯根系超氧阴离子产生速率和丙二醛含量
SOD是一种源于生命体的活性物质,能够催化超氧阴离子发生歧化反应,生成H2O2和O2,是抵御氧自由基造成生物体氧化损伤的第一道防线;CAT和POD主要的作用是清除不同细胞中积累的H2O2。由图3可知,轮作藜麦、玉米均提高了SOD、POD和CAT活性,轮作藜麦、玉米处理SOD活性较连作处理分别提高了64.72%、91.94%(图3a));轮作藜麦、玉米处理POD活性较连作分别提高了18.71%、45.81%(图3b));轮作藜麦和轮作玉米处理较连作处理的CAT活性分别提高了101.5%和135.3%(图3c))。总体而言,轮作玉米对连作马铃薯幼苗根系抗氧化酶活性提升较为显著。
由图4可知,轮作藜麦、玉米均提高了马铃薯根系脯氨酸含量、可溶性蛋白含量和可溶糖含量,但提升效果不同。轮作藜麦、玉米处理的脯氨酸含量较连作分别增加了77.71%、138.2%(图4a));轮作藜麦处理的可溶性蛋白含量和可溶糖含量分别较连作增加了49.70%和14.52%,轮作玉米处理的可溶性蛋白含量和可溶糖含量分别较连作增加了121.23%和35.44%(图4b)、图4c))。可以看出,轮作能够增强马铃薯根系渗透调节功能,且轮作玉米的调节能力最好。
2.4 不同种植模式对马铃薯根系形态的影响
由表3可知,连作马铃薯的总根长、根表面积、根体积、根平均直径、根尖数均较轮作低,轮作对连作马铃薯根系生长发育的促进效果明显。轮作藜麦、玉米处理的马铃薯总根长分别较连作提高了32.90%、125.9%;轮作藜麦处理的马铃薯根表面积、根体积及根平均直径分别较连作提高了122.1%、38.74%、46.29%,而轮作玉米较连作提高了163.4%、73.68%、126.8%;马铃薯根系根尖数在轮作藜麦、玉米处理下较连作分别增加了58.80%、104.2%。以上数据表明,轮作藜麦、玉米对于提升马铃薯根系的空间分布具有明显促进作用,而根系在土壤的空间分布影响着根系吸收土壤中养分和水分的能力。整体上,轮作玉米处理根系生长发育较好。

图3 不同种植模式下马铃薯根系抗氧化酶活性

图4 不同种植模式下马铃薯幼苗根系渗透调节物质含量
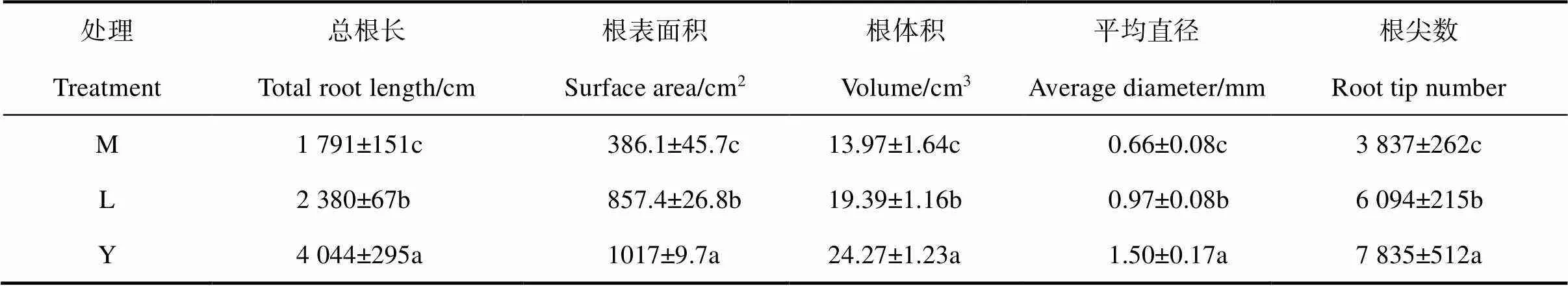
表3 不同种植模式下马铃薯根系形态
2.5 不同种植模式对马铃薯地上部分生长发育的影响
从表4可知,连作马铃薯的株高、茎粗、地上部干物质量、根干物质量及单株薯物质量均较轮作处理低。轮作藜麦、玉米均提高了马铃薯植株的株高,使其茎粗增加,促进了植株地上部分的生长,轮作藜麦处理的马铃薯株高、茎粗分别较连作增加了10.36%、14.41%,而轮作玉米处理的株高、茎粗分别较连作增加了33.53%、33.27%。轮作处理下的地上部干物质量和根干物质量也显著高于连作,促进了马铃薯植株干物质积累,轮作藜麦、玉米处理的地上部干物质量较连作分别增加了81.19%、158.6%,轮作藜麦、玉米处理的根干物质量较连作分别增加了44.87%、65.94%。马铃薯单株产量在轮作藜麦、玉米处理下较连作分别增加了148.7%、216.9%。这表明,轮作藜麦、玉米对于提高马铃薯植株的株高、茎粗、地上部干物质量、根干物质量和单株产量较连作马铃薯处理相对效果好,促进了马铃薯植株的生长发育,且轮作玉米处理的促进效果最好。
3 讨 论
3.1 不同种植模式对马铃薯根际微环境的影响
良好的土壤环境是作物生长发育的重要条件,土壤pH、有机质、氮磷钾含量等土壤理化性质是评价土壤质量的重要指标[24]。土壤酶活性(Soil enzyme activities,SEA)被认为是土壤物质和能量代谢旺盛程度及土壤质量的重要反映,土壤中各种生化反应均是在相应酶参与下完成的[25-26]。多数研究表明轮作显著提高了马铃薯连作田有机质、碱解氮、有效磷含量[18],增强土壤脲酶、碱性磷酸酶和过氧化氢酶活性[16,27]。但张智勇等[28]研究发现,轮作降低了土壤中有效磷含量。本研究结果与前者相似,轮作藜麦、玉米均增加了土壤中有机质、碱解氮和有效磷含量(表1),提高了4种土壤肥力相关酶活性,且在15~30 cm土层速效养分含量最大,酶活性最高(图1)。相较于轮作藜麦处理,轮作玉米对于土壤酶活性提升幅度最大,效果最好(图1)。土壤蔗糖酶和碱性磷酸酶活性的上升,使得土壤中有机物质代谢加快,促进了土壤中有机质和有机磷的分解,使得土壤中可有效利用的营养物质和磷素含量上升,有机质和有效磷含量也随之上升,土壤肥力上升。本研究中,土壤有效磷含量上升,这可能是由于轮作降低了土壤pH,土壤中被固定的磷素得到释放所致。
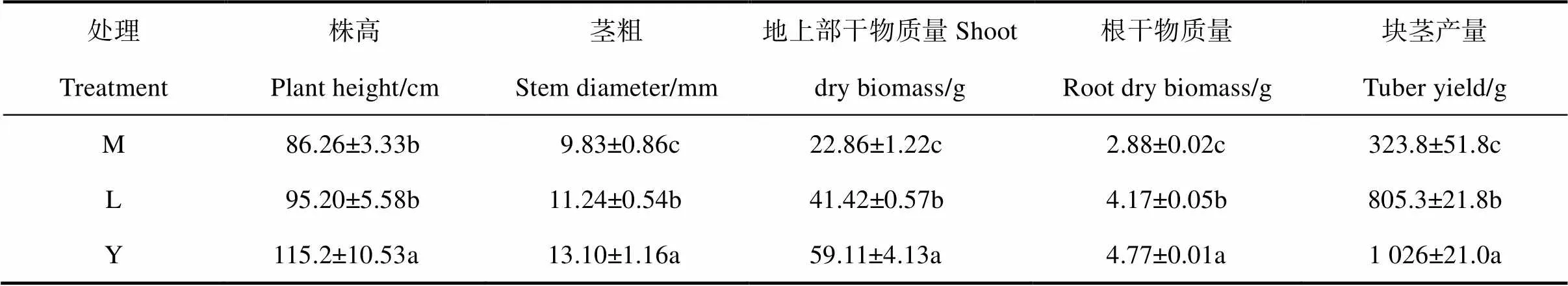
表4 不同种植模式下马铃薯地上部分生长发育指标
微生物是土壤生态系统的重要组成部分,而连作会导致土壤微生物多样性降低,有益微生物减少,病原微生物增加[29-30]。前人在对马铃薯田[16-17]、黄瓜田[31-32]不同轮作模式的研究表明,不同作物轮作改善了微生物群落的组成,明显提高土壤细菌和放线菌数量,减少真菌数量。本试验结果表明,轮作藜麦、玉米使得土壤根际真菌数量降低,有益细菌、放线菌数量以及B/F值明显增加(表2),促进微生物生长和繁殖,加速有机物质分解,提高土壤养分,这与前人研究结果相似。在3个土层中,15~30 cm土层细菌、放线菌数量及B/F值最大(表2)。可能由于不同土层土壤的温度和湿度存在差异,也可能因为各土层根系分布不同,使各土层土壤微生物环境发生改变。整体上,轮作玉米处理对连作马铃薯土壤微生物环境的改善效果最好。
3.2 不同种植模式对马铃薯根系生理和形态的影响

根系、土壤和微生物的相互作用决定了根际土壤微环境,当外界土壤环境发生变化时,植物根系会在形态上产生一系列变化,这直接影响着根系吸收土壤中养分和水分的能力[37-38]。王劲松等[38]研究发现,轮作显著提高了高粱根系的总根长、根表面积、根体积,促进了根系在10 cm以下土壤中的分布。本文研究结果显示,轮作藜麦、玉米处理的马铃薯总根长、根表面积、根体积、根平均直径、根尖数皆显著高于连作(表3)。可能是因为轮作处理的马铃薯根系对根际土壤微环境的有益变化作出了积极响应,进而促进了马铃薯根系生长发育,优化其在土壤中的空间分布,增强了根系对土壤水分和养分的吸收利用能力。结合马铃薯生长发育指标,轮作藜麦、玉米明显提高了马铃薯植株的株高、茎粗、单株产量,以及地上部干物质量和根干物质量(表4),说明轮作可有效提高马铃薯的产量,对农业生产具有重大意义,且整体上轮作玉米处理下的马铃薯产量最高(表4)。
4 结 论
轮作藜麦、玉米一定程度上改善土壤理化性质和生物学性质(土壤酶活性、土壤微生物组成),增强了马铃薯根系抗氧化能力及渗透调节能力、降低膜脂过氧化程度,促进根系的生长发育及地上部分的发育,具体表现在马铃薯植株的株高、茎粗、单株块茎产量增加。比较轮作藜麦及轮作玉米的整体表现,以轮作玉米调控马铃薯连作障碍的效果较好。
[1] Qian K. The identification of strain-specific effectors with immunity suppression insuper-race CN152. Beijing:Chinese Academy of Agricultural Sciences,2016. [钱坤. 马铃薯晚疫病强毒菌株CN152特异免疫抑制效应子的鉴定. 北京:中国农业科学院,2016.]
[2] Wu Z Q,Yue Y,Zhao X W,et al. Studies on potato industry development in Gansu Province. Chinese Journal of Agricultural Resources and Regional Planning,2008,29(6):67—72. [吴正强,岳云,赵小文,等. 甘肃省马铃薯产业发展研究. 中国农业资源与区划,2008,29(6):67—72.]
[3] He S X,Wen G H,Wang Y H,et al. Current status and proposals for improvement measures of potato industry in Gansu Province. Chinese Potato Journal,2010,24(1):54—57. [何三信,文国宏,王一航,等. 甘肃省马铃薯产业现状及提升措施建议. 中国马铃薯,2010,24(1):54—57.]
[4] Zhang S X,Guo W M,Li H X,et al. Research progresses on continuous cropping obstacles of tobacco. Soils,2015,47(5):823—829. [张仕祥,过伟民,李辉信,等. 烟草连作障碍研究进展. 土壤,2015,47(5):823—829.]
[5] Na X F,Zheng G Q,Xing Z C,et al. Effects of monocropping on diversity and structure of the bacterial community in rhizosphere of replantedL. Acta Pedologica Sinica,2017,54(5):1280—1292. [纳小凡,郑国旗,邢正操,等. 连作对再植枸杞根际细菌群落多样性和群落结构的影响. 土壤学报,2017,54(5):1280—1292.]
[6] Abugoch James L E. Chapter 1 Quinoa(Willd.):Composition,chemistry,nutritional,and functional properties. Advances in Food and Nutrition Research,2009,58(9):1—31.
[7] Meneguetti Q A,Brenzan M A,Batista M R,et al. Biological effects of hydrolyzed quinoa extract from seeds ofwilld[J]. Journal of Medicinal Food,2011,14(6):653—657.
[8] Schumacher A B,Brandelli A,MacEdo F C,et al. Chemical and sensory evaluation of dark chocolate with addition of quinoa(Willd.). Journal of Food Science and Technology,2010,47(2):202—206.
[9] González J A,Bruno M,Valoy M,et al. Genotypic variation of gas exchange parameters and leaf stable carbon and nitrogen isotopes in ten quinoa cultivars grown under drought. Journal of Agronomy and Crop Science,2011,197(2):81—93.
[10]Urcelay C,Acho J,Joffre R. Fungal root symbionts and their relationship with fine root proportion in native plants from the Bolivian Andean Highlands above 3,700 m elevation. Mycorrhiza,2011,21(5):323—330.
[11] Adolf V I,Shabala S,Andersen M N,et al. Varietal differences of quinoa’s tolerance to saline conditions. Plant and Soil,2012,357(1/2):117—129.
[12] Jacobsen S E,Monteros C,Corcuera L J,et al. Frost resistance mechanisms in quinoa(Willd.). European Journal of Agronomy,2007,26(4):471—475.
[13] Christiansen J L,Jacobsen S E,Jørgensen S T. Photoperiodic effect on flowering and seed development in quinoa(quinoa Willd.). Acta Agriculturae Scandinavica,Section B - Soil & Plant Science,2010,60(6):539—544.
[14] Huang J,Yang F R. Quinoa in the current research situation and prospect of Gansu. Gansu Agricultural Science and Technology,2015(1):49—52. [黄杰,杨发荣. 藜麦在甘肃的研发现状及前景. 甘肃农业科技,2015(1):49—52.]
[15] Song Y L,Li K F,Geng Z G,et al. Current situation and countermeasures of maize breeding in Gansu Province. Agricultural Science-Technology and Information,2019(3):80—82. [宋亚丽,李可夫,耿智广,等. 甘肃省玉米育种现状及对策. 农业科技与信息,2019(3):80—82.]
[16] Wang L H,Guo X D,Tan X L,et al. Effects of different crop rotations on enzyme activities and microbial quantities in potato soil. Agricultural Research in the Arid Areas,2016,34(5):109—113. [王丽红,郭晓冬,谭雪莲,等. 不同轮作方式对马铃薯土壤酶活性及微生物数量的影响. 干旱地区农业研究,2016,34(5):109—113.]
[17] Trabelsi D,Ben Ammar H,Mengoni A,et al. Appraisal of the crop-rotation effect of rhizobial inoculation on potato cropping systems in relation to soil bacterial communities. Soil Biology and Biochemistry,2012,54:1—6.
[18] Xu X F,Li C Z,Zhang J L. Effects of oil-sunflower rotation on growth and resistance physiology indexes of potato. Soils,2017,49(1):83—89. [徐雪风,李朝周,张俊莲. 轮作油葵对马铃薯生长发育及抗性生理指标的影响. 土壤,2017,49(1):83—89.]
[19] Bao S D. Soil and agro-chemistrical analysis. 3rd ed. Beijing:China Agriculture Press,2000:30—34. [鲍士旦. 土壤农化分析. 3版. 北京:中国农业出版社,2000:30—34.]
[20] Guan S Y. Soil enzyme and its research method. Beijing:Agriculture Press,1986:274—323. [关松荫. 土壤酶及其研究法. 北京:农业出版社,1986:274—323.]
[21] Li K. Studies on the mechanism and control approaches of replant obstacle in grape. Shenyang:Shenyang Agricultural University,2010. [李坤. 葡萄连作障碍机理及调控途径的研究. 沈阳:沈阳农业大学,2010.]
[22] Spychalla J P,Desborough S L. Superoxide dismutase,catalase,and α-tocopherol content of stored potato tubers. Plant Physiology,1990,94(3):1214—1218.
[23] Shan L S,Li Y,Duan Y N,et al. Response of root morphology and water use efficiency ofto soil water change. Acta Botanica Boreali-Occidentalia Sinica,2014,34(6):1198—1205. [单立山,李毅,段雅楠,等. 红砂幼苗根系形态特征和水分利用效率对土壤水分变化的响应. 西北植物学报,2014,34(6):1198—1205.]
[24] Velasquez E,Lavelle P,Andrade M. GISQ,a multifunctional indicator of soil quality. Soil Biology and Biochemistry,2007,39(12):3066—3080.
[25] Melero S,Madejón E,Ruiz J C,et al. Chemical and biochemical properties of a clay soil under dryland agriculture system as affected by organic fertilization. European Journal of Agronomy,2007,26(3):327—334.
[26] Roldán A,Salinas-García J R,Alguacil M M,et al. Soil enzyme activities suggest advantages of conservation tillage practices in Sorghum cultivation under subtropical conditions. Geoderma,2005,129(3/4):178—185.
[27] Qin S H,Cao L,Zhang J L,et al. Effect of rotation of leguminous plants on soil available nutrients and physical and chemical properties in continuous cropping potato field. Acta Agronomica Sinica,2014,40(8):1452—1458. [秦舒浩,曹莉,张俊莲,等. 轮作豆科植物对马铃薯连作田土壤速效养分及理化性质的影响. 作物学报,2014,40(8):1452—1458.]
[28] Zhang Z Y,Dong X X,Wang S M,et al. Influence of different control measures of continuous cropping obstacle on morphological and physiological characteristics of cotton roots in Xinjiang. Chinese Journal of Applied and Environmental Biology,2019,25(4):918—925. [张智勇,董秀秀,王绍明,等. 不同连作障碍消减措施对新疆棉花根系形态生理特征的影响. 应用与环境生物学报,2019,25(4):918—925.]
[29] Wang W P,Mao R Z,Chen J B,et al. Analysis of functional diversity of soil microbial communities under different cultivation patterns at different growth stages of maize. Chinese Journal of Eco-Agriculture,2015,23(10):1293—1301. [王文鹏,毛如志,陈建斌,等. 种植方式对玉米不同生长期土壤微生物群落功能多样性的影响. 中国生态农业学报,2015,23(10):1293—1301.]
[30] Zhang Y W,Xu Z,Tang L,et al. Effects of different organic fertilizers on the microbes in rhizospheric soil of flue-cured tobacco. Chinese Journal of Applied Ecology,2013,24(9):2551—2556. [张云伟,徐智,汤利,等. 不同有机肥对烤烟根际土壤微生物的影响. 应用生态学报,2013,24(9):2551—2556.]
[31] Yang F J,Wu H T,Wei M,et al. Effects of rotation and fallowing on the microbial communities and enzyme activities in a solar greenhouse soil under continuous cucumber cropping. Chinese Journal of Applied Ecology,2009,20(12):2983—2988. [杨凤娟,吴焕涛,魏珉,等. 轮作与休闲对日光温室黄瓜连作土壤微生物和酶活性的影响. 应用生态学报,2009,20(12):2983—2988.]
[32] Yu G B,Wu F Z,Zhou X G. Effects of rotations of cucumber with wheat and hairy vetch on soil micro-ecological environment and its yield. Acta Pedologica Sinica,2011,48(1):175—184. [于高波,吴凤芝,周新刚. 小麦、毛苕子与黄瓜轮作对土壤微生态环境及产量的影响. 土壤学报,2011,48(1):175—184.]
[33] Foyer C H,Descourvieres P,Kunert K J. Protection against oxygen radicals:An important defence mechanism studied in transgenic plants. Plant,Cell and Environment,1994,17(5):507—523.
[34] Bowler C,Montagu M V,Inze D. Superoxide dismutase and stress tolerance. Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1):83—116.
[35] Lü Y,Song F H,Li Y Y,et al. The influence of different crops rotation on the environment of soil and physiological characteristics ofRehd Seedlings. Scientia Agricultura Sinica,2014,47(14):2830—2839. [吕毅,宋富海,李园园,等. 轮作不同作物对苹果园连作土壤环境及平邑甜茶幼苗生理指标的影响. 中国农业科学,2014,47(14):2830—2839.]
[36] Xu S Z,Zhao Y W,Wang Y K,et al. Effects of dazomet fumigation and short-timerotation on the growth and physiology of. Acta Horticulturae Sinica,2018,45(6):1021—1030. [徐少卓,赵玉文,王义坤,等. 棉隆熏蒸加短期轮作葱对平邑甜茶幼苗生长及其生理的影响. 园艺学报,2018,45(6):1021—1030.]
[37] Sun W T,Ma M,Dong T,et al. Effects of mulching on root growth and nutrient reservation in overwintering apple trees grown in the dry area of eastern Gansu. Journal of Fruit Science,2016,33(11):1367—1378. [孙文泰,马明,董铁,等. 地表覆盖对陇东旱塬苹果根系生长与越冬前后树体贮藏营养的影响. 果树学报,2016,33(11):1367—1378.]
[38] Wang J S,Fan F F,Guo J,et al. Effects of different crop rotations on growth of continuous cropping sorghum and its rhizosphere soil micro-environment. Chinese Journal of Applied Ecology,2016,27(7):2283—2291. [王劲松,樊芳芳,郭珺,等. 不同作物轮作对连作高粱生长及其根际土壤环境的影响. 应用生态学报,2016,27(7):2283—2291.]
Influences of Planting Pattern on Soil Quality and Potato Growth
SONG Jiacheng1, 2, WANG Tian1, 2, YAN Shipeng1, 2, ZHANG Junlian2, 3, SHEN Baoyun4, LI Chaozhou1, 2†
(1. College of Life Science and Technology,Gansu Agricultural University, Lanzhou 730070,China; 2. Gansu Key Laboratory of Crop Genetics and Germplasm Enhancement, Lanzhou 730070, China;3. College of Horticulture, Gansu Agricultural University, Lanzhou 730070, China;4. Gansu Tiaoshan Institute of Agricultural and Forestry Sciences, Jingtai, Gansu 730400, China)

Potato; Rotation; Rhizosphere soil; Root physiology; Root morphology
S532
A
10.11766/trxb201902250026
宋佳承,王天,闫士朋,张俊莲,沈宝云,李朝周. 不同种植模式对土壤质量及马铃薯生长的影响[J]. 土壤学报,2020,57(2):490–499.
SONG Jiacheng,WANG Tian,YAN Shipeng,ZHANG Junlian,SHEN Baoyun,LI Chaozhou. Influences of Planting Pattern on Soil Quality and Potato Growth[J]. Acta Pedologica Sinica,2020,57(2):490–499.
* 国家马铃薯产业技术体系项目(CARS-09-P14)和甘肃省科技厅科技支撑项目(1604NKCA052-3)资助Supported by Potato Industrial Technology System of China(No. CARS-09-P14)and the Science and Technology Support Project of Science& Technology Department of Gansu Province,China(No.1604NKCA052-3)
,E-mail:licz@gsau.edu.cn
宋佳承(1994—),男,甘肃庆阳人,硕士研究生,主要从事植物逆境生理研究。E-mail: 1029365010@qq.com
2019–02–25;
2019–04–20;
优先数字出版日期(www.cnki.net):2019–05–31
(责任编辑:陈荣府)

