长期施肥对旱地红壤细菌群落的影响*
刘 佳,陈晓芬,刘 明,吴 萌,王伯仁,蔡泽江,张桃林,李忠佩†
长期施肥对旱地红壤细菌群落的影响*
刘 佳1,2,3,陈晓芬1,2,3,刘 明1,吴 萌1,王伯仁4,5,蔡泽江4,5,张桃林1,2,李忠佩1,2†
(1. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2. 中国科学院大学,北京 100049;3. 江西省农业科学院土壤肥料与资源环境研究所/国家红壤改良工程技术研究中心,南昌 330200;4. 中国农业科学院农业资源与农业区划研究所,北京 100081;5. 祁阳农田生态系统国家野外科学观测研究站,湖南祁阳 426182)
为探讨长期不同施肥对旱地红壤细菌群落的影响,以中国农业科学院祁阳红壤实验站的冬小麦—夏玉米定位试验为研究对象,选取不施肥(CK)、单施氮肥(N)、施化学氮磷钾肥(NPK)和化学氮磷钾+有机肥配施(NPKM)4个处理,于试验开展25年(2015年)小麦收获后采集各处理0~20 cm的土壤样品,利用Illumina MiSeq高通量测序技术对土壤细菌群落进行测定,并深入揭示影响旱地红壤细菌群落的关键因素。结果表明:(1)长期不同施肥显著改变了旱地红壤的化学性质,N和NPK处理的土壤pH显著降低至4.02和4.15,而NPKM处理的土壤pH显著上升至5.99。NPK和NPKM处理均显著改善土壤肥力,但后者效果明显优于前者,而N处理对土壤肥力的提升效果微弱。(2)长期不同施肥改变了旱地红壤优势菌的相对丰度,非度量多维度分析(NMDS)和相似性分析(ANOSIM)表明不同处理的土壤细菌群落发生显著变化。(3)与CK相比,N处理的4种多样性指数(物种丰富度、Chao1指数、系统发育多样性和香农指数)显著降低了21.4%~49.4%,而NPKM处理显著增加了7.0%~66.9%,NPK处理也会使系统发育多样性和香农指数显著降低10.3%和13.0%。(4)逐步回归分析表明土壤pH是决定优势菌相对丰度及4种多样性指数的首要因素,多元回归树分析(MRT)探明土壤pH共解释了83.1%的细菌群落变异,不同处理间细菌群落转变均由土壤pH驱动。(5)STAMP分析发现,N、NPK和NPKM处理与CK分别有11、14和8个显著差异细菌属。综上所述,长期施肥后旱地红壤细菌群落主要受土壤pH的影响,而土壤肥力的作用相对较弱,长期施用化学氮肥造成的红壤酸化的负面效应已远超肥力改善的正面效应。因此,旱地红壤施肥应以防治土壤酸化为前提,长期化肥有机肥配施是一项适宜的施肥措施。
长期施肥;旱地红壤;细菌群落;高通量测序;土壤pH
红壤是我国南方热带、亚热带地区的典型土壤,总面积148万km2,占全国耕地总面积的36%,其中旱地农田约占红壤区耕地总面积的40%[1]。由于强烈的风化淋溶,红壤具有酸性强、有机质含量低、养分匮乏等特征[2];近几十年来的过度开发和不合理利用,又进一步加剧了红壤退化。因此,尽管南方红壤区光、热、水等自然条件优越,却难以得到充分发挥,红壤旱地作物如小麦[3]、玉米[4]、花生[5]等的平均产量也远低于我国北方地区。改良红壤性状、提高红壤生产力,是实现我国南方红壤区农业可持续发展的关键。
施肥是农业生产中提高土壤肥力、增加作物产量的常用措施,合理施肥可促进土壤生态系统的正向发展,但施肥不当会引起土壤酸化、养分失衡等一系列环境问题。微生物作为土壤生态系统的重要组分,在土壤肥力的形成,有机质的分解、转化与固定,养分的生物地球化学循环中发挥着重要作用[6]。土壤微生物对环境变化极其敏感,关注施肥对土壤微生物群落的影响是近年来的研究热点。许多研究表明,施肥改变了土壤肥力状况,养分含量变化如土壤有机碳[7-8]、总氮[9-10]等直接驱动了土壤微生物群落转变,增加或降低了微生物群落多样性;但也有研究认为,施肥通过改变土壤性质间接作用于土壤微生物[11],Zeng等[12]发现施氮造成的土壤pH降低是导致细菌群落变化的主要原因,Sun等[13]发现砂姜黑土长期施肥后引起土壤细菌群落转变的pH阈值为5.74,Ma等[14]发现施肥造成的土壤C:P和N:P变化决定了土壤微生物群落组成。此外,施肥还可能通过影响地上植物作用于地下微生物[12]。可见,施肥对土壤微生物群落的影响存在多种途径,具体的影响效果及关键因素具有不确定性,这可能与土壤类型、施肥措施和种植制度等有关,因此需要开展针对性研究予以探明,这对于科学评估施肥效果、及时有效调整施肥策略具有重要意义。
土壤微生物研究长期以来受到技术方法的严重制约[15],近些年来高通量测序技术取得重大突破,使完整精准破译土壤微生物的遗传信息成为可能。因此,本研究采用当下迅速发展的Illumina MiSeq高通量测序技术,以中国农业科学院祁阳红壤实验站的定位试验为对象,研究长期施肥对旱地红壤细菌群落的影响,探明驱动细菌群落变化的关键因素及其影响阈值,揭示响应不同施肥措施的特异微生物种类,以期为我国南方旱地红壤的合理施肥和可持续利用提供理论依据。
1 材料与方法
1.1 研究区概况
试验区位于湖南省祁阳县中国农业科学院祁阳红壤实验站(26°45′12″ N,111°52′32″ E)。该区域属典型的亚热带湿润季风气候,年均气温18.0℃,≥10℃的积温5 600 ℃,年均降水量1 255 mm,蒸发量1 470 mm,无霜期约300 d,日照时数约1 610 h[16]。长期施肥定位试验开始于1990年,供试土壤为第四季红黏土母质发育的红壤,试验开始时0~20 cm土壤的基础化学性质为:pH 5.70,土壤有机碳(SOC)6.06 g·kg–1,全氮(TN)1.07 g·kg–1,全磷(TP)0.52 g·kg–1,全钾(TK)13.7 g·kg–1,碱解氮(AN)79.0 mg·kg–1,有效磷(AP)13.9 mg·kg–1,速效钾(AK)104 mg·kg–1[17]。
1.2 试验设计与样品采集
本研究选取长期施肥定位试验中的4个处理:①不施肥(CK),②单施氮肥(N),③施化学氮磷钾肥(NPK),④化学氮磷钾+有机肥配施(NPKM)。肥料年施用量为:N 300 kg·hm–2、P2O5120 kg·hm–2和K2O 120 kg·hm–2。在NPKM处理中,30%的N来源于化肥,70%的N来源于有机肥,即保证总施氮量不变。氮肥使用尿素(含N 46%),磷肥使用过磷酸钙(含P2O512%),钾肥使用氯化钾(含K2O 60%),有机肥使用猪粪(每年施用前测定其含N量)。试验的种植制度为冬小麦—夏玉米轮作。玉米季的化肥施用量占总施用量的70%,小麦季占30%,但有机肥均在小麦季施用,所有肥料在作物种植前一次性基施。试验小区面积为196 m2,两次重复。
在2015年5月小麦收获后采集土壤样品。采样时每小区分作2个半区进行,每个半区用土钻按“S”形采集0~20 cm土样10份,彻底混匀后作为一个样品,即每处理获得4个重复样品。土样采集后尽快带回室内,拣除杂质后过2 mm筛,而后将每个样品分为两份:一份风干用于测定土壤化学性质,一份保存在−80℃的冰箱中用于提取土壤DNA。
1.3 土壤化学性质测定
土壤化学性质的测定参照鲁如坤[18]的方法进行。土壤pH采用电位法测定(水︰土=2.5︰1),土壤有机碳(SOC)采用重铬酸钾氧化—容量法测定,全氮(TN)采用凯氏定氮法测定,全磷(TP)采用碳酸钠熔融法测定,全钾(TK)采用氢氧化钠熔融法测定,碱解氮(AN)采用碱解扩散法测定,有效磷(AP)采用碳酸氢钠浸提—钼锑抗比色法测定,速效钾(AK)采用乙酸铵浸提—火焰光度法测定。
1.4 土壤DNA的提取和16S rRNA基因的高通量测序
称取0.5 g土壤样品用FastDNA®SPIN Kit for Soil试剂盒(MP Biomedicals,美国)进行DNA提取,具体方法和步骤参照试剂盒说明书进行。采用特异性引物515F(5′-GTGCCAGCMGCCGCG G-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌16S rRNA基因的V4-V5区进行扩增[19]。PCR反应体系包括:PremixDNA聚合酶(5 U·μL–1)25 μL,正、反向引物(20 mg·L–1)各0.5 μL,DNA模板(20 mg·L–1)1 μL,双蒸水补至50 μL。PCR扩增条件为:95℃预变性5 min;(94 ℃45 s,56 ℃45 s,72 ℃45 s)×35个循环;72 ℃10 min。PCR产物用JET quick PCR产物纯化试剂盒(Genomed Gmbh,美国)纯化,而后使用Illumina MiSeq PE 250高通量测序平台进行测序。
1.5 高通量测序数据分析
MiSeq高通量测序结果用QIIME软件进行分析[20]。首先将具有相同Barcode引物的序列归为一类样品。将高通量测序得到的原始序列进行拼接,拼接时碱基重叠数不得少于20个,碱基配对错误率为0。拼接后去除q值(质量分数)低于25的低质量序列,用UCLUST对保留的高质量序列按97%的相似度进行聚类,得到细菌序列的可操作分类单元(OTU,Operational taxonomic units),选择每个OTU中数量最多的序列作为该OTU的代表序列。采用PyNAST方法将所有代表序列对齐后建立系统发育树并计算系统发育多样性。用RDP Classifier将OTU代表序列与Silva的16S rRNA基因数据库进行比对,比对可信度为0.8[21],生成具有物种丰度信息的OTU表用于后续分析。高通量测序的原始数据保存在ENA(European Nucleotide Archive)数据库,登记号为PRJEB30581。
1.6 数据处理
土壤化学性质、优势菌(平均相对丰度>1%)相对丰度、细菌多样性等指标采用单因素方差分析、Duncan多重比较来判断差异显著性(<0.05);采用逐步回归分析揭示优势菌相对丰度、细菌多样性与土壤化学性质的关系。采用非度量多维度分析(NMDS,Non-metric multidimensional scaling)揭示不同处理细菌群落组成的差异,并用相似性分析[22](ANOSIM,Analysis of similarities)判断差异是否达到显著水平(<0.05)。采用多元回归树分析[23](MRT,Multivariate regression tree)研究细菌群落与土壤化学性质的关系。采用STAMP分析[24](Statistical analysis of metagenomic profiles)揭示不同处理之间的显著差异物种。单因素方差分析、Duncan多重比较、逐步回归分析使用PASW Statistics 18.0完成,NMDS和ANOSIM分析使用R软件(Version 3.4.4)的vegan包完成,MRT分析使用R软件(Version 2.7.2)的mvpart包完成,STAMP分析使用STAMP软件完成。Origin 8.5作图。
2 结 果
2.1 土壤化学性质
经过25 a长期不同施肥,旱地红壤的化学性质发生了显著变化(表1)。N和NPK处理的土壤pH分别降低至4.02和4.15,而NPKM处理的土壤pH升高至5.99。NPK和NPKM处理均在不同程度上改善了土壤的肥力状况。与CK相比,NPK处理使土壤SOC、TN、TP和AN均显著提高(<0.05),分别提高了0.54倍、0.44倍、1.50倍和0.70倍,而NPKM处理对上述指标的提高幅度更大,分别达到1.11倍、1.18倍、3.65倍和1.19倍(<0.05)。土壤AP和AK对施肥的响应更加敏感,NPK处理的AP和AK相对于CK分别增加了22.4倍和3.71倍,而NPKM处理则分别增加55.5倍和9.00倍。然而,N处理对土壤肥力的改善效果微弱,仅TN相对于CK显著增加。

表1 长期不同施肥对土壤化学性质的影响
注:同列不同小写字母表示处理间差异显著(<0.05)。下同。Note:Different lowercase letters in the same column indicate significant differences between treatments at<0.05. The same below.
2.2 土壤细菌群落组成
对所有土壤样品进行MiSeq高通量测序,经数据分析与优化筛选后共获得了796 528条优质序列,其中最少序列的样品为40 979条,最多序列的样品为55 621条,样品的平均序列数为49 783条。为使所有样品的序列数在同一水平上进行比较,本研究中每个样品随机抽取40 000条序列用于分析,抽取后这些序列的96.6%可被归类为细菌。
长期不同施肥显著影响旱地红壤门水平优势菌的相对丰度(表2)。可以看出,与CK相比,所有施肥处理均显著降低酸杆菌和芽单胞菌的相对丰度;NPK和NPKM处理显著增加变形菌和厚壁菌的相对丰度,但却显著较低了蓝细菌的相对丰度,而N处理对上述三种优势菌的影响完全相反。此外,N和NPK处理显著增加浮霉菌的相对丰度,显著降低拟杆菌的相对丰度;而NPKM处理却显著增加拟杆菌的相对丰度,并显著降低绿弯菌和放线菌的相对丰度。可见,土壤优势菌对不同施肥的响应差异明显。对OTU数据进行NMDS分析发现(图1),各处理样点在NMDS图上分异明显,互不交叉。经ANOSIM检验,任意两处理之间的差异性均>0.90、<0.05,表明长期不同施肥已显著改变土壤细菌群落组成。
2.3 土壤细菌多样性
长期不同施肥显著影响旱地红壤细菌多样性(表3)。与CK相比,N处理显著降低土壤细菌多样性,其物种丰富度、Chao1指数、系统发育多样性和香农指数的降幅分别达到49.4%、46.7%、40.7%和21.4%;NPK处理也会显著降低系统发育多样性和香农指数,其降幅分别达到10.3%和13.0%;而NPKM处理可显著提高物种丰富度、Chao1指数、系统发育多样性和香农指数,其增幅分别达到63.2%、66.9%、41.1%和7.0%。

图1 细菌群落组成的NMDS分析
2.4 土壤细菌群落特征与土壤化学性质的关系
逐步回归分析发现(表4),9种土壤优势菌中有6种(酸杆菌、绿弯菌、放线菌、浮霉菌、拟杆菌和芽单胞菌)的相对丰度均首先取决于土壤pH,厚壁菌的相对丰度也受土壤pH的影响,仅变形菌和蓝细菌的相对丰度与土壤pH无关。同样,土壤pH也是决定物种丰富度、Chao1指数、系统发育多样性和香农指数的首要因素。土壤肥力状况(TN、AN、AP等)对土壤优势菌相对丰度和细菌多样性的影响相对较弱。
进一步通过MRT分析发现,MRT共解释了83.1%的细菌群落变异(图2)。首先,细菌群落由土壤pH分为两支,当pH≥4.73时CK和NPKM处理分在一支,当pH<4.73时N和NPK处理分在一支,此时pH的解释率为46.3%。进一步地,pH又分别在5.64时和4.09时将CK和NPKM处理、N和NPK处理相互分开,pH的解释率分别为22.4%和14.4%。可见,长期不同施肥后旱地红壤细菌群落变化主要由土壤pH驱动。

表2 长期不同施肥对土壤优势菌相对丰度的影响
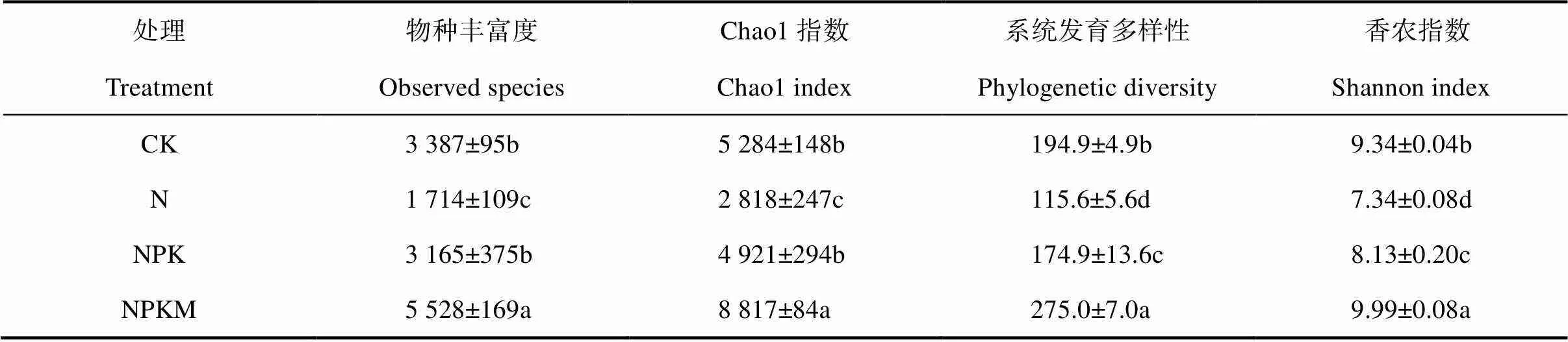
表3 长期不同施肥对土壤细菌多样性的影响
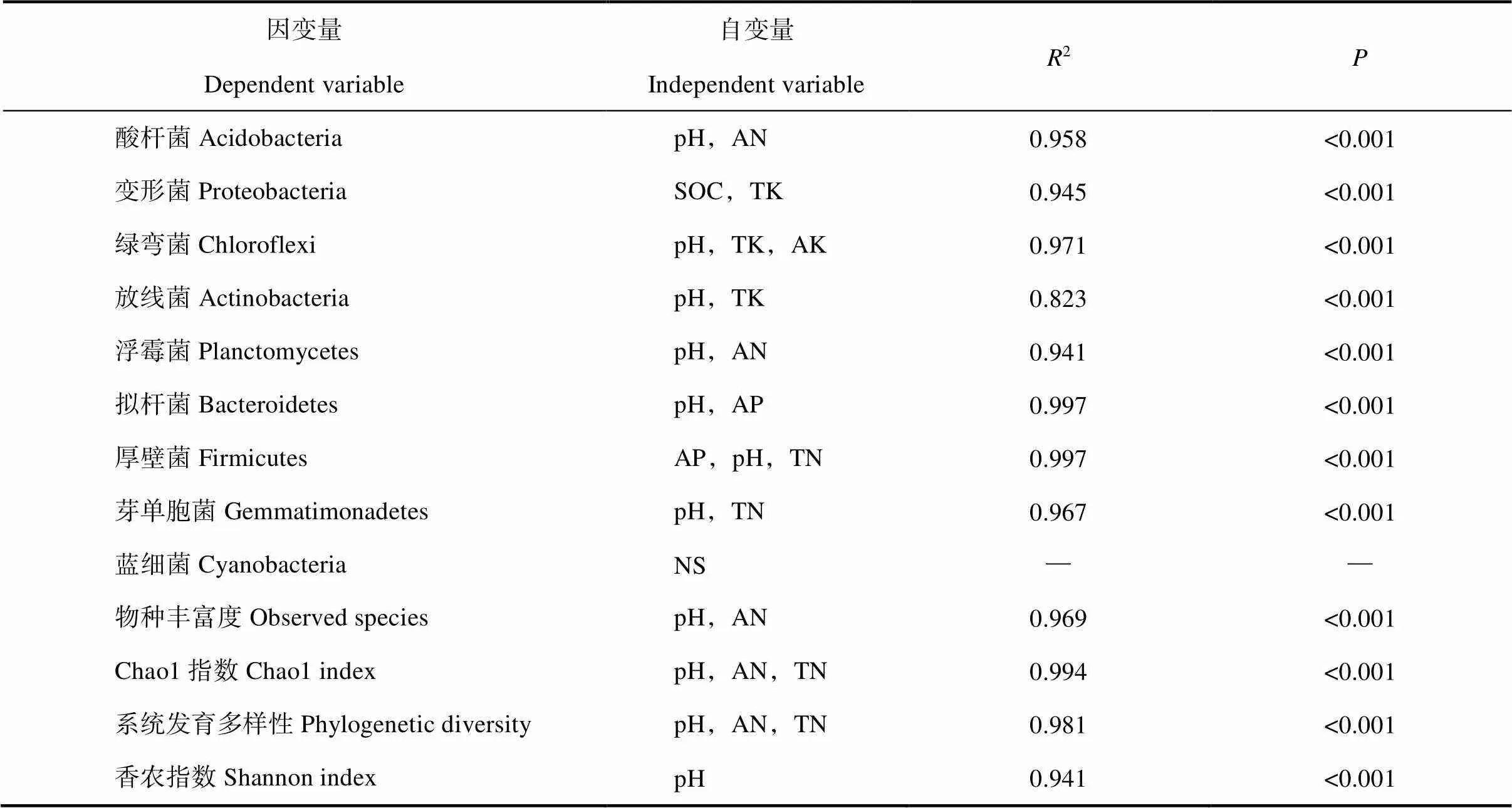
表4 优势菌相对丰度、细菌多样性与土壤化学性质的逐步回归分析
注:NS表示没有与因变量具有显著相关性的自变量。Note:NS indicates no independent variable that has significant correlation with dependent variable.
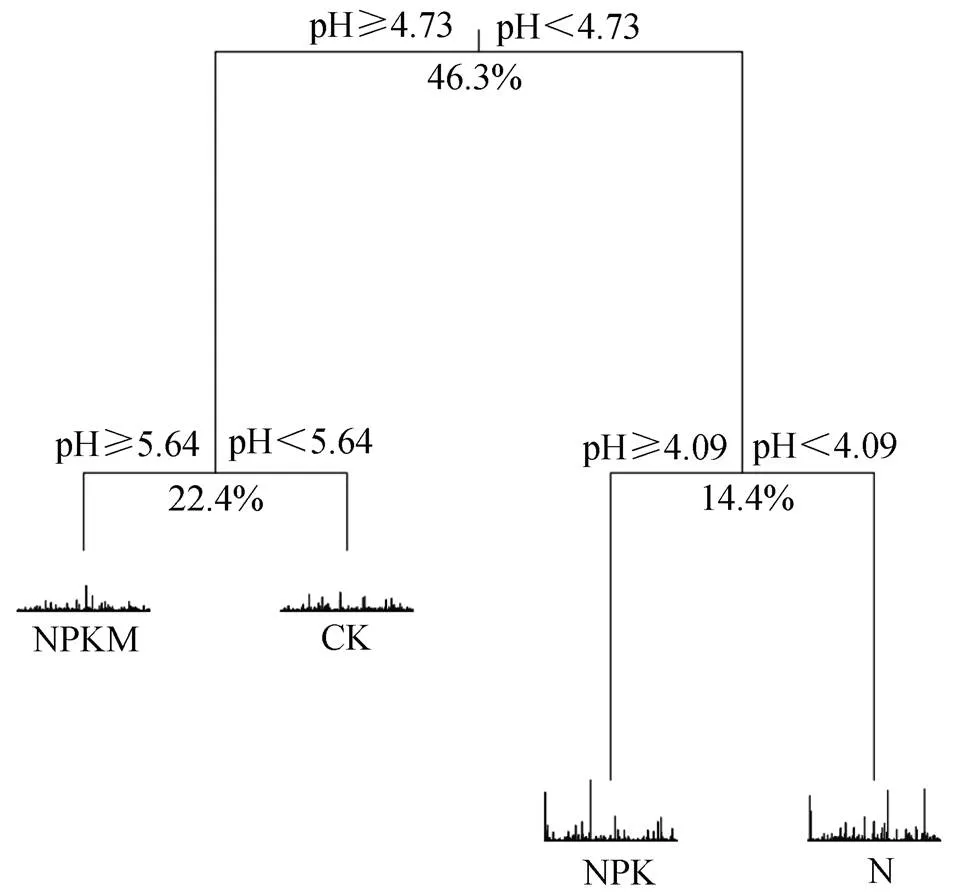
图2 不同处理土壤细菌群落的多元回归树分析
2.5 显著差异物种
在细菌属水平上进行STAMP分析发现(图3),N、NPK和NPKM处理相对于CK分别有11、14和8个显著差异细菌属。与CK相比,N和NPK处理均显著降低了和,显著增加了,而NPKM处理的表现则完全相反。N和NPK处理均显著增加了、和,而N、NPK和NPKM处理均会造成、和的显著降低。
3 讨 论
近几十年来中国农田的土壤酸化现象引起了广泛关注。Guo等[25]通过大范围的调查发现,相比1980s,中国大部分农田的土壤pH在2000s时均显著降低(<0.05)。化学氮肥的大量投入是造成土壤酸化的主要原因。高温多雨的气候特征使得南方红壤本身就经历缓慢的“自然酸化”过程,土壤呈酸性、盐基离子大量淋失、有机质含量低,因而更易遭受由施肥引起的“人为酸化”的影响[2]。本研究也证实,长期施用化学氮肥急剧加速了红壤的酸化进程,N和NPK处理的土壤pH分别下降至4.02和4.15。土壤在不同的酸化阶段,会经历不同元素的缓冲体系,尤其是当pH<4.2时,土壤进入Al缓冲体系使得大量的Al3+被释放出来[26]。因此,N和NPK处理的地上植物和地下微生物可能已遭受Al毒的危害。而在相同施氮量的基础上,用有机氮肥替代70%的化学氮肥则具有良好的改酸效果。有机肥的碱度、有机氮的氨化作用和有机阴离子的脱羧反应是减轻土壤酸度的主要原因[2]。并且,化肥有机肥配施(NPKM处理)也是改善土壤肥力的有效措施,其效果要明显优于NPK处理,而单施氮肥(N处理)不利于土壤肥力的提升。
红壤本身呈酸性,长期自然选择的结果使嗜酸性的酸杆菌具有较高比重。然而经过25 a施肥,NPK和NPKM处理中酸杆菌相对丰度均显著降低,变形菌成为最优势种群,其原因既与土壤pH变化有关,也因为酸杆菌属于典型的贫营养型(即K策略者)细菌[27],大量投入的营养物质会抑制其生长,而变形菌属于富营养型(即r策略者)细菌[28],土壤肥力提升会促进其生长。Sun等[13]研究发现变形菌的相对丰度与土壤碳含量显著正相关,本研究也证实土壤SOC是影响变形菌相对丰度的首要因素(表4)。绿弯菌和放线菌对有机肥施用非常敏感[29],Tian等[30]甚至发现其相对丰度与有机肥的施用量呈负相关关系,本研究也发现NPKM处理显著降低了绿弯菌和放线菌的相对丰度。但拟杆菌和厚壁菌不同,Chaudhry等[31]发现施用有机肥有利于提升其相对丰度,这与本研究结果一致。需要注意的是,与CK相比,NPKM处理中厚壁菌的相对丰度大幅提升了345.9%,且土壤AP的影响居首(表4),Yang等[32]研究也有相似结果。本研究中,长期单施氮肥仅提高土壤TN含量,未从根本上改善土壤肥力状况,但也造成了贫营养型的酸杆菌、富营养型的变形菌以及其他一些菌群相对丰度降低,其原因可能是严重的土壤酸化(N处理土壤pH仅为4.02)对这些微生物产生了强烈的环境胁迫;同样,拟杆菌通常也被认为是富营养型微生物[28],但其相对丰度在NPK处理中显著降低,也是因为土壤pH的胁迫作用超过了肥力改善的促进作用(表4)。
每一种微生物都具有独特的生态位和特殊的生态功能,不同施肥措施造成的显著差异微生物可以表征特殊的环境条件,因此具有很强的指示作用。Ward等[33]发现具有降解土壤中复杂有机化合物的能力,Yu等[34]发现长期秸秆还田显著增加了红壤水稻土中的相对丰度,本研究则证实长期施用猪粪也会增加旱地红壤中的比例,而施用化肥的作用相反,并且受施N、NPK和NPKM的影响效应分别居各处理所有显著差异细菌属的第2、1、1位,因此它有可能作为评价土壤改良效果的敏感微生物指标。、和均属于变形菌,其生态功能与土壤中的氮素固定或转化密切相关,本研究发现N和NPK处理显著增加了他们的相对丰度,但NPKM处理未表现出相似效果,这可能与它们偏好化学氮肥施用后的酸性土壤环境有关[35],也可能是因为NPKM处理的土壤氮素水平最高限制了它们的生态功能发挥[36]。属于变形菌,和属于放线菌,各施肥处理均造成它们的相对丰度降低,表明它们对施肥极其敏感,相关性分析发现它们的相对丰度与TN、AN等土壤养分指标呈(极)显著的负相关关系。
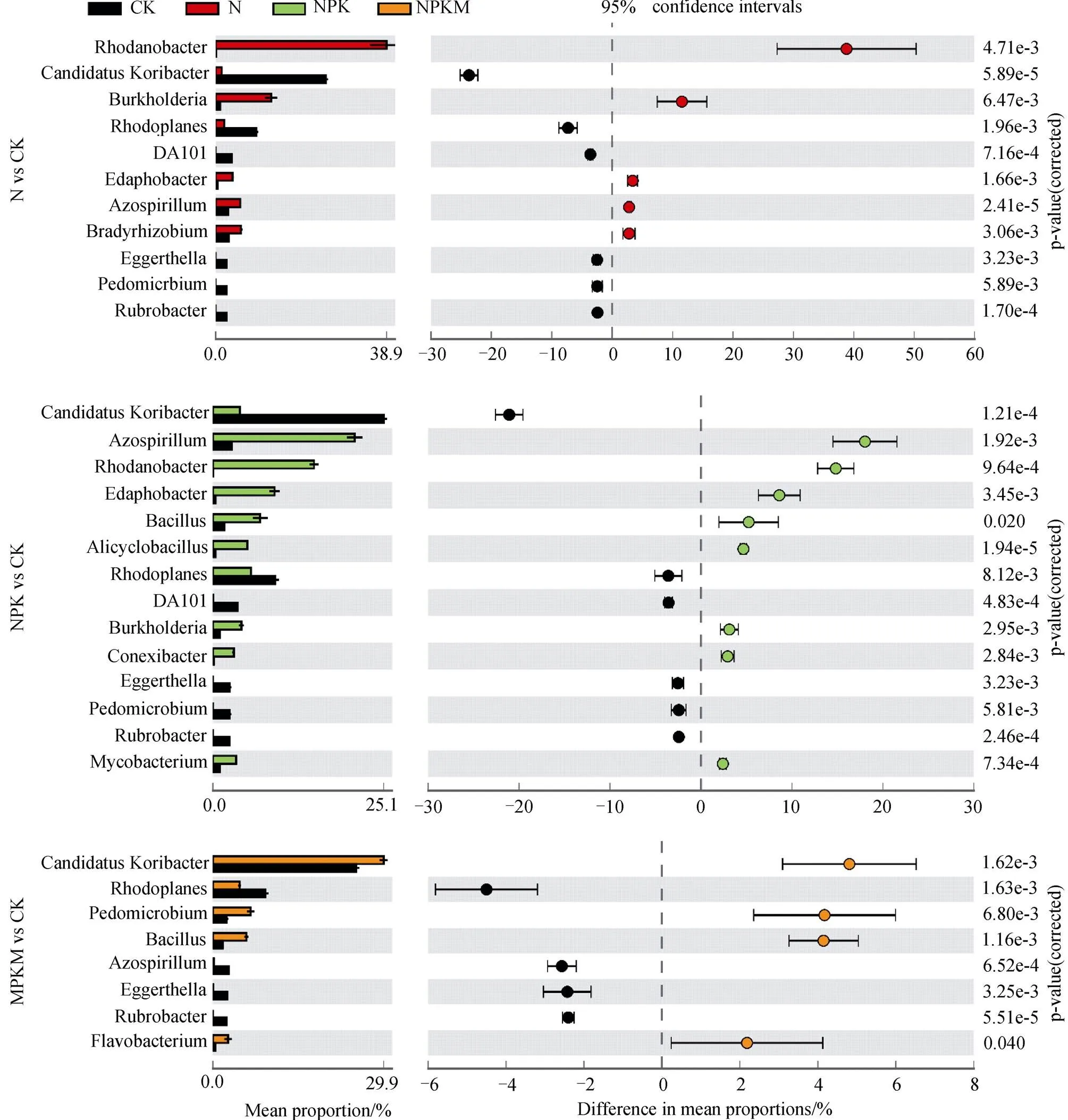
图3 基于STAMP分析的显著差异细菌属
Sun等[13]发现,长期施用猪粪或牛粪有利于维持砂姜黑土的细菌群落组成。本研究也发现,尽管长期不同施肥使旱地红壤的细菌群落发生转变,但CK和NPKM处理仍更相似,N和NPK处理更相似(图2),并且土壤pH是造成这种结果的唯一原因,即两处理细菌群落相似是因为它们具有相近的土壤pH[13]。生物多样性是生态系统稳定的基础,土壤微生物多样性是土壤质量和健康的标志。本研究证明施用有机肥提高了土壤细菌多样性,而单施氮肥会导致其大幅降低。尤其需要注意的是,长期施用化肥氮磷钾也会降低土壤细菌多样性,而“重化肥轻有机肥”正是近几十年来我国农业生产中的普遍现象。土壤细菌多样性的降低,意味着土壤微生物生态功能的缺失,长期发展下去势必会影响生态系统的稳定性和生产力。逐步回归分析发现(表4),决定细菌多样性的首要因素也是土壤pH。
由上述分析可以看出,经过25 a的长期施肥,虽然NPK和NPKM处理显著改善了旱地红壤的土壤肥力,尤其是土壤的速效养分含量(如AP)得到极大提升,但影响土壤优势菌相对丰度、细菌群落组成和多样性的首要因素仍是土壤pH,这与许多研究[7-10]认为是施肥造成的养分变化直接驱动了微生物群落转变的观点不同。造成这种不一致的主要原因是土壤pH的变化幅度,Xun等[37]提出了“橄榄球模型”来解释这种现象:即土壤在近中性环境(以橄榄球的中部表征),土壤养分对细菌群落的转变有较强的驱动作用(橄榄球中部的横截面半径较大,以此表征养分指标驱动作用的强度和方向),随着土壤酸化或碱化的加剧(以橄榄球的两端表征),土壤pH对细菌群落转变的影响越来越大,而土壤养分的作用被逐渐限制(趋向两端,橄榄球横截面的半径缩小)。在本研究中,不同施肥使得旱地红壤pH发生了显著变化,尤其是长期单施化肥急剧加速了土壤酸化,土壤甚至已经进入到危害严重的Al缓冲体系,土壤酸化的负面效应已远超肥力改善的正面效应。而化肥有机肥配施在补充土壤养分的同时,也明显改善了土壤酸度,更促进了土壤养分正面效应的充分发挥。
本研究侧重考察了长期施肥对旱地红壤细菌群落组成和多样性的影响,这对于评估生态系统的稳定性具有指导意义,但就土壤生态功能发挥而言,土壤微生物的数量及活性等也至关重要,这有待将来进一步研究完善。此外,细菌虽然是土壤中种类最多、数量最大且目前研究最广泛的一类微生物,但也不能忽视土壤中其他重要的微生物类群(如古菌、真菌等)以及具有特殊功能的微生物类群(如固氮菌、硝化细菌、解磷菌等),将来也有必要利用高通量测序技术研究它们对长期施肥的响应,这样才能更全面、真实地了解施肥措施对旱地红壤生态系统的影响。
4 结 论
长期施用化肥严重加剧旱地红壤酸化,化肥有机肥配施不仅大幅降低土壤酸度,而且对土壤肥力的改善效果最好。不同施肥措施使旱地红壤细菌群落发生显著变化,长期施用化肥降低了土壤细菌多样性,而化肥有机肥配施明显提高细菌多样性。经分析确定,土壤pH是影响旱地红壤细菌群落的关键因素,土壤肥力的作用相对较弱,长期施用化学氮肥造成的红壤酸化的负面效应已远超肥力改善的正面效应。因此,旱地红壤施肥应以防治土壤酸化为前提,化肥有机肥配施是一项适宜的施肥措施。
[1] Huang G Q,Zhao Q G. Initial exploration of red soil ecology. Acta Ecologica Sinica,2014,34(18):5173—5181. [黄国勤,赵其国. 红壤生态学. 生态学报,2014,34(18):5173—5181.]
[2] Liu J,Liu M,Wu M,et al. Soil pH rather than nutrients drive changes in microbial community following long-term fertilization in acidic Ultisols of Southern China. Journal of Soils and Sediments,2018,18(5):1853—1864.
[3] Xin X L,Qin S W,Zhang J B,et al. Yield,phosphorus use efficiency and balance response to substituting long-term chemical fertilizer use with organic manure in a wheat-maize system. Field Crops Research,2017,208:27—33.
[4] Duan Y H,Xu M G,Gao S D,et al. Nitrogen use efficiency in a wheat–corn cropping system from 15 years of manure and fertilizer applications. Field Crops Research,2014,157:47—56.
[5] Liu J,Chen J R,Xie J,et al. Effects of nitrogen application time on biomass and nitrogen accumulation of peanut in upland red soil. Chinese Journal of Oil Crop Sciences,2017,39(4):515—523. [刘佳,陈静蕊,谢杰,等. 不同施氮时期对红壤旱地花生生物量和氮素累积的影响. 中国油料作物学报,2017,39(4):515—523.]
[6] Kušlienė G,Rasmussen J,Kuzyakov Y,et al. Medium-term response of microbial community to rhizodeposits of white clover and ryegrass and tracing of active processes induced by13C and15N labelled exudates. Soil Biology& Biochemistry,2014,76:22—33.
[7] Chen X F,Li Z P,Liu M,et al. Microbial community and functional diversity associated with different aggregate fractions of a paddy soil fertilized with organic manure and/or NPK fertilizer for 20 years. Journal of Soils and Sediments,2015,15(2):292—301.
[8] Xia X,Shi K,Huang Q R,et al. The changes of microbial community structure in red paddy soil under long-term fertilization. Acta Pedologica Sinica,2015,52(3):697—705. [夏昕,石坤,黄欠如,等. 长期不同施肥条件下红壤性水稻土微生物群落结构的变化. 土壤学报,2015,52(3):697—705.]
[9] Zhang Q,Zhou W,Liang G Q,et al. Distribution of soil nutrients,extracellular enzyme activities and microbial communities across particle-size fractions in a long-term fertilizer experiment. Applied Soil Ecology,2015,94:59—71.
[10] Zhong W H,Gu T,Wang W,et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity. Plant and Soil,2010,326(1/2):511—522.
[11] Xun W B,Zhao J,Xue C,et al. Significant alteration of soil bacterial communities and organic carbon decomposition by different long-term fertilization management conditions of extremely low-productivity arable soil in South China. Environmental Microbiology,2016,18(6):1907—1917.
[12] Zeng J,Liu X J,Song L,et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition. Soil Biology & Biochemistry,2016,92:41—49.
[13] Sun R B,Zhang X X,Guo X S,et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw. Soil Biology & Biochemistry,2015,88:9—18.
[14] Ma X Y,Liu M,Li Z P. Shifts in microbial biomass and community composition in subtropical paddy soils under a gradient of manure amendment. Biology and Fertility of Soils,2016,52(6):775—787.
[15] Xia W W,Jia Z J. Comparative analysis of soil microbial communities by pyrosequencing and DGGE. Acta Microbiologica Sinica,2014,54(12):1489-1499. [夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价. 微生物学报,2014,54(12):1489—1499.]
[16] Liu K L,Huang J,Zhang H M,et al. Effect of long-term fertilization on aggregation characteristics and distribution of potassium fractions in red soil. Acta Pedologica Sinica,2018,55(2):443—454. [柳开楼,黄晶,张会民,等. 长期施肥对红壤旱地团聚体特性及不同组分钾素分配的影响. 土壤学报,2018,55(2):443—454.]
[17] Cai Z J,Wang B R,Xu M G,et al. Intensified soil acidification from chemical N fertilization and prevention by manure in an 18-year field experiment in the red soil of Southern China. Journal of Soils and Sediments,2015,15(2):260—270.
[18] Lu R K. Analytical methods for soil and agro-chemistry. Beijing:China Agricultural Science and Technology Press,2000. [鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社,2000.]
[19] Biddle J F,Fitz-Gibbon S,Schuster S C,et al. Metagenomic signatures of theMargin subseafloor biosphere show a genetically distinct environment. Proceedings of the National Academy of Sciences of the United States of America,2008,105(30):10583—10588.
[20] Caporaso J G,Kuczynski J,Stombaugh J,et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods,2010,7(5):335—336.
[21] Sun R B,Guo X S,Wang D Z,et al. The impact of long-term application of chemical fertilizers and straw returning on soil bacterial community. Microbiology China,2015,42(10):2049—2057. [孙瑞波,郭熙盛,王道中,等. 长期施用化肥及秸秆还田对砂姜黑土细菌群落的影响. 微生物学通报,2015,42(10):2049—2057.]
[22] Clarke K R. Non-parametric multivariate analyses of changes in community structure. Austral Ecology,1993,18(1):117—143.
[23] De’Ath G. Multivariate regression trees:A new technique for modeling species–environment relationships. Ecology,2002,83(4):1105—1117.
[24] Parks D H,Tyson G W,Hugenholtz P,et al. STAMP:Statistical analysis of taxonomic and functional profiles. Bioinformatics,2014,30(21):3123—3124.
[25] Guo J H,Liu X J,Zhang Y,et al. Significant acidification in major Chinese croplands. Science,2010,327(5968):1008—1010.
[26] Ulrich B. Natural and anthropogenic components of soil acidification. Journal of Plant Nutrition and Soil Science,1986,149(6):702—717.
[27] Fierer N,Lauber C L,Ramirez K S,et al. Comparative metagenomic,phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients. The ISME Journal,2012,6(5):1007—1017.
[28] Fierer N,Bradford M A,Jackson R B. Toward an ecological classification of soil bacteria. Ecology,2007,88(6):1354—1364.
[29] Sun J,Zhang Q,Zhou J,et al. Pyrosequencing technology reveals the impact of different manure doses on the bacterial community in apple rhizosphere soil. Applied Soil Ecology,2014,78:28—36.
[30] Tian W,Zhang Z H,Hu X F,et al. Short-term changes in total heavy metal concentration and bacterial community composition after replicated and heavy application of pig manure-based compost in an organic vegetable production system. Biology and Fertility of Soils,2015,51(5):593—603.
[31] Chaudhry V,Rehman A,Mishra A,et al. Changes in bacterial community structure of agricultural land due to long-term organic and chemical amendments. Microbial Ecology,2012,64(2):450—460.
[32] Yang Y R,Li X G,Liu J G,et al. Bacterial diversity as affected by application of manure in red soils of subtropical China. Biology and Fertility of Soils,2017,53(6):639—649.
[33] Ward N L,Challacombe J F,Janssen P H,et al. Three genomes from the Phylum acidobacteria provide insight into the lifestyles of these microorganisms in soils. Applied and Environmental Microbiology,2009,75(7):2046—2056.
[34] Yu Y J,Wu M,Petropoulos E,et al. Responses of paddy soil bacterial community assembly to different long-term fertilizations in southeast China. Science of the Total Environment,2019,656:625—633.
[35] van den Heuvel R N,van der Biezen E,Jetten M S M,et al. Denitrification at pH 4 by a soil-derived-dominated community. Environmental Microbiology,2010,12(12):3264—3271.
[36]Ikeda S,Sasaki K,Okubo T,et al. Low nitrogen fertilization adapts rice root microbiome to low nutrient environment by changing biogeochemical functions. Microbes and Environments,2014,29(1):50—59.
[37] Xun W B,Huang T,Zhao J,et al. Environmental conditions rather than microbial inoculum composition determine the bacterial composition,microbial biomass and enzymatic activity of reconstructed soil microbial communities. Soil Biology & Biochemistry,2015,90:10—18.
Effects of Long-Term Fertilization on Bacterial Community in Upland Red Soil
LIU Jia1, 2, 3, CHEN Xiaofen1, 2, 3, LIU Ming1, WU Meng1, WANG Boren4, 5, CAI Zejiang4, 5, ZHANG Taolin1, 2, LI Zhongpei1, 2†
(1. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Soil and Fertilizer & Resources and Environment Institute,Jiangxi Academy of Agricultural Sciences, National Engineering & Technology Research Center for Red Soil Improvement, Nanchang 330200, China; 4.Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China; 5. National Observation Station of Qiyang Agro-ecology System, Qiyang,Hunan 426182,China)
Fertilization is an effective measure to improve soil fertility and increase crop yield in red soil. As important components of a soil ecosystem, soil microorganisms play an essential role in soil fertility formation, organic matter decomposition, and nutrient biogeochemical recycling as well. However, though soil microorganisms are very sensitive to fertilization, limited information is available in the literature about effects of fertilization on the microbial community in upland red soil. The objective of this study is to investigate responses of the bacterial community in upland red soil to long-term fertilization varying in strategy, and to provide a theoretical basis for rational fertilization and sustainable utilization of the red soil in South China.In this study, a long-term field fertilization experiment (established in 1990) on winter wheat–summer maize rotation at the Qiyang Red Soil Experimental Station of the Chinese Academy of Agricultural Sciences was carried out.The experiment had four treatments, i.e. no fertilizer (CK), only application of chemical nitrogen fertilizer (N), application of chemical nitrogen, phosphorus and potassium fertilizer (NPK), and application of NPK plus manure (NPKM). Except CK, all the treatments
N 300 kg·hm–2·a–1, and the N in Treatment NPKM had 30% coming from chemical fertilizer and the rest from manure. Samples of surface soil (0~20 cm) were collected in May 2015 (after wheat was harvested and before maize was planted). The technology of high-throughput sequencing of the V4-V5 16S rRNA gene region were used to determine composition and diversity of the soil bacterial community in the samples, and then to identify key factors affecting the bacterial community in the upland red soil.Results show: (1) Long-term fertilization significantly changed chemical properties of the upland red soil. Compared with CK, Treatments N and NPK declined significantly or down to 4.02 and 4.15, respectively, in soil pH, while Treatment NPKM increased significantly or up to 5. 99. Both NPK and NPKM significantly improved soil fertility, but the effect of the latter was much better than the former. However, Treatment N only increased soil TN content, which was not conducive to soil fertility; (2) Long-term fertilization affected relative abundance of the soil dominant bacteria at the phylum level. Non-metric multidimensional scaling (NMDS) and similarity analysis (ANOSIM) shows that soil bacterial communities in the treatments varied significantly; (3) Compared with CK, Treatment N was 21.4%~49.4% lower in the four diversity indices (observed species, Chao1 index, phylogenetic diversity and Shannon index), while Treatment NPKM was 7.0%~66.9% higher. Besides, Treatment NPK was 10.3% and 13.0% lower, respectively in phylogenetic diversity and Shannon index; (4) Stepwise regression analysis shows that soil pH was the primary factor determining relative abundance of the dominant soil bacterial phyla and four diversity indices of the soil bacterial community. Furthermore, multivariate regression tree (MRT) analysis shows that soil pH explained 83.1% of the detected variation of the soil bacterial communities between the treatments, and differentiation of the bacterial community was driven by soil pH; and (5) Compared with CK, statistical analysis of metagenomic profiles (STAMP) shows that Treatment N, NPK and NPKM had 11, 14 and 8 treatment-specific bacterial genera, respectively.In conclusion, the bacterial community in the upland red soil following long-term fertilization is mainly affected by soil pH, and the negative effects of soil acidification induced by long-term fertilization may have far exceeded the positive effects of fertility improvement. Therefore, fertilization in upland red soil should be based on the premise of prevention of soil acidification, and combined application of chemical fertilizer and manure is a suitable fertilization measure.
Long-term fertilization; Upland red soil; Bacterial community; High-throughput sequencing; Soil pH
S154.3
A
10.11766/trxb201810090507
刘佳,陈晓芬,刘明,吴萌,王伯仁,蔡泽江,张桃林,李忠佩. 长期施肥对旱地红壤细菌群落的影响[J]. 土壤学报,2020,57(2):468–478.
LIU Jia,CHEN Xiaofen,LIU Ming,WU Meng,WANG Boren,CAI Zejiang,ZHANG Taolin,LI Zhongpei. Effects of Long-Term Fertilization on Bacterial Community in Upland Red Soil[J]. Acta Pedologica Sinica,2020,57(2):468–478.
* 国家自然科学基金项目(41661052,31660599)、国家重点基础研究发展计划(973计划)项目(2014CB441003)和“一三五”计划和领域前沿项目(ISSASIP1642)资助 Supported by the National Natural Science Foundation of China(Nos. 41661052 and 31660599),the National Basic Research Program(973 Program)of China(No. 2014CB441003)and the “135”Plan and Field Frontier Project(No. ISSASIP1642)
,E-mail:zhpli@issas.ac.cn
刘 佳(1984—),男,安徽六安人,博士研究生,主要从事红壤酸化及有机质转化研究。E-mail:liujia422@126.com
2018–10–09;
2019–01–20;
优先数字出版日期(www.cnki.net):2019–02–26
(责任编辑:卢 萍)

