药物微生物组学:肠道微生物与个体化用药
黄卫华,张伟
(中南大学湘雅医院临床药理研究所,湖南 长沙 410008)
美国国家研究委员会(National Research Counsil,NRC)在2011 年提出了精准医学这一新概念,引起了全世界医学研究人员和临床医生的广泛关注。精准医疗(precision medicine)是以个体化医疗为基础将个体遗传基因、生活环境与习惯差异考虑在内的疾病预防与治疗的新兴方法。精准医学区别于基因组医学,后者主要利用患者的个体基因组信息进行疾病治疗,而精准医学不仅涉及基因组学、转录组学、蛋白质组学和代谢组学,还包括了个体生活方式、肠道菌群等环境因素。
过去几十年,药物基因组学以药物效应及安全性为目标,研究各种基因变异与药效及安全性的关系。现有遗传药理学和药物基因组学研究只能解释药物反应中约60%的个体差异[1]。因此,更加系统全面地解释药物反应的个体差异,需要探索更多与精准医学相关因素(如肠道菌群)。
近年来,肠道微生物因其在人体中的重要作用被认为是人类的第二基因组[2]。个体共生肠道微生物约500 ~ 1 500 种,其中大部分是厌氧菌,少数为古细菌、病毒等[3]。人类肠道菌群中最主要菌属有:拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、梭菌属(Clostridium)、真细菌属(Eubacterium)、埃希菌属(Escherichia)、梭杆菌属(Fusobacterium)、乳杆菌属(Lactobacillus)和消化链球菌属(Peptostreptococcus),但其α-多样性和β-多样性具有很大的个体差异[4]。越来越多的研究表明,肠道菌群在药物的药效学和药代动力学中扮演着重要角色[5-7],因此,人体肠道菌群或许可以为特定药物反应的个体差异提供一个合理的解释[8-10]。
药物微生物组学(pharmacomicrobiomics)主要研究人体微生物差异如何影响药物的吸收、分布、代谢、排泄(ADME)和毒性。毋庸置疑,肠道微生物在药物的安全性和有效性方面的贡献将为精准医学的发展开启新纪元[1,3]。
1 药物微生物组学
药物微生物组学是药物基因组学的自然延伸,是精准医学的特定分支领域,不仅从微生物群落层面还从基因组层面研究药物与人体微生物之间的相互作用;其一方面关注肠道微生物如何通过影响药物的生物转化以及药物的ADME 等影响药代动力学和药效学[1,11];另一方面关注药物改变菌群的结构和功能从而影响药物效应和安全。
1.1 药物微生物组学的发展
2007 年底美国国立卫生研究院(National Institutes of Health,NIH)宣布正式启动酝酿了2年之久的人类微生物组计划(Human Microbiome Program,HMP)[12]。该计划的重点是通过元基因组学的方法研究人体内的微生物群的结构变化与人类健康之间的关系[13-14]。针对药物的生物转化和生物降解与微生物之间的相互作用已开展了大量的研究[3],而药物微生物组学是2010 年出现的一个新概念。HMP 促进了药物微生物组学的产生与发展,使之前分散的药物微生物学研究更加系统[15-17]。
最初,肠道微生物的基因组测序只是用来分析肠道中的微生物类别,由于肠道生态系统非常复杂且肠道微生物与宿主之间存在共生关系,故无法推断其具体的功能和生物学活性[18]。因此,仅通过基因组测序技术来构建一个健康人共有的“核心微生物组”非常之艰难,以致药物微生物基因组学的发展似乎进入了瓶颈期。随着高通量测序和宏基因组学等新研究方法的不断发展和应用,药物微生物组学取得了新的突破,基于种属和基因水平上展开研究,发现肠道微生物的组成因人而异,但其基因所编码的酶代谢等功能却相对稳定,这为药物微生物基因组学的进一步研究提供了可能[19-20]。
药物微生物组学与生物信息学、系统药理学和毒理学的结合扩大了个体化医学的范筹[21-22]。在不久的将来,药物微生物组学将为新药设计和精确治疗的发展提供巨大的推动力[15,23]。
1.2 肠道微生物
肠道微生物主要指寄居在人体胃肠道的真核微生物(如噬菌体、古细菌和真菌)以及一些病毒,肠道微生物与肠道微生物组是2 个不同的概念,有“人类的第二大脑”之称的肠道微生物组是指肠道微生物携带的基因,但是目前微生物组也常用于指代微生物本身[24-25]。近年来,这个由数亿微生物聚集形成的“超级生物体”吸引了国内外研究者广泛关注[24]。肠道黏膜表面以及肠腔内生活着1 000 多种微生物,其组成非常丰富[4],主要可以分三大纲类,即古细菌纲(Aarchaea)、细菌纲(Bacteria)和真菌纲(Eucarya)。
随着测序技术的发展,元基因组学取得了许多突破性进展,肠道微生物这一复杂生物体的神秘面纱被逐步揭开。肠道微生物组编码大约330 万个特定基因,是人类基因组编码基因数量的100 倍以上[26]。因此,肠道微生物组被认为是人体的第二基因组,其与人类基因组通过与环境因素交互作用以不同方式影响人类的健康。人类遗传基因组之间的序列差异仅约0.1%,但不同个体之间肠道微生物群的差异可达到 80% ~ 90%[27]。
来自欧洲生物信息学研究所的研究人员新发现了近2 000 种生活在人类肠道中的细菌,重建了来自11 850 个人类肠道微生物组中的92 143 个基因组[28-29]。这些新鉴定的基因组大大扩展了人类集体肠道微生物已知的物种谱,为人类肠道微生物基因组谱写了新的蓝图。
1.2.1 肠道微生物的个体差异 虽然人体肠道微生物的主要组成类群非常相似,但在不同宿主个体间,不同微生物类群的相对丰度和菌株种类存在很大差异[30]。了解肠道菌群个体间差异对各种疾病的危险因素或生物标志物的影响,将为深入了解宿主与微生物在人类健康和疾病中的相互作用提供帮助[31]。大量研究发现,肠道菌群组成失衡与糖尿病、肥胖症和癌症等疾病之间存在密切相关性[32-34]。与人类基因组相比,微生物组具有更大的可塑性,或许可以成为目前医学难题的突破口[11]。肠道菌群结构和多样性受到许多因素的影响,比如宿主的饮食习惯、药物使用、地域、年龄和生理状况等[35]。
不同人群由于膳食习惯的不同,对于膳食因子的摄入有很大不同,由此引起的肠道微生物组成、结构与功能也会存在较大差异[36]。随着肠型这一概念的提出与发展,人们对肠道微生物物种组成和功能的认知快速增加,目前的研究将肠型分为拟杆菌型(ETB)、普雷奥氏菌型(ETP)和瘤胃球菌型(ETF)3 类[37]。人体肠道中核心菌群与膳食模式中蛋白、脂肪和糖类成分的比例有关[37]。对欧洲儿童(西方特色饮食)及非洲儿童(非洲农村饮食)的肠道微生物研究表明,相比于欧洲儿童,非洲儿童肠道微生物种群中厚壁菌门丰度偏低而拟杆菌门则偏高[38]。
药物,尤其是抗生素、质子泵抑制剂等会对肠道微生物组产生巨大影响,这是导致肠道微生物个体差异的主要原因之一[8]。许多其他因素[例如性别、身体质量指数(BMI)、睡眠和运动]可以解释个体间差异,但无法说明个体内的差异[9]。
研究表明,不同人同一部位的微生物群落组成差异很大,同一个人的不同部位的微生物群落组成也显著不同[8]。比如,口腔、食道、胃以及大小肠中的微生物无论是在种类还是丰度上均明显不同。小肠中主要存在消化链球菌属,而这类菌在大肠中很少见[8,39]。小肠中还有大量专门用于消化简单的碳水化合物的富含革兰阳性微生物[8,39]。大肠中的微生物种类最丰富,微生物代谢主要发生在该器官[36]。
肠道菌群的组成会随年龄而变化。分娩方式会影响婴儿的微生物定植,自然分娩的婴儿出生几天后就含有大量的乳酸菌[40]。婴儿体内微生物的多样性通常很低。随着年龄的增长人体微生物的种类和数量均会增加,约2.5 岁时,人类肠道微生物组的组成、多样性和功能就会与成年人的相似,并在此后保持一个相对稳定的状态,直到65 岁以后,人体中的拟杆菌属和梭菌属IV(ClostridiumIV)的含量会增加[8,40]。在没有其他因素影响的情况下,微生物群落的不同可为儿童和成人之间药物反应的某些差异提供一个合理解释。
1.2.2 肠道微生物与个体化医学 人类基因组计划(HGP)于2003 年完成后,许多科学家已经意识到解密人类基因组并不能完全掌握人类疾病和健康的关系,因为人类对在其体内存活了数百万年共生微生物菌群知之甚少。人类遗传变异占编码基因序列的一小部分,而这些变异并不能完全解释人类之间巨大的表型变异[8]。遗传等因素不能完全解释药物反应个体差异,大多数口服药物在被吸收之前可能与肠道微生物接触,故了解肠道微生物与药物之间复杂的相互作用,以及特定微生物如何影响药物的代谢和功效将更好地实施个体化治疗[12,41-42]。微生物基因组与代谢能力之间的因果关系将人类微生物组变异与药物代谢中的个体差异联系起来,对多种疾病适应证的药物治疗和药物开发具有意义。同时,有研究证明营养不良会影响肠道微生物的结构与功能,进而影响人体免疫以及传染性和代谢性疾病的发生与发展。当宿主摄入的食物改变肠道微生物的代谢功能时,宿主的表观遗传特征也会随之发生变化。例如,肠道微生物可以影响地高辛的代谢及其功效;影响维生素K2 的吸收来影响华法林的吸收;通过增加初级胆汁酸的含量,调节肝脏中趋化因子依赖性的自然杀伤T 细胞(NKT)积累等[43]。
改变一个人的遗传基因是非常困难的,但改变人体微生物则相对较容易。肠道微生物组将成为个体化医学发展的重要分支,调节肠道菌群可为实现治疗药物效应和安全性的个性化设计提供一种新策略[9]。微生物基因组学研究成果将推动疾病诊断、健康管理和精准医学等多个领域的发展。个体化的治疗计划的制定和实施与微生物检测及差异菌群分析密切相关。
2 肠道微生物在药物微生物组学发展中的作用
2.1 药物生物转化
肠道微生物在药物代谢中发挥重要作用,可以将药物代谢为不同活性、毒性和生物利用度的代谢产物。研究人员检测了76 种不同的人类肠道细菌对271 种口服药物的代谢能力,发现这些药物至少可以被一种细菌进行生物转化,而且每个细菌菌株均能够代谢11 ~ 95 种不同的药物[44]。随后将高通量测序技术与质谱联用,系统地鉴定药物被微生物代谢转化的产物。微生物组编码的酶可以直接并显著地影响小鼠的药物代谢,并且可以基于其基因组解释人类肠道菌群的药物代谢活性[44]。肠道微生物分泌转化代谢药物的酶与人体肝药酶存在较大差异,过去人们极少关注肠道微生物对药物的影响,但是随着人类微生物组计划的提出,一些研究者开始对相关机制进行系统研究,并取得一系列重要进展。口服药物可以通过上消化道、小肠和大肠,从而不可避免地与肠道微生物发生交互作用。
微生物通过改变药物的化学结构来影响药物的生物利用度和活性,进而影响药物的疗效和安全性[1,45]。肠道细菌对药物的影响与肝药酶有所不同,肝脏中的酶通常会发生氧化和结合反应,而肠道微生物则主要通过水解和还原反应来改变药物结构[1,45](见图1 和表1)。肠道微生物主要影响药物转运至目标组织,通过胆道系统排入肠腔,或经肾脏排泄到尿液中[21]。近期的一项研究表明,肠道菌群对药物代谢作用的影响为健康志愿者体内药代动力学个体间差异提供了一个合理解释[1,21]。

图1 口服或静脉给药后药物的代谢部位和类型Figure 1 Sites and types of metabolism for drugs after oral or intravenous administration

表1 肠道微生物介导的药物代谢Table 1 Gut microbiota-mediated drug metabolism
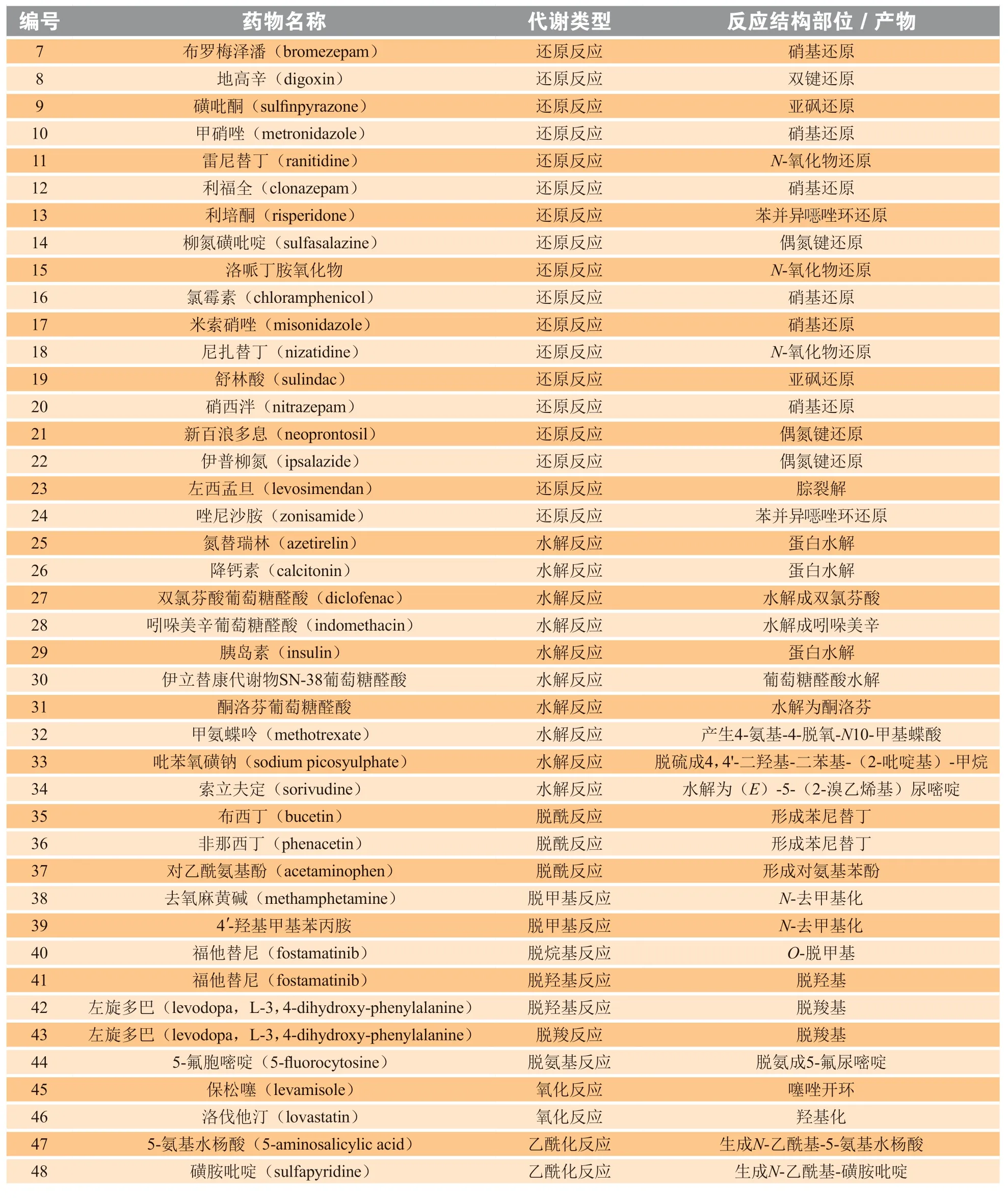
续表1
2.1.1 前药的生物转化 百浪多息是一种具有抗菌作用的经典前药,最初发现其对溶血性链球菌感染可能产生影响,其在体外没有抗菌作用,其体内活性是由于细菌偶氮还原酶分解了偶氮键并释放了具有抗菌活性的磺酰胺[1]。随后,科学家根据这一发现开发了一系列含有偶氮键并需要进行生物转化的前药,例如柳氮磺吡啶[46]。柳氮磺吡啶中的偶氮键需要在特定的肠道微生物作用下才能释放出具有抗炎活性的磺胺吡啶和5-氨基水杨酸[1,46]。
洛伐他汀是一种无活性的前药,需要在体内将内酯环水解为开链β-羟基酸衍生物才能发挥抑制胆固醇合成酶的作用,肠道菌群则可以通过水解和还原反应对其进行转化代谢[47]。近期的一项研究发现,抗生素会降低洛伐他汀的生物利用度,这进一步证实了肠道微生物在洛伐他汀转化代谢中的重要作用[47]。
2.1.2 药物的ADME 肠道菌群对药代动力学的影响可以通过4 个步骤发生,即吸收、分布、代谢和排泄。肠道微生物可能会通过影响肠道中的转运蛋白来影响药物的转运,但很少有报道。因此,这里主要讨论肠道微生物对药物吸收和代谢的影响。
格列齐特是一种用于治疗糖尿病的磺酰脲类药物,益生菌可以增加该药物的吸收[40]。糖尿病大鼠服用益生菌3 d 后,肠道微生物的组成和丰度均有明显变化,且血液中的格列齐特含量(75 mg · kg-1)高于未服用益生菌的大鼠,这表明肠道微生物可能会影响药物吸收。Hira 等[48]发现连续3 d 服用乳酸菌K8 可以调节肠道微生物的酶活性,从而降低小鼠对乙酰氨基酚的吸收。这可归因于益生菌显著增加硫酸盐和芳基硫酸盐转移酶,并减少催化对乙酰氨基酚代谢所需的β-葡萄糖醛酸苷酶[48-49]。此外,服用益生菌可以使大鼠体内胺碘酮的血浆水平增加,但肠道微生物在其中的具体机制尚未阐明[50-51]。肠道菌在中药成分的转化吸收中起着重要作用,笔者所在课题组前期研究中,收集高脂-高蛋白质(HFHP)人群和低脂-高纤维(LF-PF)人群的粪便样本,提取肠道微生物与三七皂苷进行体外孵育,用高效液相色谱与二极管阵列/四极杆串联飞行时间质谱(LC-DAD-Q-TOF-MS/MS)进行检测,采用16S rRNA 扩增子测序结果进行综合分析发现,三七皂苷的代谢差异与肠道菌群多样性具有相关性[52]。SD大鼠实验发现,伪无菌组大鼠血浆中三七皂苷活性代谢产物的浓度较正常组具有非常显著差异[53]。
已有大量研究证明肠道微生物影响药物代谢。用于治疗心力衰竭和心律不齐的地高辛可被迟缓埃格特菌(Eggerthella lenta)产生的黄素依赖性的还原酶代谢为无活性二氢地高辛,增加无菌小鼠饮食蛋白的摄入量可以抑制该酶的代谢活性[40,54]。氨氯地平是一种用于治疗高血压和冠状动脉疾病的药物,主要被肠道菌群代谢,氨苄西林可以减少胃肠道微生物对氨氯地平转化进而提高其大鼠血浆内的浓度水平[40]。此外,有文献报道阿司匹林的抗血栓作用似乎也受到肠道菌群的影响[55-56]。抗肿瘤药物多柔比星可被植生拉乌尔菌(Raoultella planticola)代谢为7-脱氧多柔比辛醇和7-脱氧阿霉素[55-56]。
2.2 药物治疗
已有研究发现肠道菌群对药物治疗的影响,但过去对于该领域关注较少。随着HMP 的实施,人们进一步了解到肠道菌群对药物的剂量、毒性和耐药性等均有影响,这些发现可以指导毒理学的风险评估,最终将推动精准医学的发展。
2.2.1 药物剂量 肠道菌群会影响药物剂量。同时使用抗生素会使华法林的国际标准化比率(INR)偏高,增加出血的风险[57],因为一些合成维生素K2 的肠道细菌被抗生素杀死,而维生素K 是肝脏中凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ合成的关键因素,故应根据凝血因子的减少而相应减少华法林的剂量[57];乳果糖氢呼气试验显示,肠道微生物较多的阳性患者的华法林剂量约是阴性患者的2 倍[58],这进一步证明肠道细菌可通过影响维生素K2 的吸收速率来影响华法林剂量[57-58]。
2.2.2 药物耐受 药物耐药会极大地降低药物的疗效。洋地黄的活性物质地高辛可治疗充血性心力衰竭和心律不齐,但是超过10%的患者会对该药物产生抗药性,耐药者粪便中含有高浓度无活性代谢产物二氢地高辛[59]。体外共孵育实验发现,迟缓埃格特菌会降低地高辛浓度,且使用广谱抗生素可以增加地高辛的血药浓度;进一步的基因测序分析发现,黄素依赖性的还原酶可以将地高辛代谢为无活性的二氢地高辛[59]。
用于治疗帕金森病的左旋多巴的吸收会受到幽门螺杆菌的影响,因为幽门螺杆菌破坏了十二指肠黏膜,而十二指肠黏膜是左旋多巴吸收的主要部位[60]。此外,幽门螺杆菌引起的局部炎症以及活性氧的释放增加会使左旋多巴失活[60-61]。因此,抑制幽门螺杆菌可以增加左旋多巴的吸收进而改善帕金森病患者的疗效。
2.2.3 药物效应 二甲双胍是治疗2 型糖尿病的经典药物,但其具体机制尚不清楚[62]。一些研究表明肠道菌群可能是二甲双胍的功能靶标[62-63]。笔者所在课题组前期用广谱抗生素处理大鼠后,发现二甲双胍改善高血糖、高血脂、胰岛素抵抗以及肝脏脂质沉积的作用在伪无菌大鼠体内均显著降低[63]。
肠道菌群与肿瘤治疗的“新星”—— 免疫抑制剂之间也存在非常密切的关系[62]。例如,用抗淋巴细胞相关抗原4 单克隆体(CTLA-4)治疗MCA205肉瘤时,正常SPF 小鼠的肉瘤生长受到抑制,而用抗生素模拟的无菌小鼠和伪无菌小鼠体内的肉瘤生长则不受抑制,两组之间最大的区别是肠道细菌的存在与否[64]。此外,16S rRNA 测序分析发现,患者体内的脆弱拟杆菌(Bacteroides fragilis)丰度与药物疗效及特异T 细胞免疫应答率成正比,因此推测CTLA-4 抗体的抗肿瘤作用与脆弱拟杆菌的丰度有关[64]。与前述研究相似,程序性死亡蛋白配体-1(PD-L1)抑制剂治疗黑色素瘤的疗效与患者体内的双歧杆菌的丰度直接相关,可将其用作PD-L1 抑制剂疗效的预测指标[65]。
2.2.4 药物毒性 当药物在肠道微生物作用下生成有害的代谢产物时,则会发生毒性反应。常见的结肠癌化疗药物伊立替康(CTP-11)是最著名的例子之一,在肠道微生物产生的β-葡萄糖醛酸苷酶作用下,高达80%的CTP-11 使用者会发生严重腹泻[1,66]。CPT-11 主要在肝脏中被羧酸酯酶代谢,从而产生抑制DNA 复制的细胞毒性代谢物SN-38,而SN-38在肝脏中被UDP-葡萄糖醛酸转移酶(UGT)酸化为无活性形式SN-38G;SN-38G 通过胆管排泄到肠中,肠道中微生物产生的β-葡萄糖醛酸苷酶将其重新激活为SN-38,而SN-38 对肠上皮细胞具有副作用进而引起腹泻[1,66]。与前者机制类似,非甾体类抗炎药(NSAID)在β-葡萄糖醛酸苷酶的作用下也会产生胃肠道毒性反应,导致多达50%的使用者产生胃十二指肠黏膜损伤[67]。乙酰胆碱酯酶抑制剂他克林可以诱导转氨酶活性增加,因而具有明显的肝毒性[68]。代谢组学研究发现,他克林诱导的肝毒性与肠道微生物具有明显相关性。分析表明,具有严重不良反应的患者去葡萄糖醛酸能力更强,β-葡萄糖醛酸苷酶基因丰度在不同反应者之间的差异仅9%,因此这种去葡萄糖醛酸能力的差异可归因于肠道微生物的组成差异(例如,乳酸杆菌属、拟杆菌属和肠杆菌属)[68]。他克林与大肠埃希菌(Escherichia coli)产生的β-葡萄糖醛酸苷酶共同给药,可显著增加转氨酶的体内敏感性,而用可杀灭肠道微生物的万古霉素和亚胺培南的预处理后则得到相反的结果,因此推断肠道菌群会影响他克林的肝毒性[9,68]。
2.3 肠道微生物的干预治疗
通常,肠道菌群可大致分为3 类,即有益菌、有害菌和中性菌。大量研究证明,人体健康与肠道菌群密切相关,肠道菌群失调与多种疾病相关,例如肥胖、糖尿病、肝病和肠炎等[69]。因此,保持肠道菌群平衡对机体健康具有重要意义。目前,常见的干预方法有益生菌和益生元、粪便菌群移植和抗生素[70-72]。
2.3.1 益生菌和益生元 目前使用的益生菌大多数是乳酸杆菌属和双歧杆菌属,可以产生乳酸等对人体有益的物质。其他菌属也有少量应用,例如链球菌、芽孢杆菌和肠球菌,但是这些属的某些菌株可能具有致病性,因此需要考虑其安全性[3]。此外,酿酒酵母也被用作益生菌。大量研究表明,益生菌对哮喘、湿疹、肥胖、代谢综合征和胃肠道疾病等具有有益作用[3,73]。益生菌发挥有益作用机制主要有以下几种[3,74]:1)与结肠细胞相互作用维持肠屏障;2)产生抗菌因子(例如H2O2、细菌素、防御素和短链脂肪酸),抑制病原体的生长;3)与潜在有害微生物的黏附和营养竞争;4)降解毒素;5)结肠中酶活性的调节;6)激活免疫应答。
益生元被定义为通过选择性促进结肠中一种或几种微生物的生长而有益于宿主健康的膳食补充剂[3]。益生元由纤维和碳水化合物组成,这些纤维和碳水化合物不会被消化,然后在大肠中被共生细菌发酵产生短链脂肪酸(SCFA),进而可以降低肠道pH 值,并促进人体有益菌(例如乳酸菌和双歧杆菌)的生长[3]。抗性淀粉(RS)是目前研究最多的益生元之一,其促进细菌生长并具有抗癌和抗炎作用。大量研究表明,大豆纤维可以缓解腹泻和厌食症,而燕麦纤维和果胶可以缓解与甲氨蝶呤(MTX)相关的小肠结肠炎的发生和进展。此外,结肠癌大鼠同时服用益生菌和伊立替康可降低伊立替康的毒性,尽管未发现与特定细菌种群相关,但这种改善可能与丁酸产量的增加有关[3]。
益生菌和益生元具有协同作用,其组合称为合生元。在共生制剂中,益生菌成分应选择性促进益生菌的生长和活性[3]。一种含有短双歧杆菌、干酪乳杆菌和低聚半乳糖的合生元可降低由多西他赛、顺铂和5-氟尿嘧啶(5-FU)化疗方案引起的腹泻、淋巴细胞减少和发热性中性粒细胞减少等副作用[3]。益生菌和益生元通过影响肠道微生物的组成和功能来维持人类健康,肠道微生物的个体差异会影响益生菌和益生元的功效[75]。因此,依据这种个体差异制定合理的使用方法对于益生菌和益生元生物疗法至关重要。
2.3.2 粪菌移植 粪菌移植(fecal microbiota transplantation,FMT)是通过重建肠道菌群进行治疗的一种方法,多用于艰难梭菌感染的治疗[74]。这项研究成果激发了许多与FMT 相关的研究,FMT 已被用于治疗许多疾病,例如炎症性肠病、肠易激综合征、慢性便秘和非酒精性脂肪肝,尤其是由艰难梭菌引起的假膜性小肠结肠炎[72,74]。FMT 为传统治疗方式无法攻克的疾病带来了新的希望。
为了降低FMT 的风险,通常从患者的妻子、近亲或邻居中选择FMT 的供体。根据相关统计分析,近亲捐赠者的比例(93%)略高于外来捐赠者(84%),但这2 个比例之间在统计学上没有显著差异[72]。因此FMT 的第一步就是确定谁具有健康的肠道微生物。同时,肠道微生物和人的指纹以及其他器官一样具有个体差异,因此在治疗过程中应考虑这种差异可能造成的后果[70]。FMT 的问题涉及年龄、供体选择、移植后过程管理和环境因素,尤其是受者和供体可能携带的致病菌,制备过程中给药的药物剂量以及要移植材料的含量等[70]。
2.3.3 抗生素 抗生素是目前医学上广泛使用的抗感染药物,是一类由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的次级代谢产物[3,76]。抗生素治疗的合理机制包括降低细菌密度,消除目标有害细菌,抑制继发性细菌增殖以及减少细菌易位。
抗生素对肠道微生物整个细菌群落均有很强的作用,这意味着微生物群中每种细菌均可能受到抗生素的影响,无论它们是否是致病菌[76]。一系列研究发现,抗生素治疗会改变肠道菌群的组成和丰度,使某些物种数量增加而其他一些物种则减少或消失[77]。抗生素对肠道菌群的干扰会受抗生素类型、剂量、暴露时间、药理作用和靶向细菌等因素的影响[77]。广谱抗生素可导致杆菌门(Bacteroidetes)和壁厚菌门(Firmicutes)的微生物比例失衡,从而打乱肠道微生态的稳态[77]。
每类抗生素具有不同的特性,因而对肠道微生物组成产生的影响也不尽相同。同时,不同个体的肠道菌群本身存在巨大差异,抗生素治疗可能在帮助一个人的同时对另一个人产生不良影响。例如,环丙沙星每日2 次、每次500 mg,持续服用5 d,会影响约30%的肠道菌群,但幅度因人而异。微生物学家和分子生物学家已经在细菌或克隆的基因组水平上评估了抗生素的耐药性[78]。随着宏基因组测序技术的发展,科学家进一步研究了抗生素对人类肠道菌群的多样性和丰富性的影响,为抗生素耐药机制研究提供了良好的补充。总之,抗生素对肠道菌群的影响因人而异,如何使用好抗生素这把双刃剑是一个值得深思的问题。
3 结语
药物微生物基因组学是一个新的医学领域,是微生物学、药理学、药物基因组学、遗传药理学和个体化医学发展的产物。人体表型组差异除了与遗传和环境等因素相关以外,肠道微生物也与之有密切联系。由于肠道微生物的复杂性,迄今为止科学家们尚未从中发现可以作为精准医学诊断或预后的生物标记。但是,相信随着技术的发展,人们对微生物的认识会更加全面、深入、系统。药物微生物组学定将推进个体化医学的进一步发展。

