氮磷汇入驱动下的河流轮虫群落演替
陈星宇, 刘雨泽, 郭逍宇, 熊 薇
1首都师范大学,北京 100048; 2中国科学院生态环境研究中心,北京 100085;3北京市第十四中学,北京 100053
生物多样性急剧减少已成为全球关注的重要生态环境问题,生物多样性决定机制已被列为科学界面临的25大重要科学问题之一(Pennisi,2005)。全球河流生物多样性受威胁程度研究结果表明,中国是河流生物多样性锐减的重灾区之一(Vörösmartyetal.,2010),水体污染是导致生物多样性迅速减少的五大重要因素之一(Dudgeonetal.,2006)。我国河流正面临严峻的污染问题,根据2003—2013年的调查统计,我国淡水水体污染具有时间长、污染范围持续扩大的特点(Caietal.,2017)。其中,海河流域是七大流域中污染最严重的区域。在2005—2015年间,该流域有大于60%的河段水质处于Ⅴ类或劣Ⅴ类水平(中华人民共和国环境保护部,2016)。人类活动介导的氮磷输入是河流水体水质恶化的重要原因之一,极易导致水体富营养化发生,成为水生态系统健康和生态安全的重要威胁(Pernet-coudrieretal.,2012; Vörösmartyetal.,2010; Wangetal.,2019; Xiongetal.,2019)。同时,水体富营养化问题还与人口密度及气候相关,密集的城市人口导致营养物质大量排放,干旱半干旱气候导致的降雨量减少使富营养化问题进一步恶化(Nyenjeetal.,2010),从而导致水体缺氧、鱼类死亡、藻类暴发等一系列生态环境问题。虽然氮磷输入对典型类群如鱼类以及初级生产者藻类的影响已有报道,但在污染条件下,河流生物区系的演替规律及其机制未得到很好解答,而这一问题的解析是诊断多样性急剧减少的关键,同时也是生物多样性保护亟待解决的科学问题。
浮游动物是河流典型的无脊椎动物生物类群,主要包括甲壳类的枝角类和桡足类、轮虫以及原生动物四大类群。它们主要以水体藻类、细菌以及有机碎屑为食,同时被鱼类等脊椎动物捕食,是河流食物网中能量传递和物质流动的中间环节(Yoshidaetal.,2003)。因此,从河流生态系统的物质、能量流动角度来看,浮游动物具有重要的生态学意义。其中,轮虫是在污染河流中丰度最高的浮游动物类群,对污染响应迅速,对水体污染具有潜在的指示作用(Ejsmont-karabin,2012)。另外,Dugganetal. (2002)通过对新西兰31个湖泊轮虫群落的研究分析发现,轮虫群落组成受到水体透明度、总磷浓度、湖泊平均深度以及叶绿素浓度的影响。Wangetal.(2010)和Xiongetal.(2016)分别对我国长江流域湖泊和海河流域河流轮虫群落开展了研究,结果一致表明轮虫群落组成与水体总氮水平显著相关。另外,Yangetal.(2017)对太湖及入湖支流浮游动物的分析结果表明,轮虫丰度与氨氮显著相关,与枝角类及桡足类相比,轮虫对氨氮耐受性更高。因此,解析污染条件下轮虫群落的演替规律对于阐明河流生物区系对污染的响应具有重要意义。
北三河水系地处半干旱气候地区,流经京津冀地区,是海河流域九大水系之一,由东部的温榆河—北运河、中部的潮白河—潮白新河以及东部的蓟运河3条主干道河道组成,最终汇入渤海。其西部毗邻北京市、天津市,东部处于河北市内。西部温榆河为北京市的排污受纳河流,北京市污水处理厂出水由清河、坝河、凉水河等汇入温榆河以及下游北运河。已有研究表明,温榆河—北运河磷含量为0.3~5.3 mg·L-1,氮含量为3.0~49 mg·L-1,而氨氮(0.6 mg·L-1)和亚硝酸盐氮(≥ 1 mg·L-1)的浓度均超过了毒性水平,且氮、磷来源为城市的污水排放(Pernet-coudrieretal., 2012)。Yangetal.(2018)对温榆河—北运河后生浮游动物群落与环境的相互关系研究结果表明,温榆河段河流的氮磷浓度最高,同时氮磷浓度的改变与浮游动物群落的地理分布显著相关。因此,北三河西部河流,尤其是温榆河受到了严重的氮磷污染,解析北三河不同河流的轮虫群落组成及其决定机制,将对该区域的河流生态退化诊断、生物多样性保护提供重要的理论支撑,也将为京津冀地区的生态安全保障提供指导。
1 材料与方法
1.1 采样点设置及样品采集
在北三河水系的西部河流设置11个采样点,主要分布于排污受纳河流温榆河,为本研究的H组样点;另外,在东部诸河流中设置15个代表性采样点,为本研究的L组样点(图1)。这些采样点为海河流域北三河生态调查监测站点,样点设置参见Xiongetal.(2016)。
为了获得轮虫群落定量样本,本研究在每个采样点取30 L水通过20 μm漏斗形浮游生物网过滤收集所有浮游动物样本,并保存于5%的福尔马林溶液中,定容终体积为100 mL,用于轮虫群落形态学鉴定分析。同时,在每个样点采集500 mL水样,用于水体的理化指标测定。所有样品均冷藏于4 ℃冰箱,并尽快运回实验室进行分析。
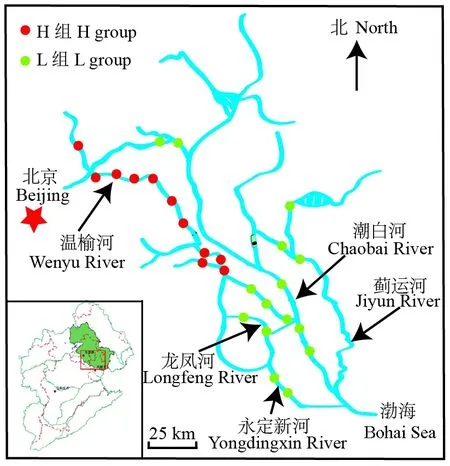
图1 北三河水系采样点
1.2 轮虫群落组成分析及水质指标测定
为了定量分析每个样点的轮虫群落组成,本研究在100 mL保存样品中取出2 mL样品全部进行镜检计数,且此过程重复3次,最终取平均值并换算为每升水中的物种密度。在每次取出镜检样品之前,摇匀样品瓶,以保证样品在瓶中均匀分布,以减少随机取样带来的误差对结果的影响。本研究物种鉴定采用光学显微镜完成,根据不同物种的形态特征尽量鉴定到种水平,但是个别属的轮虫种类由于固定保存后鉴定特征丢失,只鉴定到属水平,例如异尾轮属、犹毛轮属和巨头轮属等。
为了研究污水排放对水体营养水平的影响,本研究共测定了8个理化指标,包括现场探头测定的水体温度(water temperature, WT),以及实验室测定的总磷(total phosphorus, TP)、溶解性总磷(dissolved total phosphorus, DTP)、活性磷(soluble reactive phosphorus, SRP)、总氮(total nitrogen, TN)、溶解性总氮(dissolved total nitrogen, DTN)、硝酸盐氮(nitrate nitrogen, NO3-N)和氨氮(ammonia nitrogen, NH4-N)。其中,TP、SRP、TN、NO3-N和NH4-N采用国标法测定;DTN和DTP采用电感耦合等离子体发射光谱仪(ICP-OES,OPTIMA 2000,珀金埃尔默,美国)测定。
1.3 数据分析
1.3.1 水质差异性分析 为了分析2组样点间水质因子的差异,本研究采用主成分分析(principle component analysis, PCA)的方法基于8个测定的环境变量的欧式距离对26个样点进行排序分析,排序结果中距离越相近的点,环境条件越相似。为了进一步统计单个环境变量在组间的差异显著性水平,本研究采用了非参数曼-惠特尼U检验对8个环境变量分别进行差异显著性检验分析。
1.3.2 轮虫群落差异性分析 根据群落组成分析的结果,本研究首先统计每个样点的生物多样性,包括总物种数目(S)、总个体数目(N)、物种丰富度(d)、香农威纳指数(H)和均匀度(J)。采用非参数曼-惠特尼U检验对H组和L组间的生物多样性指数进行差异水平检验。另外,为了分析样点间的组成差异,本研究首先采用非度量多维尺度分析(non-metric multidimensional scaling, NMDS)基于物种组成的Bray-Curtis不相似性对26个样点进行排序分析,同时采用相似性分析(analysis of similarity, ANOSIM)对H组和L组间的群落差异性进行差异水平检验。为了进一步深入分析导致H组和L组样点轮虫群落组成差异的物种,本研究采用相似百分比分析(similarity of percentage, SIMPER)对H组和L组样点轮虫群落的代表性物种分别进行了识别。同时,对H组和L组样点轮虫群落差异贡献率最高的物种进行了识别。
1.3.3 轮虫群落与水质变量的相互关系分析 在环境条件以及群落差异分析的基础上,本研究采用基于spearman相关的mantel检验对每个环境变量与轮虫群落组成差异的相关性进行了分析,以识别出与轮虫群落显著相关的环境因子。另外,本研究采用基于线性模型的冗余分析(redundancy analysis,RDA)对环境因子与群落组成进行建模分析,以建立样点、物种以及环境变量三者之间的关系。为了增加所构建模型的可靠性,本研究在进行RDA分析之前通过计算每个环境变量的膨胀因子(inflation factors)对环境因子进行筛选,剔除具有共线性的环境变量,以建立节俭、可靠的RDA模型,正确揭示样点、物种以及环境变量三者之间的关系。
2 结果与分析
2.1 环境差异性
环境变量测定结果表明,H组样点的TN、DTN、TP、DTP和SRP的平均值要明显高于L组,曼-惠特尼U检验结果显示,2组间的TN、DTN、TP、DTP和SRP具有极显著差异(P<0.001,表1),而WT、NO3-N和NH4-N无显著差异。PCA排序结果表明,H组样点和L组样点清晰地聚为2簇。2个分析显示,2组样点的环境条件明显不同(图2)。从样点在环境梯度上的分布来看,H组样点的氮(TN和DTN)、磷(TP、DTP和SRP)相关指标明显高于L组样点。同时,PCA排序图中TN、DTN、TP、DTP和SRP变量相互间呈锐角关系,表明这些变量间具有极强的相关性。
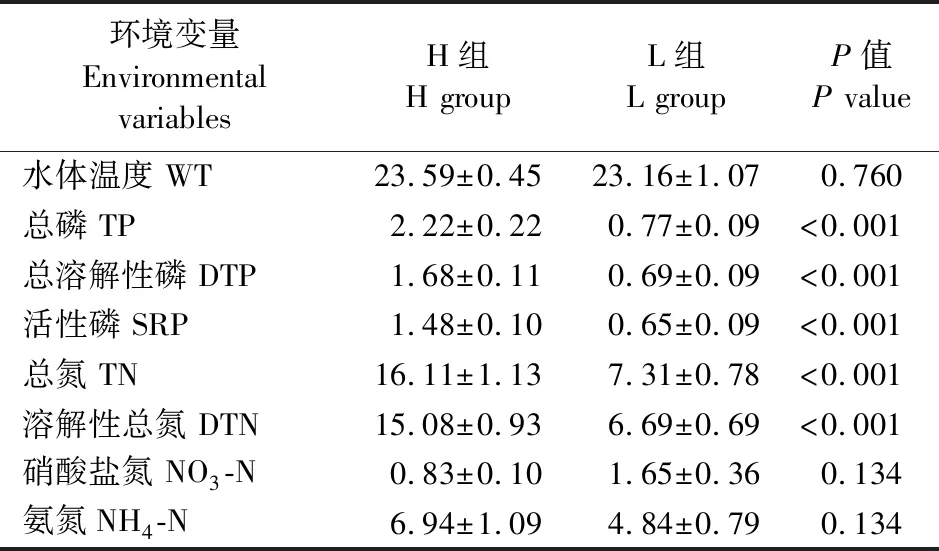
表1 H组和L组各环境变量的均值±标准差及组间差异性U检验分析
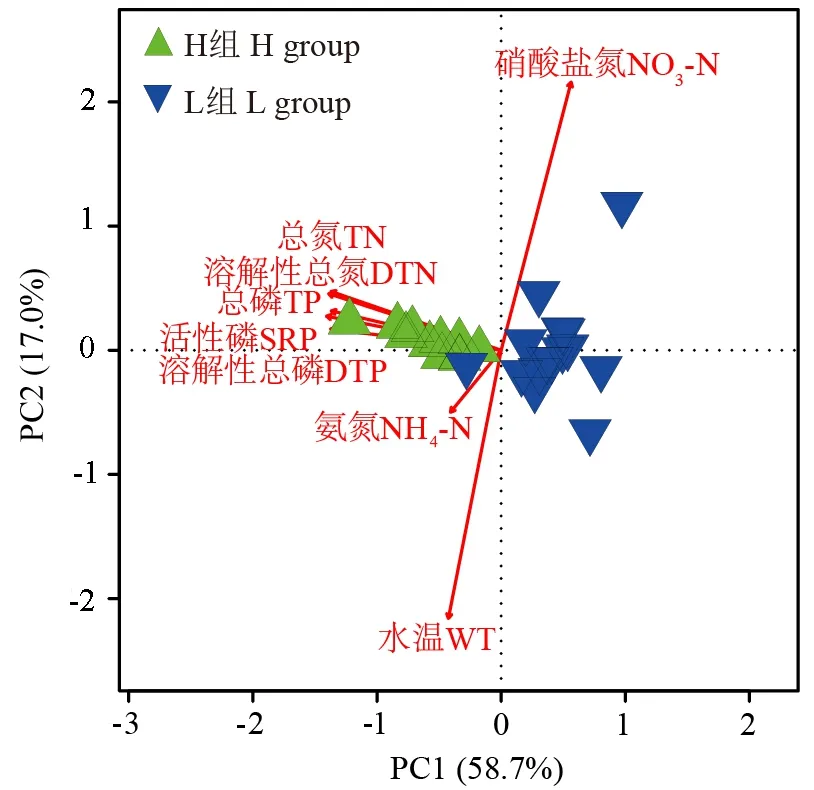
图2 基于环境因子欧氏距离排序的主成分分析
2.2 群落演替规律
轮虫群落组成分析结果表明,在研究的26个样点中共检测到44个轮虫种类。H组样点平均总物种数为6.2种,平均总生物个体数为1008个;L组样点平均物种数为10.8种,平均生物个体数为2904个。另外,从图3可以看出,H组样点不仅是总物种数目(S)、总生物个体数目(N)明显低于L组样点,同时物种丰度(d)、香农威纳指数(H)以及均匀度(J)均低于L组样点。对组间多样性指数进行曼-惠特尼U检验结果显示,除均匀度指数外,H组与L组间的总物种数目、总生物个体数目物种丰富度、香农威纳指数的差异程度均为极显著差异水平(P<0.001)。
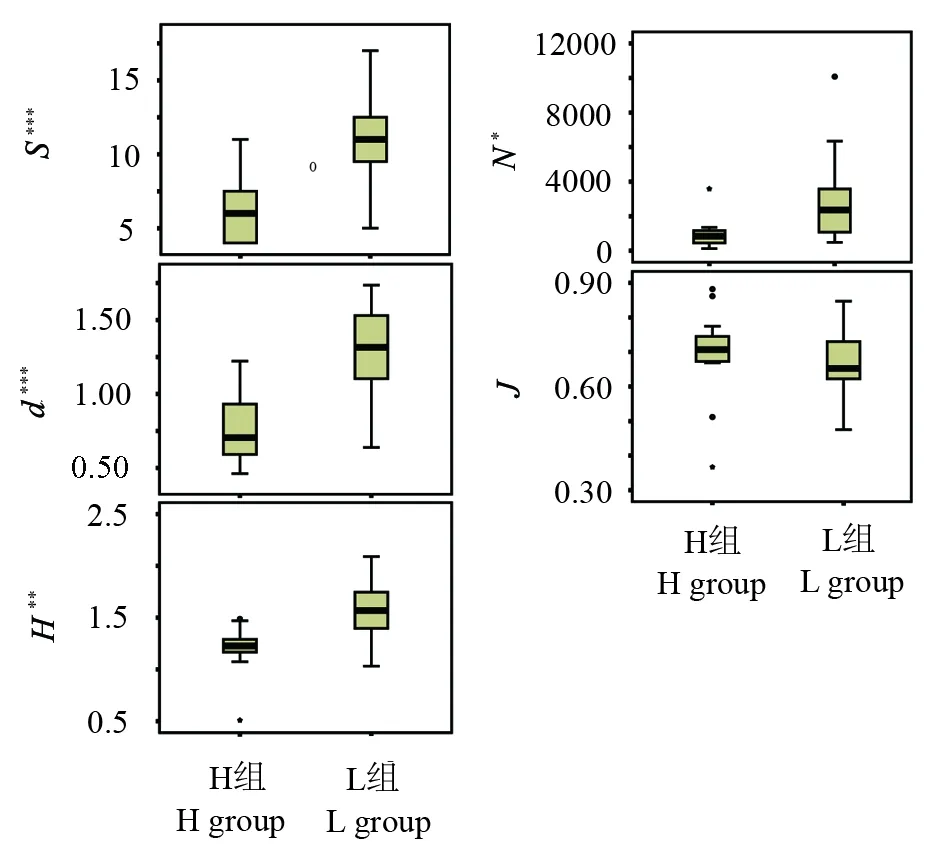
图3 H组和L组轮虫群落多样性指数箱式图
相似百分比分析结果表明,H组典型物种为壶状臂尾轮虫BrachionusurceolarisMüller和角突臂尾轮虫B.angularisGosse,L组典型的物种为针簇多肢轮虫PolyarthratriglaEhrenberg和萼花臂尾轮虫B.calyciflorusPallas (表2)。NMDS排序结果表明,H和L组群落在排序图中主要群落聚为2个不同的簇,ANOSIM的差异性程度分析显示,2组样点在群落组成上的差异已达到显著性水平(ANOSIM,R=0.194;P<0.01,图4)。因此,H和L组群落在组成上具有显著差异。物种对组间群落差异的贡献率分析结果表明,H组群落的物种丰度减少以及物种的有无均是组间群落差异重要原因。其中,迈氏三肢轮虫Filiniamaio(Colditz)、蒲达臂尾轮虫B.budapesllensisDaday和奇异巨腕轮虫Hexarthramira(Hudson)丰度的减少对组间群落差异性共贡献了17.32%;沟痕泡轮虫PompholyxsulcateHudson和叉爪单趾轮虫MonostylafurcateMurray的有无对组间群落差异性共贡献了8.98%(表3)。
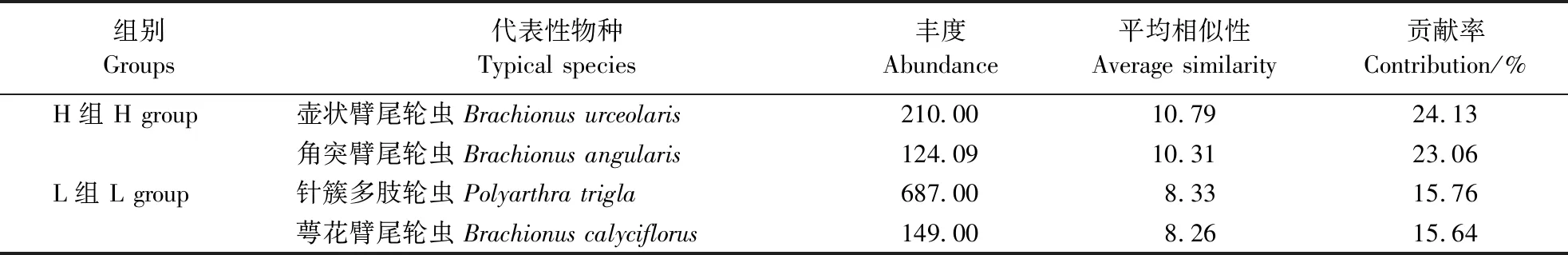
表2 基于相似百分比分析(SIMPER)的H组和L组典型代表性轮虫物种鉴定
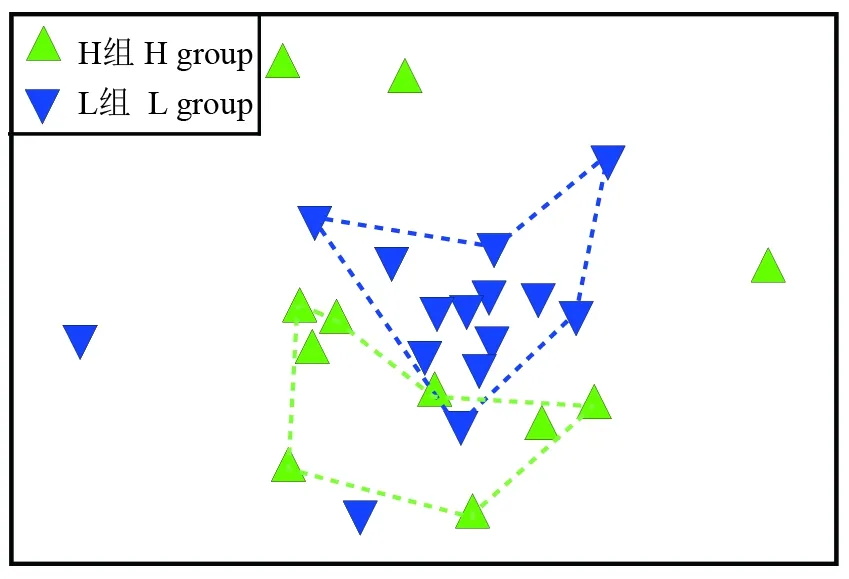
图4 基于群落Bray-Curtis不相似性的非度量多维尺度分析
2.3 关键污染因子识别
Mantel相关分析结果表明,样点间TN(r=0.356;P=0.001)、DTN(r=0.3454;P=0.001)、TP(r=0.316;P=0.002)、DTP(r=0.375;P=0.001)、SRP(r=0.370;P=0.001)和NH4-N(r=0.148;P=0.039)的差异均与群落组成差异显著相关。
膨胀因子分析筛选出TP、NH4-N、WT和NO3-N的膨胀因子系数<10,为非共线性变量。基于这4个非共线性变量,本研究成功构建了可靠的RDA模型(全模型Trace=0.277;P=0.024)。基于RDA模型的样点、物种及环境变量的三序图显示(图5),H组与L组样点分布于不同的TP梯度上,H组样点分布于较高的TP环境中,且物种卜氏晶囊轮虫AsplanchnabrightwelliiGosse、椎轮属Notommatasp.和长三肢轮虫F.longiseta(Ehrenberg)与TP正相关。而L组样点分布于低TP梯度,其中蒲达臂尾轮虫、迈氏三肢轮虫以及角突轮虫B.angularisGosse均与TP浓度呈负相关。NH4-N浓度的变化不是导致H组与L组群落组成差异的主要原因,但是NH4-N浓度的变化与L组组内群落差异相关。
3 讨论
3.1 河流水质差异
本研究结果表明,西部河流(温榆河)的TN、TP、DTN、DTP以及SRP的浓度均显著高于东部诸河(包括潮白河、蓟运河及其支流)。Yangetal.(2018)对温榆河的水质监测结果也发现,温榆河具有较高的TN、TP浓度,其平均值分别为40.7、5.09 mg·L-1。榆河毗邻北京市,其水源一部分来自于上游的沙河水库,另一部分主要由4个支流(清河、坝河、通惠河和凉水河)汇入的来自北京市排放的废水组成(Heebetal.,2012)。据报道,未处理的生活污水、畜禽养殖污水排放导致温榆河上游沙河水库水质溶解性无机磷(DIP)含量达3.2 mg·L-1,NH4-N含量为33 mg·L-1(Pernet-Coudrieretal.,2012)。同时,汇水支流的水质研究结果表明,其TN、TP浓度范围分别是4.26~27.04、0.06~2.42 mg·L-1。因此,大量营养物质通过支流汇入温榆河。另外,污水氮磷排放与区域人口基数呈正相关关系(Wangetal.,2019)。因此,温榆河作为北京市重要的排污河流,与北京市密集人口密度相关。而东部诸河虽然较温榆河氮磷浓度较低,但是其TN、TP平均浓度分别为7.31、0.77 mg·L-1。根据我国地表水环境质量标准(GB 3838—2002),均超过地表水Ⅴ类水标准。Xiongetal.(2017)对潮白河的研究结果表明,在潮白河下游区域较密云水库上游保护区,其TN含量增加1倍,而TP含量增加近70倍,潮白河下游主要受到农业面源污染的影响。张婉璐等(2012)对蓟运河的水质评价结果也表明,蓟运河水质均为Ⅴ类水水平。潮白河、蓟运河及其支流流经天津、河北多个市,包括廊坊市、承德市,因此受到人类活动的影响较大。
3.2 轮虫群落组成关键影响因子
本研究结果表明,系氮磷输入导致北三河水的营养盐相关指标显著增加,轮虫群落物种数目、个体数目、香农威纳多样性指数以及均匀度显著降低、轮虫群落组成显著改变。Xiongetal. (2019)在松花江流域针对浮游动物群落的研究的结果也表明,尽管松花江流域的营养盐浓度显著低于北三河水系,营养盐浓度的变化与轮虫群落组呈显著相关。
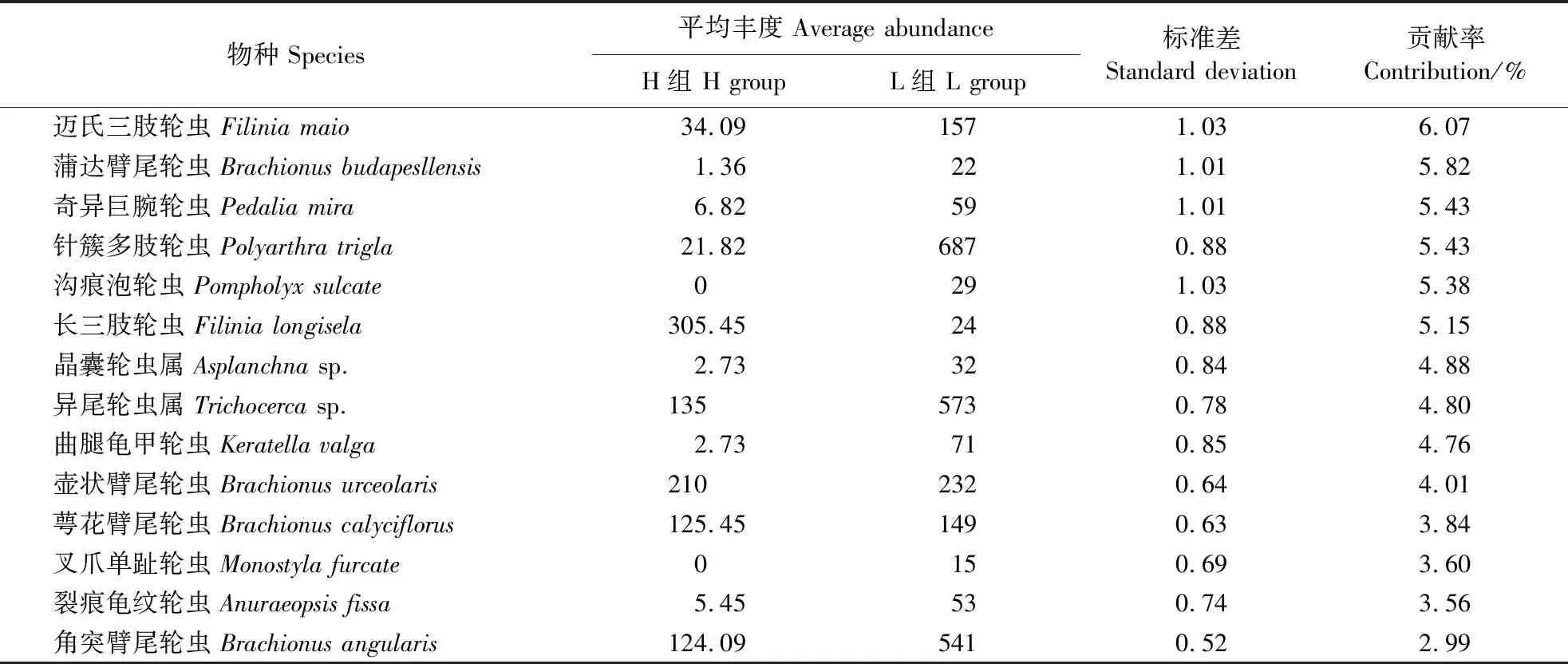
表3 基于相似百分比分析(SIMPER)的组间差异重要贡献(累积贡献率>65%)的物种
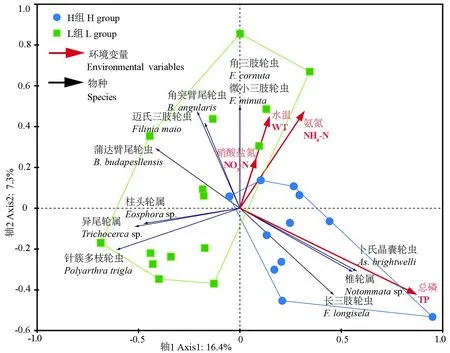
图5 轮虫群落与环境因子间的冗余分析
已有研究表明,水体营养程度对轮虫群落的影响主要来自于2个方面:一方面是直接作用,主要是高浓度的氨氮或者亚硝酸盐氮对生物个体的毒害作用,以及寡营养环境的资源缺乏对轮虫群落组成带来影响;另一方面是间接影响,包括通过降低水体的氧浓度、pH值等对轮虫群落带来不利影响(王汨等,2017),以及通过影响水体藻类生长、微生物生长、捕食者丰度来影响轮虫群落的组成及丰度(鲁耀鹏等,2017; Dugganetal.,2002)。例如,轮虫丰度与叶绿素a浓度正相关,广布多肢轮虫在叶绿素a高的静态水体易形成优势种(梁迪文等,2017)。本研究中,群落演替同时受到SRP等无直接毒害作用营养盐因素以及氨氮的影响,可以推断在北三河轮虫群落同时受到了环境条件的直接和间接作用的影响。RDA分析显示,水体营养水平变化对群落差异解释量的估计为27.7%,表明除了受到水体营养水平的影响外,轮虫群落同时也受到其他本研究未检测环境污染变量的影响。前人实验室培养实验已经证明,农药β-六六六和十氯丹能导致萼花臂尾轮虫种群胚胎发育时间显著缩短、世代时间显著延长(查春旺,2007),环境激素双酚A、阿特拉津、西维因和久效磷能延迟轮虫幼体发育(陆正和,2013)。
3.3 轮虫群落对河流污染的指示作用
本研究显示了轮虫群落组成与河流水体污染物具有密切响应关系,这一结果表明轮虫群落是河流水质评价的潜在对象。虽然大型无脊椎动物(陈义永等,2018; 李朝等,2018)以及硅藻(陈向等,2017)是国内外河流水质生物评价的典型对象,但是轮虫在水质评价中的作用是这2种生物类群不可替代的。首先,轮虫对水质营养盐浓度变化的迅速响应得到全球多个地域水体的研究的验证,包括生态环境状况良好的新西兰地区的湖泊水体(Dugganetal.,2002)、中国污染最严重的海河流域的河流水体(Xiongetal.,2016)以及中国沿长江流域的富营养化湖泊水体(Wangetal.,2010)等;其次,轮虫对水质变化的指示作用是由浮游动物在食物链中承上启下的位置决定的,作为河流浮游动物群落的主导组成类群,其多样性的变化既可以反映自下而上的环境响应,也可以反映自上而下的环境效应(García-chicoteetal.,2018)。更有多种轮虫种类为营养水平的指示种,如左其亭等(2017)通过污染指示种的组成及群落多样性指数对淮河中上游进行了水质评价。
本研究中高污染区(H组)代表性物种为壶状臂尾轮虫和角突臂尾轮虫,二者分别为β中污型及β-α中污型指示物种;低污染区(L组)代表性物种为针簇多枝轮虫和和萼花臂尾轮虫,二者分别为寡污到β中污型(o-β)和β-α中污型指示种。因此,本研究中代表性物种的组成也指示出了高污染区比低污染区更高的营养水平。另外,基于轮虫群落指示种的E/O指数(即富营养型指示种数与贫营养型指示种数比值)以及QB/T指数(即臂尾轮虫属的种数与异尾轮虫属的种数比值)已频繁应用于湖泊、水库水质评价(鞠永富等,2016; 李共国和虞左明,2003)。而这些水质评价指标的应用以轮虫极广生态幅度为基础,该类群从寡营养水体到腐生水体均存在。另外,轮虫能生存于特殊极端环境如污水处理厂的活性污泥(寇海涛等,2018)及pH≤3的酸性水体(Deneke,2000)。另一方面,大型底栖生物群落往往在河道疏浚等环境修复工程中遭到破坏,并在短期内难以恢复,而浮游动物群落在工程实施后可以迅速恢复(刘国锋等,2010)。因此,在污染河流水质评价过程中应将轮虫列为生物评价对象,尤其是针对富营养化河流。

