内源性MHCⅠ类分子对海马神经元突起生长的影响
吕 丹, 周多奇
(安庆师范大学 生命科学学院 皖西南生物多样性研究与生态保护安徽省重点实验室, 安庆 246133)
主要组织相容性复合体(Major histocompatibility complex,MHC)是编码主要组织相容性蛋白的一组紧密连锁且高度多态性的基因群,在人类称为HLA(Human lymphocyte antigen),在小鼠称为H-2复合体(histocompatibility-2)[1]。MHC分子是重要的免疫蛋白,按其编码基因结构和功能的不同,可分为3类,其中MHCⅠ类分子是调节免疫细胞发育、调控T细胞应答及NK细胞活性的关键分子。
中枢神经系统曾被认为是“免疫豁免”区,正常生理条件下神经元不表达MHCⅠ类分子,仅在病毒感染等病理条件下才会被诱导表达[2]。但是,近二十年通过对小鼠、大鼠、猫、绒猴及人类的实验研究逐渐表明,MHCⅠ类分子表达于正常神经元,在中枢神经系统发育过程中承担一定的功能,主要参与突触形成、精确突触连接建立、突触可塑性等事件[3-4],进而影响运动、学习、记忆等活动[5],并可能与一些神经发育或神经退行性疾病的发生、发展相关,如孤独症、精神分裂症、老年性痴呆、肌萎缩侧索硬化等[6-8]。研究MHCⅠ类分子在中枢神经系统中的功能及其工作机制具有重要的理论及临床意义。
通过对人类及小鼠MHCⅠ类分子时空表达谱的检测分析,在神经元突起生长及突触形成之前已可检测到MHCⅠ类分子的表达,提示MHCⅠ类分子可能在神经元突触形成前已开始发挥一定的作用[9-10]。本研究以体外培养的小鼠海马神经元为研究对象,在神经元突起生长之前可检测到MHCⅠ类分子的表达,并且进一步获得结果提示内源性MHCⅠ类分子具有限制神经元突起生长、分支的作用;同时,在免疫系统中作为MHCⅠ类分子配体发挥作用的PirB(paired immunoglobulin-like receptor B)分子具有类似功能。本研究为进一步探究MHCⅠ类分子在神经系统的新功能及其作用机制奠定基础。
1 材料与方法
1.1 实验动物
本研究使用的野生型及经典MHCⅠ类重链基因敲除(H-2Kb/Db-/-)小鼠均为C57BL/6J小鼠,H-2Kb/Db-/-小鼠由东南大学HLA实验室惠赠。将性成熟的雌、雄鼠于下午16:00前合笼,取出生当天(P0)小鼠用于海马神经元原代培养。实验动物的饲养及处理均遵循人道主义原则。
1.2 海马神经元原代培养
P0小鼠海马神经元原代培养参照Kaech和Banker报道的方法[11]。取24孔细胞培养板,加入100 μg/mL多聚-D-赖氨酸包被的盖玻片,将经过胰液消化过滤的海马神经细胞悬液种于24孔板中。种板30 min后,换含有B27(美国Invitrogen公司)、GlutMAX(美国Invitrogen公司)及D-葡萄糖(美国Sigma-Aldrich公司)的Neurobasal培养液(美国Gibco公司)。对于抗体阻断实验,在种板后30 min换培养液时加入相应浓度的抗-MHC I类分子抗体(OX18,美国Abcam公司)、抗-PirB抗体(美国Santa Cruz公司)或同种型IgG对照抗体(美国Invitrogen公司)。
1.3 免疫染色
收集体外培养的海马神经元,新鲜配制的 4%多聚甲醛室温固定细胞20 min;加入0.25% Triton X-100处理细胞15 min并进行BSA封闭;去除封闭液,加入新鲜封闭液配置的抗β-III-tubulin 一抗(美国covance公司,1∶5000),4 ℃孵育过夜;用新鲜封闭液配制的荧光二抗,室温避光孵育1 h; DAPI衬染后封闭,荧光显微镜下观察、拍照;利用Image J插件Sholl Analysis对图片神经元分支数进行分析。
1.4 数据分析
所有实验均重复3次以上;数据采用平均数±标准误的形式表示,并利用配对t检验进行数据统计分析。
2 结果与分析
2.1 神经元突起生长前MHCⅠ类分子的表达
原位杂交及免疫组化的检测结果显示,在小鼠胚胎发育过程中,神经元前体细胞可检测到MHCⅠ类分子[10]。对体外培养0 d(div 0)的小鼠海马神经元进行检测,结果显示在神经元突起未生出之前,可在细胞膜观察到MHCⅠ类分子的表达(图1)。
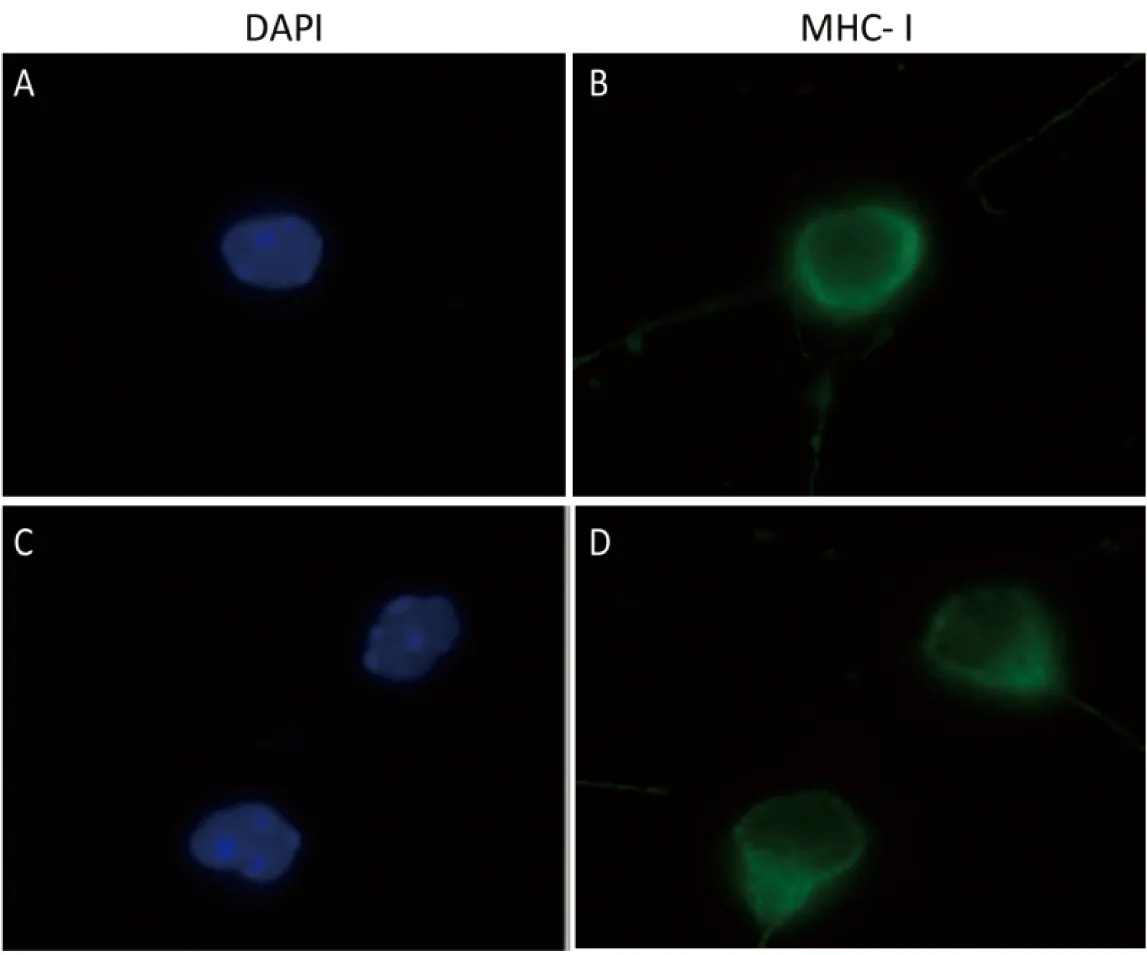
图1 海马神经元表达MHCⅠ类分子
2.2 抗MHCⅠ类分子抗体促进神经元突起生长
已有研究报道,外源性添加重组的MHCⅠ类分子可以抑制视网膜外植体[12]及背根节细胞神经突的生长[13]。为了探究内源性表达的MHCⅠ类分子对神经元突起生长是否有影响,在海马神经元的培养体系中加入抗MHCⅠ类分子的特异性抗体OX18,用以阻断内源性MHCⅠ类分子信号通路,并在48 h后对神经元进行β-III tubulin荧光染色,观察神经元突起生长情况。染色结果显示,相较于加入同源抗体的对照组,加入OX18抗体阻断神经元MHCⅠ类分子信号通路后,海马神经元突起分支数目显著增加(图2)。
2.3 经典MHCⅠ类分子敲除小鼠海马神经元突起数目增多
为了进一步证实内源性MHCⅠ类分子对神经元突起生长、分支的影响,我们对野生型及经典MHCⅠ类基因H-2Kb/Db敲除小鼠的海马神经元进行体外培养,48 h后进行β-III tubulin荧光染色。染色结果显示:相比于野生型小鼠,来源于H-2Kb/Db敲除小鼠的海马神经元突起数目显著增加(图3)。该结果进一步提示内源性MHCⅠ类分子具有限制海马神经元突起生长、分支的功能。

Control:同源抗体对照组;OX18抗体浓度为5.0 μg/mL;*表示差异显著(P < 0. 05)
图2 抗体阻断MHCⅠ类分子信号通路促进神经突起生长
Figure 2 The branch number of neurons increased by anti- MHCⅠ antibody
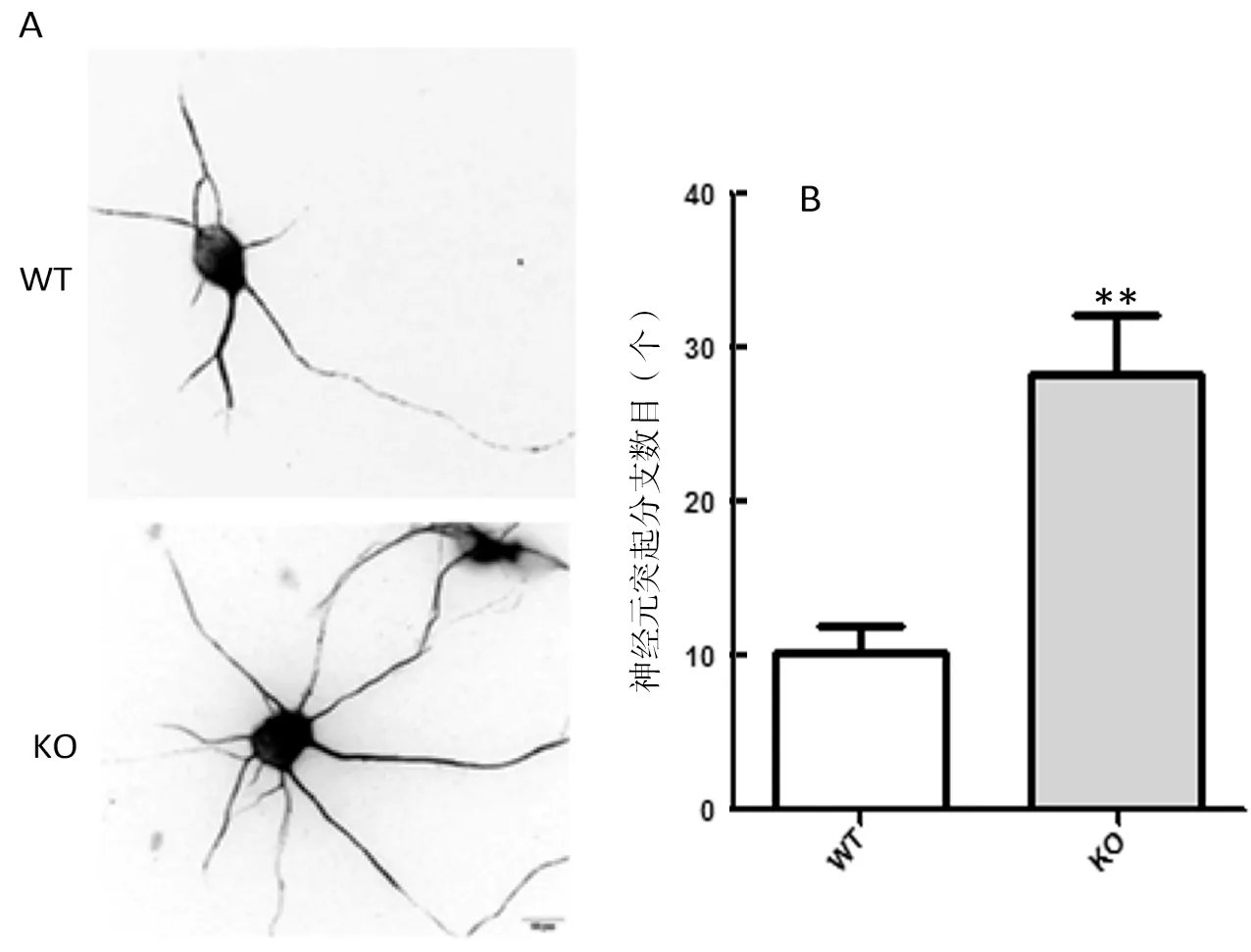
WT:wild type,野生型;KO:knockout,H-2Kb/Db基因敲除型;**表示差异极显著(P < 0. 05)
图3 缺乏MHCⅠ类分子表达神经元突起数目增多
Figure 3 Increased branch number of H-2Kb/Dbknockout neurons
2.4 抗PirB抗体促进神经元突起的生长
免疫系统中,MHCⅠ类分子可通过与PirB分子相互作用发挥免疫功能。已有研究结果证实神经元表达PirB分子,且在神经元突触修正过程中发挥一定作用[14]。那么,MHCⅠ类分子是否可能通过PirB分子发挥抑制神经元突起生长的功能?我们在海马神经元的培养体系中加入抗PirB分子的抗体,48 h后β-III tubulin荧光染色结果显示:加入抗PirB分子抗体阻断其信号通路后,海马神经元突起数目增加(图4),类似于加入抗MHCⅠ类分子抗体的结果。

Control:同源抗体对照组;抗PirB抗体浓度为1.0 μg/mL
图4 抗体阻断PirB分子信号通路促进神经突起生长
Figure 4 The increased branch growth of neurons by anti- PirB antibody
3 讨论
免疫蛋白MHCⅠ类分子在神经元中表达,并对突触数目及功能有重要的影响。通过对MHCⅠ类分子的时空表达谱检测分析发现,MHCⅠ类分子在神经元突起生长之前已有表达,提示MHCⅠ类分子可能在神经元突触形成前已开始行使一定功能。有研究报道显示:体外培养来源于神经元特异性过表达H2-Db分子(NSE-Db)的小鼠海马神经元,其神经突起的生长及极化速率显著增强[15];相较于来源于野生型小鼠的丘脑外植体,来自于NSE-Db小鼠的丘脑外植体的延伸受到抑制[16];同时,H-2KbDb敲除小鼠大脑皮层2/3层的锥体神经元树突分支较野生型增多[17]。这些结果均提示MHCⅠ类分子可能参与神经元突起生长、分支的过程。为了探究内源性MHCⅠ类分子是否能够影响神经元突起生长,我们对小鼠海马神经元进行了体外培养,并在不同条件下检测了海马神经元突起分支数目。
首先,利用MHCⅠ类分子特异性的抗体(OX18)来阻断MHCⅠ类分子信号通路。在免疫系统的多个研究已证实抗体OX18可以阻断MHCⅠ类分子信号通路,导致MHCⅠ类分子功能的缺失[18]。利用OX18抗体阻断MHCⅠ类分子信号通路后,体外培养的海马神经元突起数目显著增加;进一步对经典MHCⅠ类分子敲除小鼠的海马神经元进行体外培养,结果同样显示MHCⅠ类分子缺失导致海马神经突起数目的增加。上述结果均提示,在原代培养的海马神经元中,内源性MHCⅠ类分子参与神经元突起的生长过程,具有限制海马神经突起生长的作用。
在免疫系统中,MHCⅠ类分子具有控制细胞间相互识别及调节免疫应答强度的功能。在T细胞应答过程中,T细胞通过其细胞表面受体(T cell receptor, TCR)能够识别并结合抗原递呈细胞表面的MHC分子-抗原肽复合体,并通过CD3分子向胞内传递抗原信号,活化T细胞[19]。但是,在中枢神经系统中并未检测到神经元表达功能性TCR[20]。另一方面,PirB分子也可作为经典MHCⅠ类分子的配体在小鼠免疫系统中发挥作用。已有结果表明PirB mRNA在中枢神经系统中广泛表达, PirB基因敲除小鼠可模拟MHCⅠ类分子基因敲除小鼠的一些异常表型,如视皮层突触密度增加等,外源性PirB分子能以MHCⅠ类分子依赖的方式与皮层神经元结合,在中枢神经系统发育及突触重塑等过程中发挥重要作用,推测中枢神经系统中PirB分子同样可能与MHCⅠ类分子相互作用发挥功能[21-22],故猜想PirB分子是否可能同样参与海马神经元突起生长过程。在海马神经元原代培养体系中加入抗PirB分子的抗体,检测结果表明在加入抗PirB分子抗体后,神经元突起数目显著增加,与加入抗MHCⅠ类分子抗体的结果类似,提示MHCⅠ分子可能与PirB分子共同作用参与调控海马神经元突起数目。
MHCⅠ类分子在正常的中枢神经系统中有广泛表达,不仅在突触形成期,在胚胎期及老年期也有表达,其在神经系统的新功能有待进一步挖掘。本研究的结果初步提示内源性的MHCⅠ类分子具有限制海马神经元突起生长的功能,为深入研究神经元MHCⅠ类分子的新功能及其机制提供了一些基础数据。

