陆地棉蔗糖磷酸合成酶基因家族的鉴定及表达分析
晁毛妮,胡海燕,付丽娜,温青玉,胡根海,骆雨锋,李娅楠,王清连*
(1.河南科技学院生命科技学院/ 现代生物育种河南省协同创新中心,河南新乡453003;2.河南省农业科学院,郑州450002)
蔗糖是植物光合作用的主要产物,对于植物的生长发育和产量形成至关重要[1]。 蔗糖磷酸合成酶(Sucrose phosphate synthase, SPS)是调控植物叶片中蔗糖合成的关键限速酶,在植物光合产物的积累与分配方面发挥着重要作用[2-3]。 鉴定和克隆植物的SPS基因,并通过分子手段调控SPS的表达或活性,可能是提高植物蔗糖含量,实现植物高产目标的1 条重要途径。
在植物中,蔗糖磷酸合成酶是1 个多基因家族,不同物种中家族成员数量差异很大[4]。 目前,已从拟南芥[5]、玉米[4]、甘蓝型油菜[6]和苹果[7]等物种中分别鉴定到 4、7、11 和 8 个SPS基因。 对已鉴定和克隆的SPS基因进行分析发现,高等植物的SPS基因家族大致可分为 A、B 和C 三个亚族[5],而禾本科植物还有 1 个 D 亚族[4,8]。 不同亚族间,SPS基因的表达特性差异很大。 例如,玉米SPS 基因家族的 7 个基因中,ZmSPS1、ZmSPS6和ZmSPS7 主要在叶片中表达,ZmSPS2 在叶片和 花 粉 中 高 表 达 , 而ZmSPS3、ZmSPS4 和ZmSPS5 在各个组织均表达量很高[4]。 植物SPS家族成员不同的组织表达模式,暗示着它们在植物生长发育过程中可能起着不同的作用。
目前,在多个物种中开展关于SPS基因功能的研究发现,SPS基因在植物蔗糖的合成和积累、生长发育、产量和品质的形成,以及光合产物的分配等多个方面均起着重要作用。 例如,抑制水稻OsSPS1 基因的表达会导致其株高降低,且控制株高的数量性状位点 (Quantitative trait locus,QTL) 与蔗糖磷酸合成酶基因OsSPS1 共定位[9],表明OsSPS1 基因在调控水稻株高方面起着重要作用。 在烟草和马铃薯中,过表达来自玉米的ZmSPS基因, 转基因植株的产量和干物质质量均显著提高[10-11]。 此外,SPS 的活性与植物体内蔗糖含量也密切相关。 SPS 活性常常作为高粱蔗糖含量的重要标记[12]。 对菜用大豆籽粒蔗糖变化规律进行研究发现,较高的SPS 活性有利于大豆籽粒中蔗糖的积累,且蔗糖含量高的材料SPS 活性显著高于蔗糖含量低的材料[13]。 对SPS 活性与光合产物淀粉和蔗糖含量之间的关系进行进一步研究发现,SPS 活性与淀粉含量之间存在负相关,与蔗糖含量之间存在正相关[14],且SPS 活性的高低会影响植物蔗糖/ 淀粉比值[15-16],表明SPS在光合产物的分配方面也起着重要作用。
棉花是重要的经济作物,提高棉花的产量和纤维品质一直是棉花育种的主要目标[17-18]。 在棉花中,过表达菠菜SPS基因可促进棉花叶片中蔗糖的合成,改善纤维品质[15],表明SPS基因在改善棉纤维品质方面具有很大潜力。 然而,关于棉花蔗糖代谢关键基因挖掘及功能研究的工作较少,目前还未对棉花SPS基因家族进行系统鉴定和表达特性分析。 本研究基于最新公布的陆地棉基因组序列[19],对陆地棉SPS基因家族进行全基因组鉴定,并对SPS基因的编码蛋白结构、进化关系和表达特性等进行了深入研究,为今后深入研究SPS基因的功能及棉花产量的提高提供理论依据。
1 材料与方法
1.1 实验材料
实验材料为陆地棉品种百棉1 号,种植于河南科技学院乔谢试验田(河南省新乡市红旗区洪门镇),常规田间管理。 取开花期棉株的根、茎、叶片、花瓣和初铃期的纤维,立即速冻于液氮中,并保存于–80 ℃冰箱, 用于GhSPS基因的表达特性分析。
1.2 陆地棉SPS家族基因的全基因组鉴定
从http://ibi.zju.edu.cn/cotton 网站下载最新公布的陆地棉基因组数据(TM-1_V2.1)[19],并建立本地Blast 数据库。 拟南芥SPS 家族成员At-SPSA1 (At5g20280)、AtSPSA2 (At5g11110)、At-SPSB(At1g04920)和AtSPSC(At4g10120)的蛋白序列[20]从拟南芥基因组数据库网站(https://www.arabidopsis.org/)下载。以拟南芥SPS 家族成员的蛋白序列作为目标序列, 运行BLASTP 检索程序(e value<1e-10),初步获得候选基因。 然后将这些候选基因的蛋白序列提交到Pfam 数据库进行进一步的结构域 (Pfam ID:PF00534 和PF05116)验证[21],最终鉴定出陆地棉 SPS 基因家族的成员。
1.3 序列分析
利用BioXM 2.6 软件分析陆地棉SPS 家族成员的蛋白序列长度及理化性质(分子量和等电点);利用ClustalX 软件进行蛋白的多序列比对,比对后的序列用GeneDoc 进行编辑。
1.4 进化树构建及基因结构示意图的绘制
拟南芥、水稻、烟草和高粱SPS 家族成员的蛋白序列从NCBI 网站进行下载; 从Cottongen网站(https://www.cottongen.org/)下载海岛棉、雷蒙德氏棉和亚洲棉SPS 家族成员的蛋白序列。利用Mega 5.02 软件中的邻近法(Neighbor joining)构建系统进化树[22],其中校验参数bootstrap 值设置为 1 000,选择 p 距离(p-distance)模型,空位缺失数据的处理为成对删除(Pairwise deletion)。 利用 GSDS 在 线 工 具 (http://gsds.cbi.pku.edu.cn/),根据基因的编码区序列和基因组序列,绘制基因的外显子-内含子结构示意图。
1.5 染色体定位和基因复制分析
根据基因组数据库提供的陆地棉SPS 家族基因的染色体位置信息,利用MapInspect 软件绘制陆地棉SPS 家族基因的染色体位置图。 根据2个基因序列相互匹配部分的长度大于较长序列长度的80%,且相互匹配部分的相似性大于80%来判定基因复制事件;同时,结合基因在染色体上的位置来确定基因复制的类别是串联复制还是片段复制[23-24]。
1.6 基因表达特性的转录组分析
棉花根、茎、叶片、花瓣和20 d 纤维的转录组数据从NCBI 网站SRA 数据库下载[19]。基因表达量的FPKM(Fragments per kilobase of exon model per million mapped reads) 值使用 cufflinks 2.1.1进行计算[25]。 利用MeV 4.9 软件绘制陆地棉SPS家族基因表达的热图[26]。
1.7 RNA的提取和cDNA反转录
使用RNA 提取试剂盒 (TIANGEN,DP441)提取棉花根、茎、叶片、花瓣和纤维的总RNA,然后用1%琼脂糖凝胶电泳检测RNA 的提取质量。使用反转录试剂盒 (TaKaRa,6210B) 将约 2 μg RNA 反转录形成cDNA, 并保存于-20 ℃冰箱备用。
1.8 基因表达特性的荧光定量PCR分析
使用Premier 5.0 软件, 根据基因的CDS 序列设计特异性引物,内参基因Actin(GenBank 登录号为AY907703.1) 和GhSPS基因的引物序列见表1。以反转录得到的cDNA 为模板,于BIOER荧光定量PCR 仪上进行荧光定量聚合酶链式反应 (Quantitative real-time polymerase chain reac tion,qRT-PCR)分析。反应总体系为20μL,包括2×SYBR Premix ExTaq(TaKaRa,RR420A)10 μL、10 mmol·L-1正向引物 0.8 μL、10 mmol·L-1反向引物 0.8 μL、cDNA 模板 1 μL 和 ddH2O 7.4 μL,共计 20 μL。 PCR 扩增条件的设置为 95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40 个循环后增加熔解曲线。每个样品进行 3 次重复,采用 2-ΔΔCt法[27]进行基因表达量的相对定量分析。

表1 本研究所用引物Table1 Primer used in this study
2 结果分析
2.1 陆地棉SPS基因家族成员的鉴定
通过BLASTP 分析,在陆地棉基因组中共鉴定到10 个蔗糖磷酸合成酶基因, 按照它们在染色体上位置和顺序, 分别将其命名为GhSPS1~GhSPS10(表2)。 10 个GhSPS的基因组大小在5 039 bp(GhSPS3)~6 580 bp(GhSPS5)之间,编码区序列长度 3 108 bp(GhSPS1)~3 189 bp(Gh-SPS2)之间。 对GhSPS基因编码的蛋白进行分析发现,GhSPS 蛋白的氨基酸长度在1 035 aa(Gh-SPS1)到 1 062 aa(GhSPS2)之间,蛋白分子量在116.83 kDa(GhSPS6)到 119.73 kDa(GhSPS2)之间,等电点从 6.429(GhSPS8)到 7.201(GhSPS1)不等,其中等电点小于7 的GhSPS 蛋白有8 个,占80%,表明陆地棉SPS 蛋白主要以弱酸性蛋白存在(表2)。

表2 陆地棉蔗糖磷酸合成酶基因家族成员Table2 Members of sucrose phosphate synthase gene family in G.hirsutum
2.2 陆地棉SPS家族成员的蛋白序列分析
先前研究表明植物SPS 蛋白普遍具有2 个保守的蛋白结构域,分别是位于N 端的葡糖基转移结构域 (glycosyltransferase domain) 和位于C端的 SPP-like 结构域(SPP-like domain)[28-29],且存在3 个相对保守的蛋白磷酸化位点, 分别为光/暗调控位点(Ser-158),14-3-3 调控蛋白结合位点(Ser-229)和渗透压调控位点(Ser-424)[28,30-31]。 对陆地棉SPS 家族成员的蛋白结构域和磷酸化位点进行分析发现,10 个GhSPS 蛋白均具有保守的葡糖基转移结构域和 SPP-like 结构域 (图1);蛋白磷酸位点在陆地棉SPS 蛋白间相对保守,4 个 GhSPS 蛋白不具有 Ser-158 磷酸化位点,6 个 GhSPS 蛋白不具有 Ser-229 磷酸化位点,4 个GhSPS 蛋白不具有Ser-424 磷酸化位点(图1)。

图1 陆地棉GhSPS 蛋白的多序列比对Fig.1 Multiple sequence alignment of GhSPS proteins in G.hirsutum
2.3 陆地棉SPS家族成员的系统进化分析
先前研究表明, 植物SPS 基因家族的A、B和C 亚族广泛存在于单子叶植物和双子叶植物,而D 家族仅存在于单子叶植物中[32]。 为了了解陆地棉SPS 家族基因在进化上的位置及亲缘关系,本研究对拟南芥、水稻、烟草、高粱、雷蒙德氏棉、亚洲棉、海岛棉和陆地棉共8 个物种的46 条蛋白序列进行系统进化分析。 结果表明, 植物的SPS 蛋白在进化上聚为 A、B、C 和 D 共 4 个亚族 , 其 中 陆 地 棉 GhSPS2、GhSPS3、GhSPS5、GhSPS7、GhSPS8 和 GhSPS10 属 于 A 亚 族 ,GhSPS4 和 GhSPS9 属 于 B 亚 族 ,GhSPS1 和GhSPS6 属于C 亚族,不存在 D 亚族成员,且陆地棉SPS 蛋白与来源于同源染色体A 亚组和D亚组的SPS 蛋白聚于同一分支(图2)。 进一步对SPS 蛋白在不同亚族的分布情况进行分析发现,A 亚族包含较多的成员,包含6 个陆地棉GhSPS蛋白,2 个拟南芥 AtSPS 蛋白,1 个水稻 OsSPS蛋白,1 个烟草 NtSPS 蛋白、1 个高粱 SoSPS 蛋白、6 个海岛棉 GbSPS 蛋白、3 个雷蒙德氏棉GrSPS 蛋白和 3 个亚洲棉 GaSPS 蛋白;B 亚族包含的成员数次之,包含2 个陆地棉GhSPS 蛋白,1个拟南芥 AtSPS 蛋白,2 个水稻 OsSPS 蛋白,1个高粱 SoSPS 蛋白、1 个烟草 NtSPS 蛋白、2 个海岛棉GbSPS 蛋白、1 个雷蒙德氏棉GrSPS 蛋白和1 个亚洲棉GaSPS 蛋白;C 亚族包含的成员数最少, 包含 2 个陆地棉 GhSPS 蛋白,1 个拟南芥At SPS 蛋 白 ,1 个 水 稻 OsSPS 蛋 白 、1 个 烟 草NtSPS 蛋白、2 个海岛棉 GbSPS 蛋白、1 个雷蒙德氏棉 GrSPS 蛋白和 1 个亚洲棉 GaSPS 蛋白;D亚族仅包含单子叶植物的SPS 蛋白,包含2 个水稻 OsSPS 蛋白和 1 个高粱 SoSPS 蛋白(图 2)。
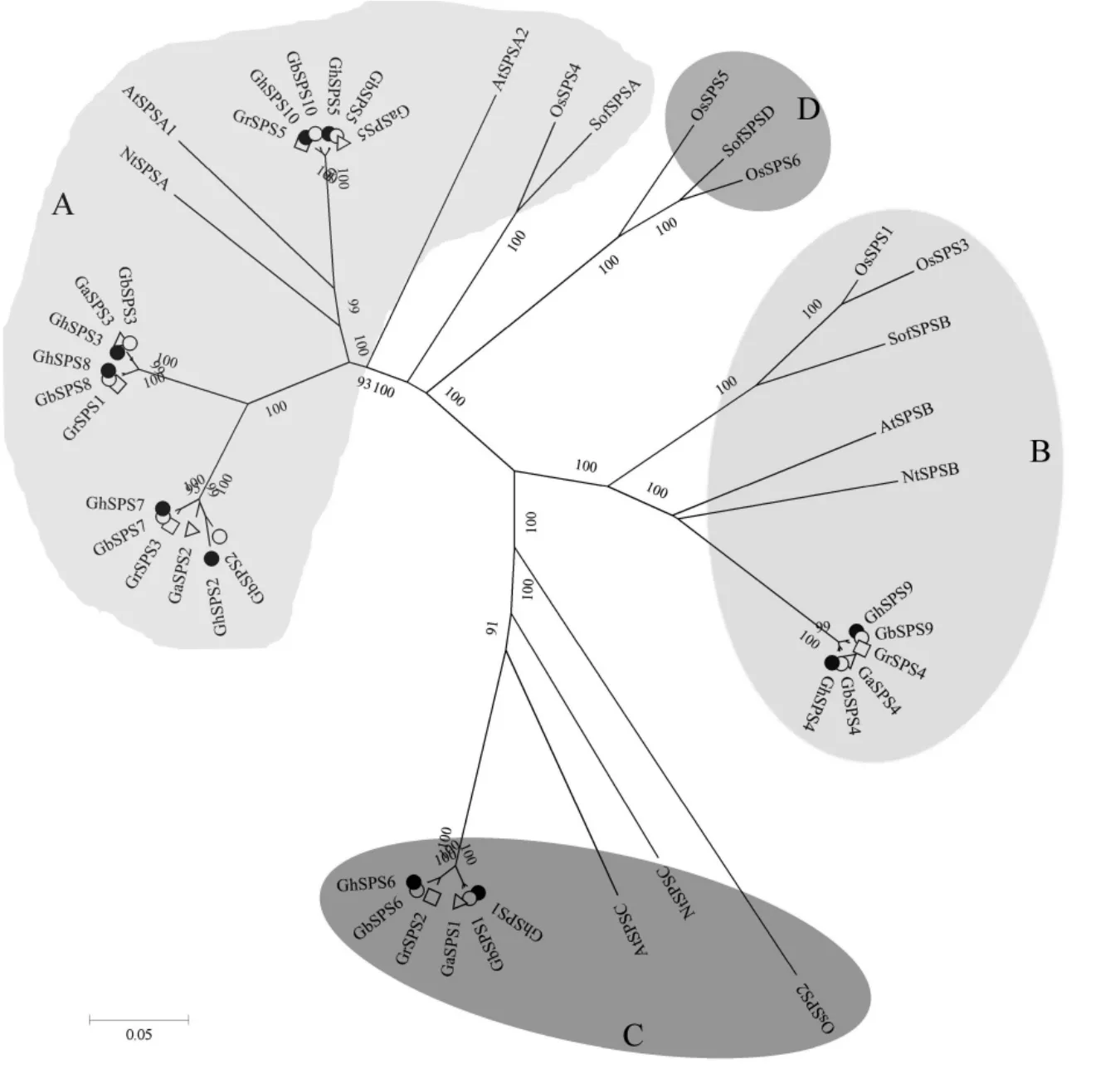
图2 陆地棉与其它物种SPS 蛋白的系统进化分析Fig.2 Phylogenetic relationship between the SPS proteins in G.hirsutum and other species
2.4 陆地棉SPS家族成员的基因结构分析
基因结构分析表明,10 个GhSPS基因均含有内含子和外显子,且位于同一亚族的GhSPS基因具有相似的外显子- 内含子分布模式 (图3);不同亚族间GhSPS基因的外显子/ 内含子数目差异较大, 其中A 亚族成员的GhSPS基因具有13 个外显子和 12 个内含子;B 亚族成员的GhSPS基因均具有12 个外显子和11 个内含子;C 亚族成员的GhSPS基因均具有13 个外显子和12 个内含子(图3);陆地棉不同亚族成员基因外显子和内含子数目的差异,表明不同的陆地棉SPS基因在进化过程中其结构或功能已经发生了分化。
2.5 陆地棉SPS家族成员的染色体分布
陆地棉SPS 基因家族的10 个成员分别分布在A 亚组和D 亚组的5 条染色上, 且每条染色体各包含1 个GhSPS基因(图4);基因复制分析表明,该家族成员无串联复制,存在两个片段复制事件GhSPS2/GhSPS3 和GhSPS7/GhSPS8,表明片段复制可能导致了GhSPS基因在陆地棉基因组中的扩增。

图3 陆地棉SPS 家族成员的系统进化树和基因结构示意图Fig.3 Phylogenetic relationship and gene structure of SPS family numbers in G.hirsutum
2.6 陆地棉SPS基因家族表达特性的转录组分析
转录组分析表明,不同亚族的GhSPS基因具有不同的组织表达特性(图5)。B 亚族的GhSPS4和GhSPS9 主要在叶片中表达量最高,在其它组织表达量很低或者不表达,表明该亚族基因可能参与源器官中蔗糖的合成与积累。 C 亚族的GhSPS1 和GhSPS6 在纤维中表达量最高, 其次是叶片和花瓣,在茎和根中表达量较低,表明该家族基因可能主要参与棉纤维的发育和形成。 A亚 族 的GhSPS2、GhSPS3、GhSPS5、GhSPS7、GhSPS8 和GhSPS10 在被检测的组织均具有较高的表达,表明该家族基因可能参与棉花生长发育的多个过程。 进一步对GhSPS基因的表达特性进行聚类分析发现,陆地棉SPS 家族基因的表达模式可分为2 类, 一类是组织特异性表达基因,包括B 亚族全部基因成员,另一类是非组织特异性表达基因, 包括A 亚族和C 亚族的全部基因成员(图5)。陆地棉不同亚族GhSPS基因的不同组织表达特性,表明它们的功能在进化过程中可能受到了选择作用。
2.7 陆地棉SPS基因组织表达特性的qRTPCR分析
为了验证陆地棉SPS 基因家族的组织表达特性, 本研究进一步通过荧光定量PCR 的方法分析了GhSPS4(亚族 B)、GhSPS1(亚族 C)、Gh-SPS7(亚族 A)和GhSPS10(亚族 A)的组织表达特性。 结果表明,GhSPS4 在叶片中表达量很高,叶片是植物进行光合作用的主要位置,在其它组织表达量很低或者不表达(图6A),表明该基因在源器官中光合产物的积累方面可能起着重要作用,该结果与B 亚族基因的转录组分析结果一致。GhSPS1 在叶片中表达量较高,其次是花瓣,在纤维中表达量较低(图6B)。转录组分析表明C亚族SPS基因在纤维中有较高的表达,GhSPS1在纤维中较低的表达可能跟所检测的纤维发育时期不同有关。GhSPS7 和GhSPS10 在被检测的各个组织均有较高的表达(图6C、6D),该结果与A 亚族SPS基因的转录组分析结果较一致。

图4 陆地棉SPS 家族基因的染色体分布和基因复制分析Fig.4 Chromosomal distribution and gene duplication analysis of SPS family genes in G.hirsutum

图5 陆地棉GhSPS 基因组织表达特性的转录组分析Fig.5 Transcriptome analysis of tissue expression pattern of%GhSPS genes in G.hirsutum
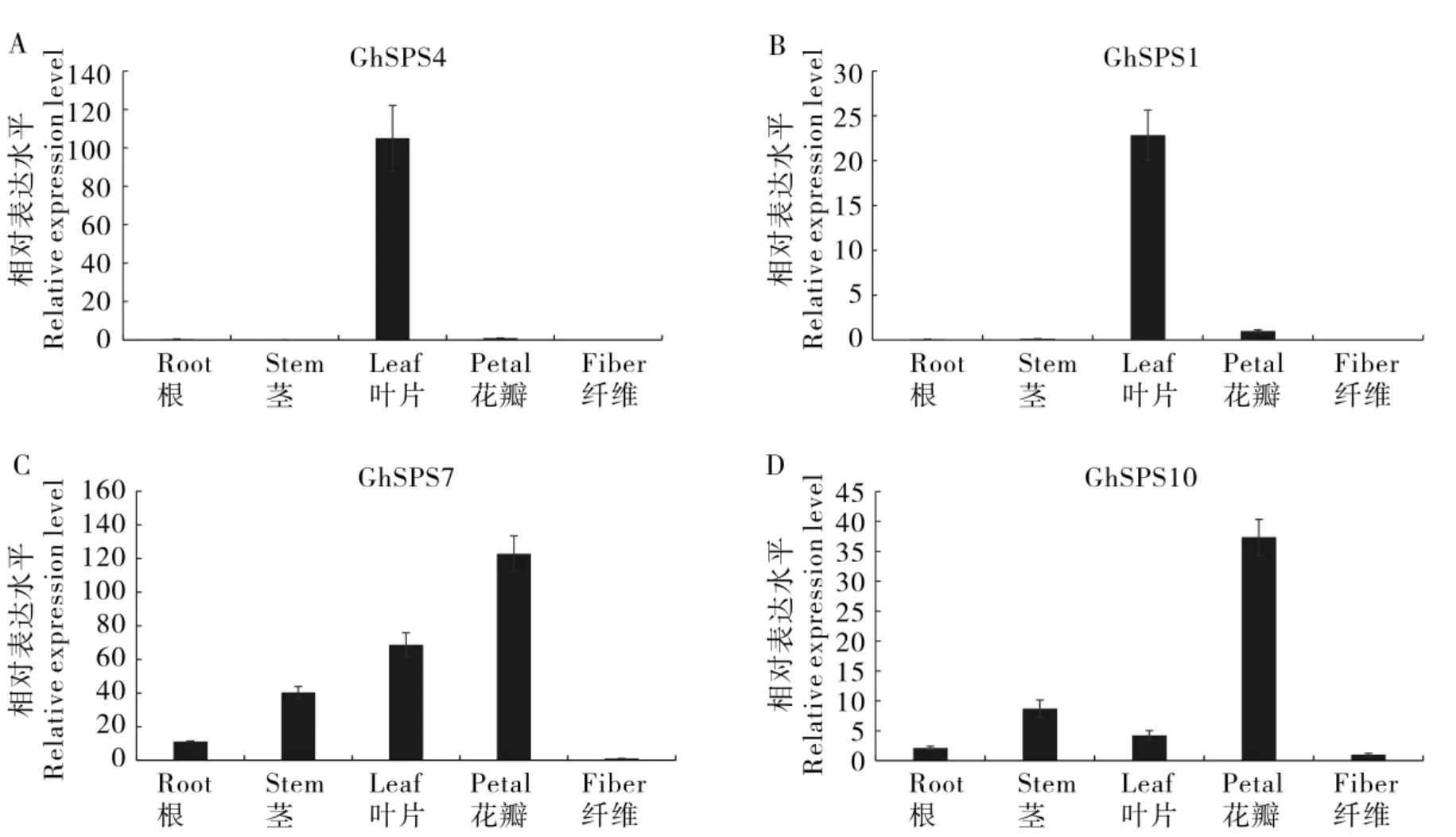
图6 陆地棉GhSPS 基因组织表达特性的荧光定量PCR 分析Fig.6 Quantitative real-time PCR analysis of tissue expression pattern of GhSPS genes in G.hirsutum
3 讨论
蔗糖磷酸合成酶是调控蔗糖合成的关键酶,自1975 年在小麦胚芽中被发现以来[33],随着研究的深入,发现SPS 在植物的光合组织和非光合组织中均广泛存在[34],暗示着SPS 可能参与植物生长发育的多个过程。 有证据表明,高等植物的基因组中至少含有1 个SPS基因[5,35],随着更多物种基因组测序的完成,人们发现植物SPS基因主要以基因家族的形式存在,其成员数量因物种不同而异[32]。 本研究利用新公布的陆地棉基因组数据,对陆地棉SPS 基因家族进行了全基因组鉴定和系统分析。
3.1 陆地棉SPS基因家族的进化
在陆地棉基因组中共鉴定到10 个SPS基因(表2),然而,大多数植物的基因组中存在3~5个SPS基因,玉米和大豆的基因组至少存在7 个SPS基因[21]。 不同植物SPS 家族基因数量的差异,主要是进化过程中的基因扩增导致的,其中基因组加倍扮演着重要的角色。 陆地棉是由两个祖先种杂交形成的异源四倍体(AADD),杂交导致的基因组加倍会增加基因的拷贝数,因此,陆地棉基因组中数量较多的SPS基因可能与其经历的基因组加倍事件有关。 另外,在本研究中,陆地棉SPS 基因家族可分为 A、B 和 C 三个亚族, 不存在 D 亚族(图 2)。 前人研究表明,A、B 和 C 亚族广泛存在于单子叶植物和双子叶植物,D 亚族仅存在于单子叶植物中[32],本研究结果与该研究相一致。
3.2 陆地棉SPS基因家族的差异表达
对于植物的SPS 基因家族而言,不同亚族间SPS基因的表达特性和功能差别很大[36]。 在本研究中, 陆地棉不同亚族GhSPS基因具有不同的组织表达特性(图5)。 B 亚族GhSPS基因在叶片中表达量很高,表明其可能主要参与源器官中蔗糖的合成。在水稻中,B 亚族的OsSPS1 基因在源器官叶片中高表达,且其表达不受发育时期的影响,因此,OsSPS1 被认为是水稻源器官特异性表达的基因[37]。 在荔枝中,B 亚族LcSPS3 基因在成熟的叶片中表达量很高[28]。 B 亚族SPS基因在叶片中的特异性高表达,暗示着它们在源器官光合产物的积累方面可能起着重要作用。 在许多植物中,A 亚族SPS基因常被认为是植物重要的看家基因[38],该亚族SPS基因在各个被检测的组织均有较高的表达,例如在甘蔗[39]、柑橘[35]和烟草[38]中。 此外,过表达拟南芥A 亚族SPS基因,可以显著增加棉花库器官的蔗糖水平,而不改变源器官的蔗糖水平,提高库器官纤维的长度[40]。本研究中, 陆地棉A 亚族SPS基因在被检测的各个组织均表达量很高(图5),但是它们的表达是否会影响棉花库器官的强度和生长发育仍需进一步地研究。 研究表明,C 亚族SPS基因与淀粉降解后蔗糖的合成密切相关, 其表达具有生物钟特性,在晚上表达量很高[38]。 在烟草中,通过RNA干扰技术抑制C 亚族NtSPSC的表达,可抑制淀粉降解的过程, 使其叶片中淀粉含量增加3~8倍[38]。 在本研究中,陆地棉 C 亚族GhSPS基因在纤维中表达量很高,表明它们的功能可能与棉纤维的发育有关,这为通过分子育种提高棉纤维品质提供了基因信息。
3.3 SPS基因的转录后调控
目前认为,SPS 活性不仅受基因表达的转录水平调控, 还受蛋白磷酸化的转录后调控[41]。Ser-158 是植物SPS 蛋白响应光/ 暗信号的磷酸化修饰位点[42],该位点在植物中高度保守[43],表明植物的SPS 活性受光/暗信号调控。 此外,SPS活性还受14-3-3 蛋白的磷酸化调控[44],14-3-3 蛋白可与SPS 蛋白磷酸化位点Ser-229 发生互作[45],抑制14-3-3 蛋白的表达可以导致SPS 活性升高和蔗糖积累的改善[46]。Ser-424 是菠菜响应渗透压的磷酸化修饰位点[47],该位点在植物中相对保守。在本研究中, 对3 个蛋白磷酸化位点在陆地棉GhSPS 蛋白间相对保守(图1),说明转录后调控可能也参与了陆地棉SPS 蛋白活性的调控。 因此,在今后的研究中,一方面要继续深入研究棉花SPS基因的功能, 另一方面, 还要深入研究SPS 表达/ 活性调控的分子机制,为今后通过调控SPS 活性,实现棉花产量和品质的提高提供新途径。
4 结论
本研究在陆地棉基因组中共鉴定到10 个GhSPS基因, 它们均匀地分布在A 亚组和D 亚组的5 条染色体上,且具有SPS 家族特有的蛋白结构域和磷酸化位点。陆地棉SPS 家族成员可分为3 个亚族,同一亚族的SPS基因具有相似地外显子-内含子分布模式。 转录组和荧光定量PCR分析表明, 不同亚族GhSPS基因具有不同的组织表达模式, 其中A 亚族GhSPS基因在被检测的各个组织均有较高的表达,B 亚族GhSPS基因在叶片中高表达,C 亚族GhSPS基因在纤维、叶片和花瓣中高表达。 这些研究结果为深入解析陆地棉SPS 家族基因的功能奠定理论基础。

