骨化三醇对老年髋部脆性骨折患者骨代谢指标和骨密度的影响
于树军,王敬博,杨 阳,王裕民,贾 健
(1.天津医科大学研究生院,天津300070;2.天津市天津医院创伤骨科,天津300211)
骨质疏松症(osteoporosis)是由于多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆性增加,继而增加骨折风险的全身性骨病[1]。骨折是常见的严重并发症,主要以髋部骨折危险性最严重。随着骨质疏松症机体骨脆性的增加,骨折风险也显著增加,严重者可以导致患者生活不便,生活质量下降。中老年人由于身体机能下降,尤其是骨流失,更易患骨质疏松症,发生骨折。近年来,我国逐渐步入老年社会,骨质疏松症的发病率逐年递增。据流行病学资料显示,我国60 岁以上患者骨质疏松症发病率约为22.6%[2]。
目前基于对骨质疏松症的临床研究,医护人员在治疗过程中依旧采取保守治疗及外科手术治疗策略,主要关注抗骨质疏松的预后效果。运用有效的药物,实施合理的治疗方案改善骨质疏松老年患者的生活质量是目前迫切需要解决的问题。有研究发现维生素D 对人体的骨骼发育及肌肉系统起着重要的作用,主要影响激素等促进牙齿和骨骼的生长发育[3]。有研究报道,25-羟维生素D[25-(OH)D]、甲状旁腺激素(PTH)和碱性磷酸酶(ALP)是影响骨质疏松患者的关键因素[4]。本研究通过分析不同剂量骨化三醇对老年髋部骨质疏松骨折患者骨代谢相关指标和骨密度的影响,为临床上改善老年骨质疏松骨折骨质量提供新的可能治疗策略。
1 资料与方法
1.1 一般资料 本研究筛选自2017 年3 月-2018 年11 月收治在天津医院的骨质疏松性骨折患者共200 例,其中男性100 例,女性100 例。所有患者均符合WHO 推荐的骨质疏松症的相关诊断标准[5]。纳入标准:女性患者60 岁以上,男性患者65 岁以上;受伤机制为日常生活中跌伤,骨质疏松性骨折患者。患者及家属知情并同意参与该研究项目。排除标准:女性60 岁以下和男性65 岁以下患者;其他代谢性骨病患者;受伤机制为车祸伤或坠落伤;入院时血25(OH)D>30 ng/mL 者;正在接受糖皮质激素等激素治疗患者;有严重肝肾功能不全患者;伤后6 个月内患者去世或失去联系。
1.2 分组及治疗方法 根据随机数字表法,将患者随机分为治疗1 组和治疗2 组,每组各100 例。1 组患者口服骨化三醇(上海罗氏制药有限公司,国药准字20151015),0.25 μg/d;2 组患者口服骨化三醇0.5 μg/d。两组患者均连续治疗6 个月。两组患者在治疗期间均未服用抑制骨破坏的药物。
1.3 观察指标
1.3.1 BMD 的检测 在治疗前、治疗后6 个月,分别采用双能X 射线吸收法骨密度检测对患者股骨颈,髋部骨密度(BMD)进行测定。
1.3.2 血磷、血钙、BALP、25-(OH)D 和PTH 的检测 两组患者分别于治疗前、治疗后3 个月、6 个月分别抽取5 mL 静脉血,室温静置2 h,以3 000 rpm离心10 min,析出血清,吸取上清保存于-80 ℃冰箱待测。利用血液自动分析仪检测患者血磷、血钙、BALP。采用酶联免疫吸附试验法检测血清中25-(OH)D,化学发光法测定PTH。
1.3.3 血清中骨转化指标β-CTx、P1NP 水平的检测 采用化学发光法分别检测治疗前、治疗后3 个月,6 个月患者血清中β-CTx、P1NP 的水平。
1.4 统计学分析 采用SPSS 21.0 统计学软件进行数据的分析和处理,计量资料经正态分布检验后,采用±s或中位数形式表示,计数资料以率(%)表示。对于正态分布、方差齐性计量资料采用参数检验,两组计量资料的比较采用t检验,非正态分布计量资料采用Mann-WhitneyU检验。两组样本率的比较采用χ2检验。P<0.05 表示差异显著,具有统计学意义。
2 结果
2.1 患者基本特征 1 组男性53 例,女性47 例;年龄62~78 岁,平均(66.7±5.9)岁。其中3 例患者因精神障碍未能完成随访,2 例患者因合并内科疾患未能完成随访。2 组男性47 例,女性53 例;年龄63~76 岁,平均(66.3±6.9)岁。其中4 例患者因合并内科疾患死亡,3 例患者因自身原因未能参加随访。
2.2 患者股骨颈和髋部骨密度的影响 治疗前,治疗6 个月后分别检测股骨颈和髋部骨密度,结果表明,治疗6 个月1 组股骨颈及髋部骨密度与治疗前无明显差异(P分别为0.847 和0.884),2 组患者股骨颈和髋部骨密度较治疗前增加,但无统计学意义(P分别为0.787 和0.730),见表1。治疗6 个月后,两组患者股骨颈和髋部骨密度比较无明显差异(P分别为0.939、0.236)。治疗前后骨密度没有明显差异,可能与骨密度灵敏度较低有关,如果进一步延长随访时间,可能会得到有差异的结果。
表1 两组患者股骨颈和髋部骨密度的比较(±s)
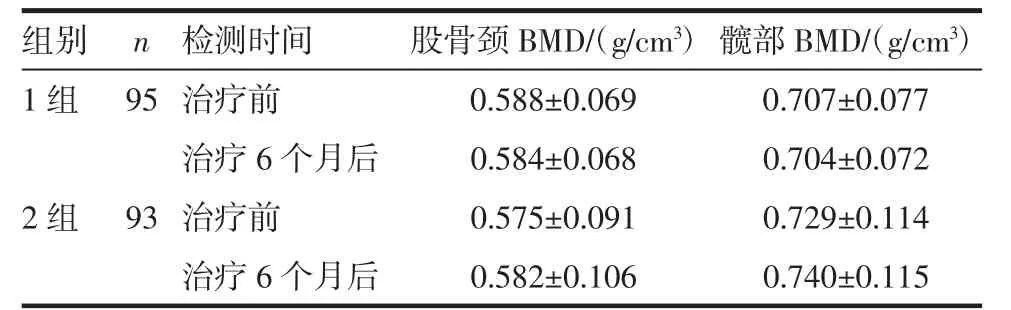
表1 两组患者股骨颈和髋部骨密度的比较(±s)
组别 n 检测时间 股骨颈BMD/(g/cm3) 髋部BMD/(g/cm3)1 组 95 治疗前 0.588±0.069 0.707±0.077治疗6 个月后 0.584±0.068 0.704±0.072 2 组 93 治疗前 0.575±0.091 0.729±0.114治疗6 个月后 0.582±0.106 0.740±0.115
2.3 患者血磷、血钙、BALP、25-(OH)D 及PTH 的影响 治疗3 个月,6 个月后,两组患者血清中血钙、血磷较治疗前均增加,差异有统计学意义(P<0.01),但两组间比较,治疗后血钙、血磷水平无明显差异(P>0.05),见表2。治疗3 个月、6 个月后,和治疗前比较,1 组和2 组患者血清中BALP 均降低,差异显著(P<0.05)具有统计学意义;与1 组比较,治疗6 个月后2 组中患者血清中BALP 含量显著降低,差异显著,具有统计学意义(P<0.05),见表2。和治疗前比较,2 组和1 组治疗3 个月、6 个月后,血清中25(OH)D 均增加,治疗6 个月后,1 组和2 组差异均明显,具有统计学意义(P<0.05);和1 组比较,2组中25(OH)D 显著增加,差异显著,具有统计学意义(P<0.05),见表2。和治疗前比较,2 组和1 组在治疗6 个月后,血清中PTH 均显著降低,差异显著,具有统计学意义(P<0.05);和1 组比较,治疗6 个月后,2 组中PTH 显著降低,具有统计学意义(P<0.01),见表2。
表2 两组患者治疗前后生化指标的比较(±s)
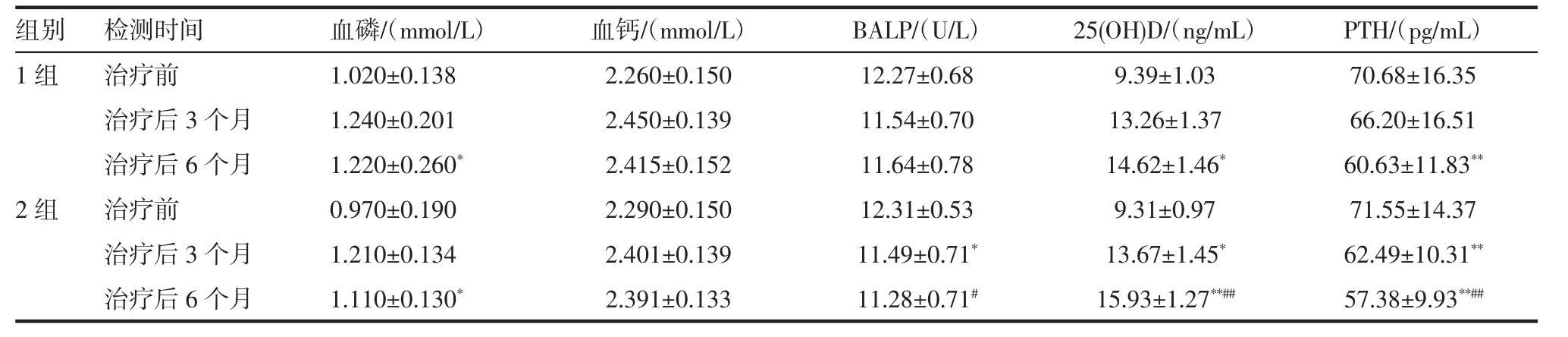
表2 两组患者治疗前后生化指标的比较(±s)
和治疗前比较,*P<0.05,**P<0.01;和1 组比较,#P<0.05,##P<0.01
25(OH)D/(ng/mL) PTH/(pg/mL)9.39±1.03 70.68±16.35 13.26±1.37 66.20±16.51 14.62±1.46* 60.63±11.83**2 组 治疗前 0.970±0.190 2.290±0.150 12.31±0.53 9.31±0.97 71.55±14.37治疗后3 个月 1.210±0.134 2.401±0.139 11.49±0.71* 13.67±1.45* 62.49±10.31**治疗后6 个月 1.110±0.130* 2.391±0.133 11.28±0.71# 15.93±1.27**## 57.38±9.93**##组别 检测时间 血磷/(mmol/L) 血钙/(mmol/L)1 组 治疗前 1.020±0.138 2.260±0.150治疗后3 个月 1.240±0.201 2.450±0.139治疗后6 个月 1.220±0.260* 2.415±0.152 BALP/(U/L)12.27±0.68 11.54±0.70 11.64±0.78
2.4 患者血清中β-CTx、P1NP 的变化和治疗前比较 治疗3 个月、6 个月后,1 组和2 组患者血清中β-CTx 明显降低,P1NP 明显升高,差异显著,具有统计学意义(P<0.001),见表3。而2 组患者之间比较治疗前后β-CTx、P1NP 均无明显差异。

表3 两组患者治疗前后β-CTx 和P1NP 的比较
3 讨论
老年骨质疏松症属于原发性骨质疏松症,由于机体的衰老导致的骨量减少,骨微结构破坏导致骨脆性增加极易发生骨折的一类全身性疾病。有研究证实,骨质疏松是由多种因素引起的病理结果,主要包括激素调控(雌激素、甲状旁腺素、降钙素)、营养状态(钙、磷)、免疫功能及特定的遗传因素[6-8]。骨质疏松症临床表现不明显,多数患者骨折发生后才意识到骨质疏松的存在。因此早发现,提前预防骨质疏松的发生具有非常重要的意义。
骨密度是目前临床诊断骨质疏松的金标准,因此老年人需定期监测骨密度,预防可以一定程度减少骨质疏松性骨折的发生。本研究结果显示,骨化三醇可以维持骨质疏松骨折患者的骨量,防止骨密度进一步减低。但不同剂量的骨化三醇对于老年髋部骨质疏松性骨折患者的骨密度的影响无明显差别。
目前骨质疏松患者发生髋部骨折病例逐年增多,此类患者除了骨密度检测严重骨质疏松外,临床检测中发现血液中25-(OH)D 水平降低和PTH升高,BALP 升高的情况。25-(OH)D 是维生素D 在体内的贮存、转运形式,直接反映体内维生素D 的水平,维生素D 参与骨代谢,且能保持肌力正常,参与免疫调节作用。骨化三醇可以增加骨质疏松患者血清中25-(OH)D 的水平,维持骨代谢正常,减少骨流失。BALP[9]可以反应成骨改变的早期状态。骨质疏松症发生时,BALP 异常增高,骨化三醇治疗后,BALP 减少,可以调节骨代谢。甲状旁腺素能够对骨细胞和破骨细胞产生正性促进作用,提高破骨细胞的活性,加重其对骨组织的损伤,直接导致骨密度降低[10],骨脆性增加,骨折风险升高。本研究证实,高剂量的骨化三醇较低剂量的骨化三醇更能升高25-(OH)D 的水平,降低PTH 及ALP 的水平,调节骨细胞与破骨细胞的动态平衡,从而减缓骨组织的损伤。
国际骨质疏松基金会建议骨转换标志物的变化作为临床研究的首选。其中血清1 型前胶原N 端前肽(type 1 procollagen amino terminal peptide,P1NP)和血清1 型胶原羧基末端肽(type 1 collagen carboxyl terminal peptide,β-CTX)具有敏感性相对较高的优势[11-12]。P1NP 是骨形成的特异性标志物,是目前发现的唯一存在于骨和软骨中的胶原类物质,约占骨基质的90%以上。P1NP 主要反映了Ⅰ型胶原的合成速率及骨转换情况,升高则提示合成速率增快,骨转换表现活跃;当成骨细胞合成减少时,P1NP 水平就会下降[13]。本研究证实,骨化三醇可以上调P1NP 的水平,表明骨化三醇可以改善骨细胞活性。
β-CTx 为骨吸收的生化标志物,主要反映了骨代谢的变化,其活性与骨细胞活性增高一致[14]。同时β-CTx 与骨重吸收程度相关,骨质疏松症发生时,β-CTx 显著增加,对抗骨的重吸收。骨化三醇治疗后,患者血清中β-CTx 显著降低。但本研究中不同剂量的骨化三醇治疗后,β-CTx 及P1NP 两组间无明显差异。
综上所述,骨化三醇可以显著改善老年骨质疏松症患者,增加25-(OH)D,下调PTH,BALP,口服剂量大者效果更明显;同时上调P1NP 的水平,降低β-CTx,调节骨代谢,影响患者骨密度防止其进一步减低,使得骨质疏松症状得到缓解。这提示患者在临床治疗过程中需要在基础治疗方案中辅以骨化三醇等补充维生素D 的药物,具有一定临床推广价值。由于样本含量小,以及患者依从性不一,功能活动及下地负重时间不同,膳食等多方面因素的原因,实验数据可能存在一定偏差。为了最终目标,明确维生素D 及P1NP 等骨质疏松检测指标之间的关系还需要大样本、多中心的随机对照研究达成临床共识。通过增加样本量,延长随访时间,增加口服维生素D 的剂量来进一步明确他们之间的关系,为指导临床用药提供依据。

