NPPA rs198358基因多态性与持续不卧床腹膜透析患者容量状况的相关研究
黄冰莹 韦海媛 苏和平 陆正宇 黄子艳黎伟 蒙如庆 黄剑华 韦秀芳
1广西医科大学第二临床医学院(南宁530021);2广西医科大学第二附属医院肾内科(南宁530007);3广西河池市人民医院肾内科(广西河池547000);4广西凤山县人民医院肾内科(广西凤山547600);5广西武鸣人民医院肾内科(广西武鸣530100)
持续不卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)作为终末期肾脏病替代治疗的主要方式已被越来越多的患者所接受。容量相关并发症是CAPD 常见并发症,容量负荷是患者发生心血管并发症及死亡的独立危险因素[1-2]。临床上评估CAPD 容量状态相关检测指标包括有:水肿、中心静脉压、血压、左室肥厚、脑利钠肽水平及生物电阻抗等[3-6]。但仍缺乏敏感有效的容量负荷评定生物标志物。
B型脑钠肽(brain natriuretic peptide,BNP)及其前体(N-terminal pro-brain natriuretic peptide,NTproBNP)是近年受关注且公认的容量状况评定指标,尤其NT-proBNP 目前已被临床广泛应用于评估容量负荷,但实际上对腹透患者容量负荷的特异度和预测效率仍有限。近年发现,编码利钠肽蛋白的NPPA 基因发生遗传变异会影响BNP和NT-proBNP 水平,导致水钠潴留及血压波动,在容量状态调节中可能起关键作用。且研究[7-10]表明NPPA rs198358 多态性与血NT-proBNP 水平变化、血压波动及高血压发生等显著相关。由此推测,NPPA 基因多态性与CAPD 患者容量状况相关。目前关于NPPA 基因多态性与CAPD 容量状况相关研究少见报道,本研究拟探讨NPPA 基因多态性与CAPD 容量状况的关联性,为寻找有效评定CAPD 容量状况的指标提供新的思路。
1 对象与方法
1.1 研究对象选取2017年1月至2019年1月在广西医科大学第二附属医院肾内科规律随访的CAPD 患者,入选标准:年龄≥18岁,规律CAPD ≥1个月。排除标准:同时行血液透析治疗的患者;近1个月有腹膜炎或其他部位急性感染史;近1个月内使用糖皮质激素及免疫抑制剂的患者;合并严重肝功能不全、慢性阻塞性肺疾病、恶性肿瘤、风湿性心脏病等疾病患者。本研究获得广西医科大学第二附属医院伦理委员会批准,入选患者均签署知情同意书。
1.2 一般资料收集收集CAPD 患者相关临床资料,包括腹透龄、尿量、血常规、肝肾功能、血压、电解质、全段甲状旁腺素(intact parathyroid hormone,iPTH)及血清NT-proBNP 等,计算肾小球滤过率估值(estimated glomerular filtration rate,eGFR),行腹膜平衡试验,计算D/P 值,高转运类型定义为0.82~1.03,高平均转运类型定义为0.66~0.81,低平均转运类型定义为0.50~0.65[11]。计算尿素清除指数Kt/V。予心脏彩超检查,记录左室射血分数(left ventricular ejection fraction,LVEF)、左室后壁厚度(left ventricular posterior wall thickness,LVPWT)数据,计算左室重量指数(left ventricular mass index,LVMI)[12],左室肥 厚 定义为男性LVMI ≥115 g/m2,女性LVMI ≥95 g/m2[13]。血压控制目标:血压控制≤140/90 mmHg。
1.3 全血DNA提取 研究对象抽取3 mL 抗凝外周静脉血于-80℃冻存。采用北京天根生化科技公司提供的DNA 提取试剂盒提取基因组DNA,严格按说明书进行操作。
1.4 SNP的选择本研究选择的NPPA rs198358属性见表1。
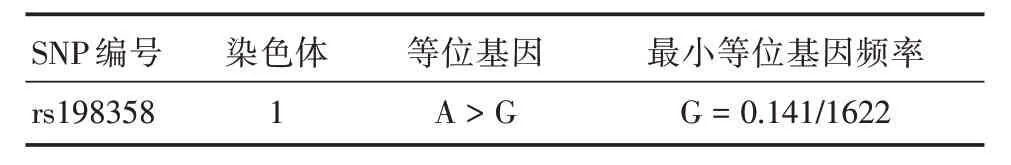
表1 NPPA 基因SNP位点信息Tab.1 The attribute of NPPA SNP
1.5 基因分型基因型结果通过将提取的DNA送至上海生工生物工程有限公司进行测序获得。1.6 统计学方法 采用SPSS 17.0 统计软件,正态分布计量资料用表示,组间比较用t检验。非正态分布资料使用M(P25,P75)表示,组间比较用秩和检验,计数资料比较用χ2检验。Hardy-Weinberg 定律验证群体代表性。多元线性回归分析不同基因型携带与临床容量检测指标的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料本研究共纳入60例CAPD 患者,男女比为1∶1.22,病因:70.0%为慢性肾小球肾炎、15.0%为糖尿病肾病、其他病因占15.0%,平均年龄(43.40 ± 13.78)岁,平均腹透龄(20.10 ±17.79)个月。
CAPD 患者男女的比较中,男性患者有更高的收缩压、舒张压、血iPTH、BUN及血胱抑素C,Kt/V <1.7的患者中男性占比更大(P<0.05)。见表2。
2.2 NPPArs198358基因型及等位基因的分布情况 NPPA rs198358 存在A和G 两种等位基因,组成AA、AG、GG 三种基因型,在CAPD 患者的分布符合Hardy-Weinberg 定律(P= 0.304),AA型在左室肥厚组和高血压组中均占比更高。基因型及等位基因频率在高血压组和非高血压组的分布差异均有统计学意义(P<0.05),而在左室肥厚组和非左室肥厚组的分布差异无统计学意义(P>0.05)。见表3。
2.3 CAPD患者左室肥厚情况与血压水平的关系CAPD左室肥厚组与非左室肥厚组两组间的收缩压及舒张压比较差异均无统计学意义(P>0.05)。线性回归分析显示,CAPD是否伴有左室肥厚与收缩压、舒张压均无相关性(P>0.05)。
表2 CAPD 患者的一般资料Tab.2 The general data in CAPD patients ±s

表2 CAPD 患者的一般资料Tab.2 The general data in CAPD patients ±s
注:体质量指数=BMI、脑钠肽前体=NT-proBNP、全段甲状旁腺素=iPTH、血钙=Ca、血磷=P、尿素氮=BUN、血肌酐=Scr、肾小球滤过率估值=eGFR、左室重量指数=LVMI、左室射血分数=LVEF、左室后壁厚度=LVPWT。LVMI、尿素氮表示为M(QR)。#P 为男女在3种腹膜转运类型间分布情况差异进行比较,*P <0.05
指标例数年龄(岁)透析龄(月)BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)尿量(mL/d)NT-proBNP(pg/mL)iPTH(pg/mL)Ca(mmol/L)P(mmol/L)BUN(mmol/L)Scr(μmol/L)eGFR[mL/(min·1.73 m2)]内生肌酐清除率(mL/min)胱抑素C(mg/L)LVMI(g/m2)LVEF(%)LVPWT(mm)Kt/V D4/P4 Kt/V 大于/小于1.7低平均转运(例)高平均转运(例)高转运(例)女33 46.91±10.07 19.36±20.18 23.27±3.89 126.64±21.72 84.56±13.49 422.73±323.57 4 936.67±194.14 498.11±339.56 2.15±0.25 1.91±0.75 16.00(11.33,18.59)952.91±754.13 5.53±2.66 7.12±2.44 6.52±1.32 131.92(119.20,162.51)68.32±4.22 11.30±1.55 2.37±0.48 0.69±0.08 27/3 9 18 0男27 39.11±16.37 21.00±14.47 23.45±2.89 155.56±21.97 98.56±15.09 464.44±498.65 5 128.44±146.41 1 104.34±528.68 1.974±0.25 2.09±0.69 21.62(16.74,24.75)1 142.78±269.44 4.91±1.77 6.89±1.48 7.83±0.73 161.15(104.94,181.06)64.92±9.41 11.59±1.22 1.69±0.52 0.69±0.14 12/12 9 9 6 t/χ2值-2.163 0.353 0.202 5.105 3.770 0.391 2.755 5.152-2.649 0.987-3.146 1.345-1.073-0.413 4.885-1.376-1.764 0.791-5.033 0.156 10.634 8.854 P 值0.036*0.725 0.841 0.000*0.000*0.697 0.146 0.000*0.010*0.328 0.002*0.186 0.288 0.681 0.000*0.169 0.087 0.432 0.000*0.877 0.001*0.012#*
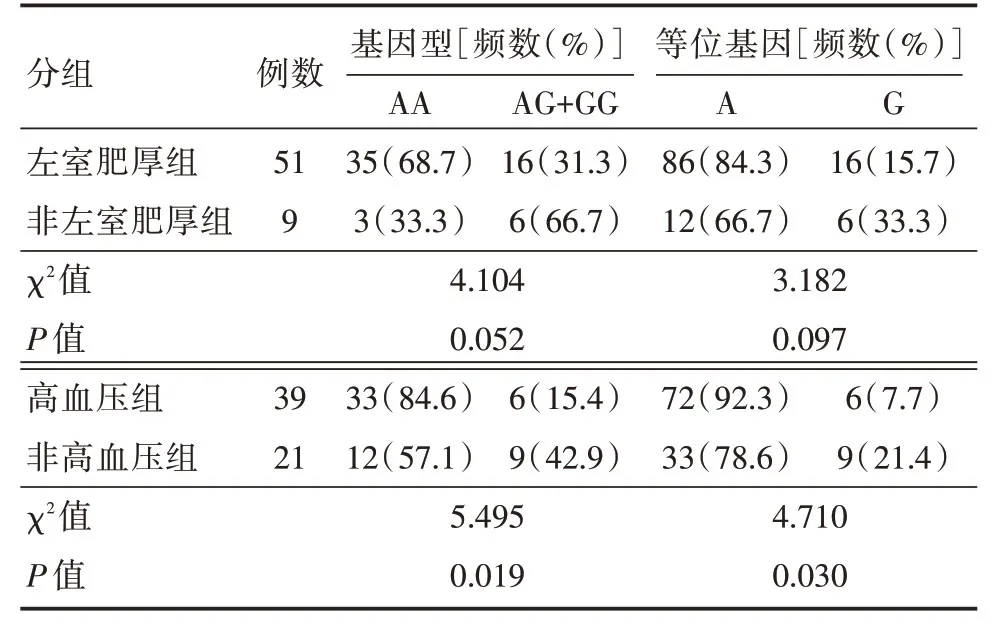
表3 rs198358基因型及等位基因在CAPD 患者的分布情况Tab.3 rs198358 genotypes and alleles distribution in CAPD patients
2.4 NPPA rs198358 不同基因型间临床各指标的比较NPPA rs198358 AA型与AG+GG型的舒张压、BMI和血清NT-proBNP 水平比较的差异有统计学意义(P<0.05),AA型有更高的舒张压、BMI和NT-proBNP 水平。见表4。
2.5 NPPA rs198358 不同基因型携带与腹透相关指标的关系rs198358 AA型与AG + GG型在3种腹膜转运类型间分布差异有统计学意义(P<0.05),而在Kt/V 分布差异无统计学意义(P>0.05)。见表5。
2.6 NPPA rs198358 不同基因型携带与临床各指标的相关性多元线性回归分析显示,NPPA rs198358 AA型携带与CAPD 患者舒张压、BMI、血清NT-proBNP 水平相关(P<0.05)。见表6。
表4 NPPA rs198358 不同基因型间临床各指标的比较Tab.4 Comparison of clinical characteristics between NPPA rs198358 different genotypes±s,M(P25,P75)
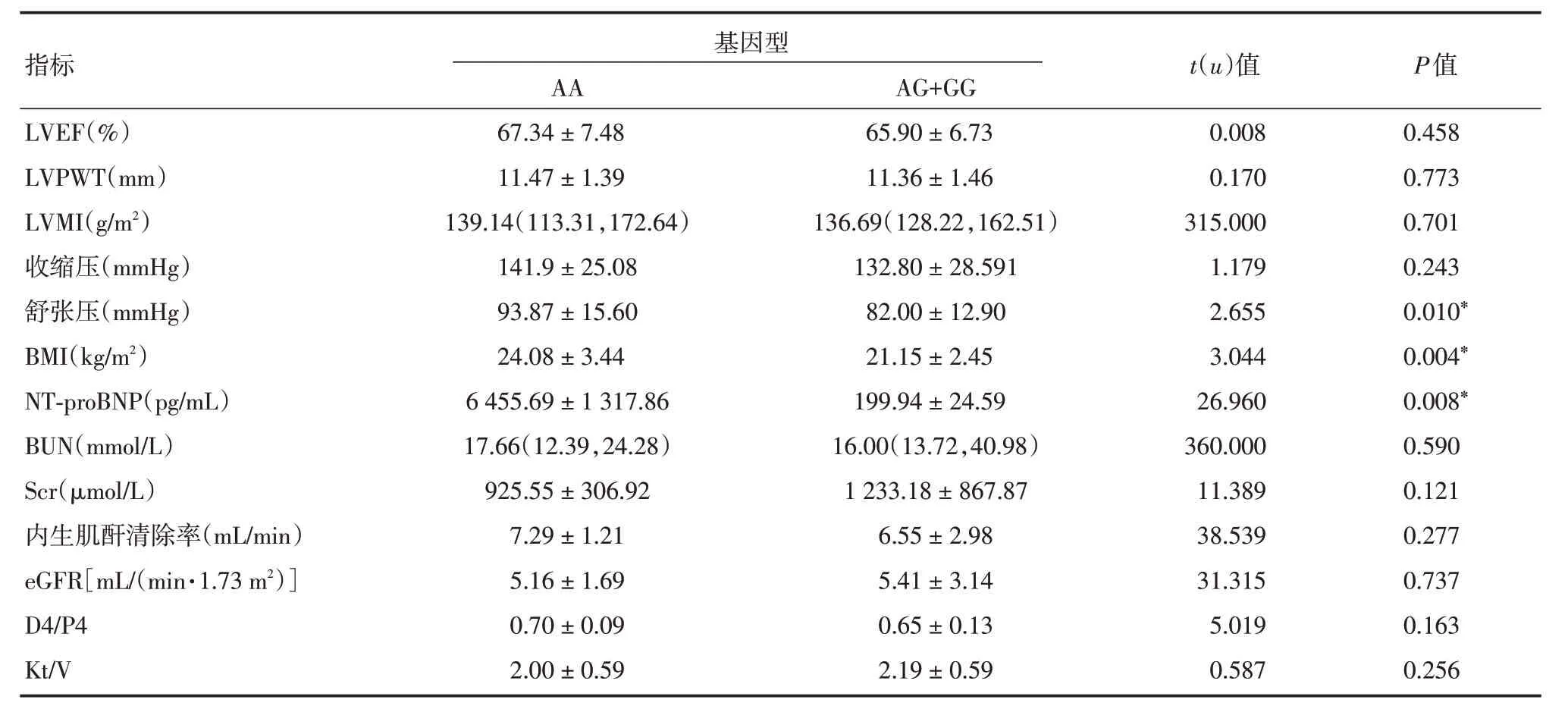
表4 NPPA rs198358 不同基因型间临床各指标的比较Tab.4 Comparison of clinical characteristics between NPPA rs198358 different genotypes±s,M(P25,P75)
指标LVEF(%)LVPWT(mm)LVMI(g/m2)收缩压(mmHg)舒张压(mmHg)BMI(kg/m2)NT-proBNP(pg/mL)BUN(mmol/L)Scr(μmol/L)内生肌酐清除率(mL/min)eGFR[mL/(min·1.73 m2)]D4/P4 Kt/V基因型AA 67.34±7.48 11.47±1.39 139.14(113.31,172.64)141.9±25.08 93.87±15.60 24.08±3.44 6 455.69±1 317.86 17.66(12.39,24.28)925.55±306.92 7.29±1.21 5.16±1.69 0.70±0.09 2.00±0.59 AG+GG 65.90±6.73 11.36±1.46 136.69(128.22,162.51)132.80±28.591 82.00±12.90 21.15±2.45 199.94±24.59 16.00(13.72,40.98)1 233.18±867.87 6.55±2.98 5.41±3.14 0.65±0.13 2.19±0.59 t(u)值0.008 0.170 315.000 1.179 2.655 3.044 26.960 360.000 11.389 38.539 31.315 5.019 0.587 P值0.458 0.773 0.701 0.243 0.010*0.004*0.008*0.590 0.121 0.277 0.737 0.163 0.256

表5 NPPA rs198358 不同基因型与腹透相关指标的关系Tab.5 The relation between characteristics of peritoneal dialysis and NPPA rs198358 genotypes
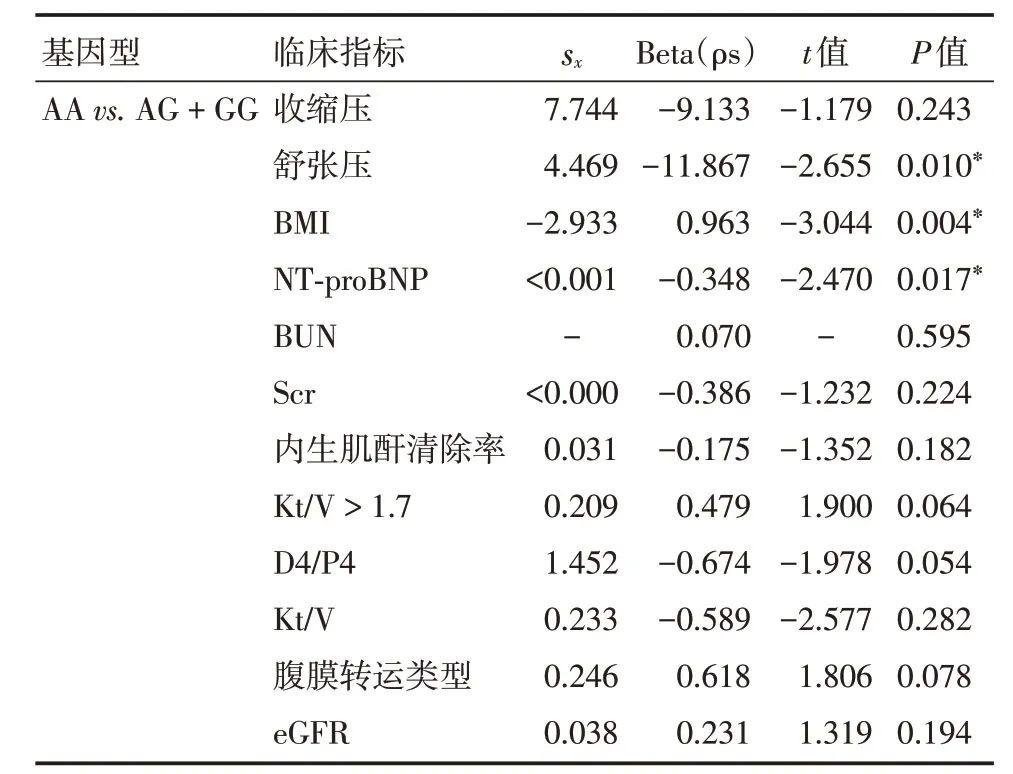
表6 NPPA rs198358基因型携带与各临床指标的多因素分析Tab.6 Multi-factor analysis of association between rs198358 genotypes and clinical characteristics
3 讨论
NT-proBNP是目前临床广泛应用的容量状况评估指标,被认为是终末期肾病患者心血管事件发生和死亡的独立预测因子,但研究发现其在腹透患者容量评估中的作用仍有限及存在不足[3,14-16]。作为可能直接调节NT-proBNP 水平的基因,近年来NPPA SNPs 与容量状况的研究被不断深入开展。针对中国高血压人群的研究提示,NPPA rs5063 TT基因型与高心房钠尿肽水平和较低的高血压风险有关[8],急性左心衰患者的NPPA SNPs与NT-proBNP水平相关[17]。而日本的研究也提示NPPA rs5063可能与盐敏感性高血压相关[18],NPPB rs198389 G等位基因的血压值更低[19]。学者[20-21]认为NPPA基因遗传变异可直接影响NT-proBNP 水平,NPPA基因多态性与血液循环、血压及水钠潴留发生等密切相关。本研究也发现rs198358 AA型有更高的NT-proBNP 水平,rs198358基因多态性与CAPD患者NT-proBNP 水平显著相关,故结合国内外研究及本研究结果推断,NPPA 基因影响NT-proBNP的水平,NPPA 基因多态性与容量指标密切相关,有望成为敏感的评估腹透容量状况早期预测标志物。但一项欧洲的研究[22]显示,rs198358 G 等位基因与血清NT-proBNP 浓度呈正相关,而本研究是携带A 等位基因有显著相关性,此差异可能由于地域环境及群体遗传背景不同等原因所致。
此外,本研究还提示AA型患者腹膜转运类型以高平均转运为主,有更高的BMI 水平,rs198358基因多态性与BMI 显著相关。中国汉族人群研究中,携带rs198358 G 等位基因的吸烟者发生中心性肥胖的风险更低,这与本研究结果一致[9]。原因可能为AA型患者中高平均转运类型占比更大,腹膜高转运更易发生超滤衰竭,引起容量超负荷导致BMI 升高,增加患心血管疾病和短期死亡风险[23-24]。提示如果携带rs198358 AA型患者有较高的高平均转运风险,腹透超滤效果可能欠佳,应及早制定针对性的透析处方。
据报道,NPPA 基因多态性与血压进展和高血压的发生有关[8,25]。笔者发现高血压组患者以AA型为主,rs198358 SNP 与舒张压密切相关,AA型有更高的舒张压。而HU 等[26]在上海周边地区开展的研究发现,rs198358 SNP 与舒张压及年龄存在交互作用,rs198358 G 等位基因的舒张压更高,可能会随年龄增长而改变。HU 等[26]的研究结果与本研究不一致,本研究表明G 等位基因的舒张压更低,可能为不同饮食习惯、RAAS 系统激活、动脉弹性等因素差异都可影响血压波动。
诚然,本研究存在一定局限性。第一,本研究纳入样本量较少,且非队列研究无法证明因果关系。第二,由于设备条件限制,本研究未利用生物电阻抗法以定量评估患者容量状况,另也缺乏中心静脉压等指标分析。第三,本研究仅选择NPPA基因单位点,未覆盖研究基因座其它位点。上述不足,有待下一步扩大样本量,纳入更多NPPA 基因位点进行队列研究以进一步阐明NPPA 基因变异对腹透容量状况的影响及评估作用。
综上,本文探讨了NPPA 基因多态性与腹透容量评估指标的相关性,为寻找有效评定CAPD 容量状况的指标提供科学依据。本研究表明,携带NPPA rs198358 AA型的CAPD 患者更容易有高血压及高平均转运的腹膜类型,NPPA rs198358 与舒张压、BMI及NT-proBNP 水平密切相关,NPPA 基因多态性对于CAPD 容量状况评估有一定预测价值。

