改性核桃壳固定化脂肪酶研究
韩本勇 周志梅 耿树香 马婷 宁德鲁 赵鹏 徐军伟 余旭亚 李涛


摘要:以核桃壳为原料,采用磷酸活化法制备炭化核桃壳,接着通过表面氧化和硅烷化对其进行改性处理使表面连接上疏水性有机官能团,并以此为载体来固定化脂肪酶,研究了不同固定化条件对酶活力的影响以及固定化酶的稳定性。结果表明,最佳工艺条件为酶质量浓度16 mg/mL,缓冲液pH值5.0,固定化时间3 h,固定化温度30 ℃。在此条件下最高酶活力可达166 U/g,稳定性试验表明,固定化脂肪酶具有较好的热稳定性,而且反复使用10次后,固定化脂肪酶仍可保留60%以上的初始酶活。
关键词:核桃壳;脂肪酶;固定化;载体;制备工艺;稳定性
中圖分类号: S188+.3
文献标志码: A
文章编号:1002-1302(2020)02-0282-05
收稿日期:2018-11-23
作者简介:韩本勇(1974—),男,云南昭通人,硕士,副教授,主要从事生物资源开发利用研究。E-mail:xmcx668@126.com。
通信作者:李 涛,硕士,高级实验师,主要从事生物资源开发利用研究。E-mail:1315385216@qq.com。
脂肪酶(lipase,EC 3.1.1.3)是一类广泛用于催化甘油三酯水解的酶类。除了具有水解的功能外,还可以参与醇解、酯化、酯交换、内酯合成、酯聚合及酰化反应等,是研究和应用最多的酶类之一[1-3]。但是游离脂肪酶存在诸多缺陷,例如受环境影响容易失活,催化过程不稳定,反应完成后与产品难分离或者分离成本高等缺陷,因而脂肪酶的进一步应用受到了限制,但是选择适当的载体材料以及固定化方法,制备固定化脂肪酶,则可以有效避免采用游离脂肪酶带来的问题[4-7]。
目前,已有多种材料被成功用于酶的固定化,来源广泛、价格低廉的载体材料对于固定化酶的工业化应用具有十分重要的影响。利用活性炭发达的孔系结构、较好的机械强度,将其用于制备固定化酶已有不少研究[7-8],结合脂肪酶结构特性,将活性炭进行疏水性改造,一方面利用活性炭较强的吸附能力,另一方面通过载体的疏水作用使脂肪酶的“盖”打开[9],并借助载体使这种活性构象被固定住,从而有望提升催化活力。云南省是核桃大省,核桃壳资源十分丰富,本研究通过制备改性核桃壳载体,以此固定化脂肪酶,并进行了相关工艺的优化,以期为核桃壳的开发利用以及固定化脂肪酶的应用提供相关理论依据。
1 材料与方法
1.1 材料
核桃壳,由临沧市云县汇智源公司提供;脂肪酶,云南师范大学生物能源持续开发利用教育部工程研究中心馈赠;甲基丙烯酰氧基丙基三甲氧基硅烷(KH-570)、橄榄油(西亚试剂);考马斯亮蓝G250、牛血清蛋白(Sigma);其他试剂均为分析纯市售品。
1.2 仪器
高速多功能粉碎机(上海力箭机械有限公司)、马弗炉(上海洪纪仪器设备有限公司)、台式恒温振荡器(太仓市实验设备厂)、pH计(瑞士梅特勒-托利多)、分光光度计(日本岛津)、物理吸附仪(美国麦克)、场发射扫描电子显微镜(日本日立)、红外光谱仪(德国布鲁克)、冷冻干燥机(美国SIM)。
1.3 方法
1.3.1 载体的制备 将核桃壳烘干、粉碎,加入一定量的磷酸溶液,在60 ℃水浴锅中浸渍一段时间,过滤后将其送入马弗炉,首先在300 ℃条件下炭化80 min,然后在600 ℃条件下活化80 min,活化结束后,取出用0.1%盐酸清洗并用蒸馏水洗涤至中性[10],最后烘干,保存备用。
1.3.2 载体的改性 载体的表面氧化:称取5 g载体,加入质量分数为20%的硝酸溶液,在80 ℃的水浴锅中浸渍3 h。过滤后将得到的滤饼置于烧杯中,加入蒸馏水煮沸、过滤,重复进行4次后烘干[11]。
载体的表面硅烷化:取1 g氧化后的载体置于100 mL无水乙醇中,超声分散1 h后形成均匀分散液;再加入一定量的0.01 mol/L HCl,调节溶液pH值至4.0,然后加入3%的KH-570溶液,在60 ℃的条件下反应24 h,过滤,滤饼分别用无水乙醇和蒸馏水洗涤以除去未反应的KH-570,烘干后即得固定化酶载体[12]。
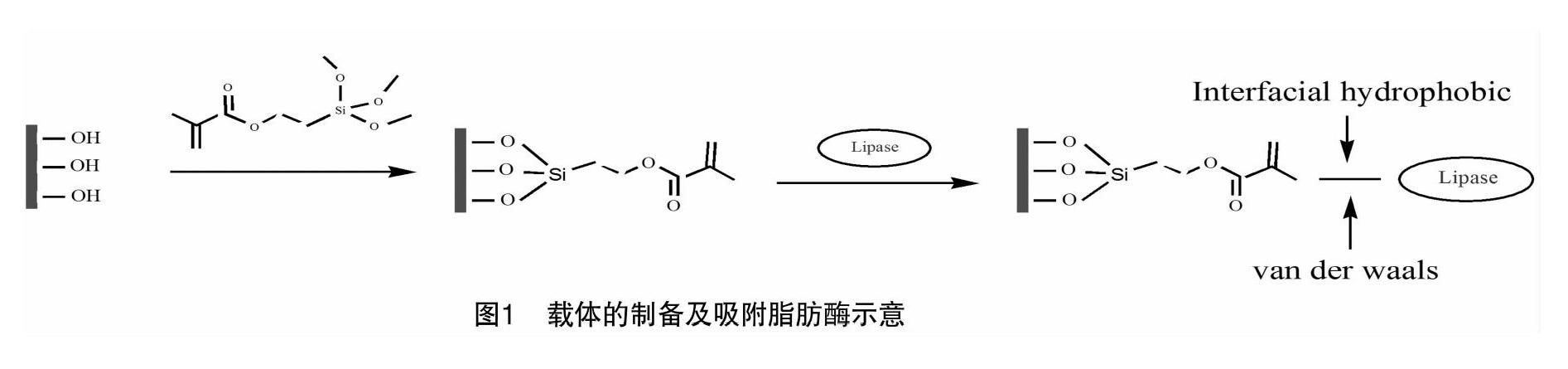
1.3.3 固定化酶的制备 称取1.0 g经改性处理的载体于三角瓶中,加入5 mL含有一定量脂肪酶的缓冲液,在摇床上振荡一定时间使载体吸附固定脂肪酶。固定完成后,移取一定量的溶液,离心取上清液,测定酶的吸附率。抽滤,用去离子水洗涤干净,然后冷冻干燥,得到固定化脂肪酶,4 ℃冰箱中保存备用。载体制备及固定化原理如图1所示。
1.3.4 固定化酶的稳定性 热稳定性:将固定化酶和游离酶70 ℃水浴分别保温0、1、2、3、4、5、6 h后取出,冷却至室温,再测定酶活。将保温0 h时的酶活设定为100%。
重复使用性:取0.5 g固定化脂肪酶测定酶活力,测定完成后,取出,抽滤,洗涤,分离所得固定化酶,干燥后进行下一次反应。将初始酶活设定为100%。
1.3.5 脂肪酶含量及活力的测定 脂肪酶含量的测定以牛血清白蛋白(BSA)为标准蛋白,采用考马斯亮蓝法测定蛋白含量[13]。游离酶和固定化酶水解活力的测定均采用橄榄油水解法测定[14],以在pH值为7的缓冲液、温度为40 ℃的条件下,1 min水解产生1 μmol脂肪酸所需的酶量定义为1个活力单位(U)。
2 结果和讨论
2.1 载体结构的表征
2.1.1 傅立叶变换红外吸收光谱仪(FT-IR)表征 载体改性前后的FT-IR谱如图2所示。可以看出,样品在3 200~3 500 cm-1处的强吸收峰是由醇、酚和有机酸的羟基(—OH)的伸缩振动引起的,1 620 cm-1附近处的吸收峰对应于CC或CO伸缩振动,1 400 cm-1为活性炭表面上C—OH键变形振动峰,1 125 cm-1对应于仲醇中O—H或醇、酚中C—O或C—O—C的反对称振动。相比未改性载体,改性后载体在3 500 cm-1处的吸收峰比未改性的弱,说明一部分羟基与硅烷化试剂发生了反应从而消耗了部分羟基[15],同时改性载体在 1 074 cm-1 处出现Si—O基团的伸缩振动峰,进一步说明硅烷化试剂已成功修饰到载体上[12]。
2.1.2 SEM结果 载体改性前后的SEM如图3所示。可以发现,未改性载体以及改性载体的表面均非常粗糙,其上分布着大小不等的孔,并向里延伸。
经过表面氧化以及硅烷化处理后,载体的孔结构整体并未发生十分显著的改变。
2.1.3 N2吸附-脱附分析结果 表1为改性前后载体的比表面积(BET)、孔体积和孔径分布的情况。由表1可知,由核桃壳炭化制备的载体比表面积为803 m2/g,这可能是在制备过程中,未隔绝空气处理,导致核桃壳部分氧化,开孔不够充分,导致比表面积不够高[16-17],以及经濃硝酸煮沸处理时,浓硝酸氧化导致活性炭的结构塌陷,比表面积降低。经改性处理后,载体的比表面积、孔体积均有所降低而孔径基本不变。这是由于硅烷化使活性炭表面某些含氧基团变为含氧硅烷基基团,这些大的基团以及有机硅化物的缩合产物在活性炭孔道表面对其进行堵塞和填充,从而使比表面积和孔容减小,由于比表面积和比孔容同步减小,故平均孔径没有太大的变化,从比表面积、孔体积和孔径分布的情况也进一步说明疏水性的硅烷基团已成功修饰到载体上。
2.2 固定化条件的优化
2.2.1 酶液浓度对脂肪酶固定化的影响 从图4可以看出,随着酶液质量浓度的增大,固定化脂肪酶的活力和蛋白吸附量也随之增加,但当酶液的质量浓度达到16 mg/mL后,继续增加酶液质量浓度,固定化酶的活性和蛋白吸附量都不再上升且酶活略有下降。由于所用载体的孔径小于脂肪酶分子的直径[18],因而脂肪酶不能进入孔内而只能吸附于外表面,在本试验中,当载酶量达到1.8 mg/g时,根据王海雄等的试验结果[19]来估算,本试验范围内的吸附为多分子层吸附,这就增加了底物和产物的传质阻力,同时由于所用的脂肪酶为粗品,存在其他非酶成分,而使部分脂肪酶被包埋于内部而不能与底物接触,这些都使固定化酶的活力降低。高吸附量会由于酶分子紧密接触而导致构象变化以及增加空间传质阻力[20]。因此,在固定化酶的制备过程中,以酶溶液质量浓度为16 mg/mL最佳。
2.2.2 缓冲液pH值对脂肪酶固定化的影响 由图5可知,固定化脂肪酶的活力和蛋白吸附量随着pH值的升高先升高而后降低。在pH值为5.0时,固定化脂肪酶活力达到最大,而游离酶的最适pH值为7,经过固定化的脂肪酶的最适pH值下降,这可能是由于载体经过改性处理后与脂肪酶的结合改变了其结构,从而使其能适应更低的pH值。Kandasamya等也发现,将脂肪酶固定在稻壳活性炭上后,在pH值为3.5的酸性环境下,脂肪酶活力更高[21]。因此,在固定化酶的制备过程中,以缓冲液pH值为5.0最佳。
2.2.3 固定化时间对脂肪酶固定化的影响 由图6可知,随着吸附时间的增加,固定化脂肪酶的活力和蛋白吸附量都不断增大。当吸附3 h时,固定化脂肪酶的活力和蛋白吸附量达到最大值,随后随着吸附时间的增加,固定化脂肪酶的活力和蛋白固定量不再增加,固定化酶活性甚至有所下降,这可能是由于脂肪酶和载体结合需要一段时间,而时间过长,已经固定上的酶有可能脱落下来或者由于脂肪酶分子相互聚集导致脂肪酶的活性中心互相遮盖而影响酶活。因此,以改性核桃壳为载体的固定化脂肪酶最佳固定时间为3 h。
2.2.4 固定化温度对脂肪酶固定化的影响 由图7可知,在20~40 ℃范围内,蛋白吸附量随温度的升高而增大,固定化脂肪酶的活力先升高后降低。当温度为30 ℃时,固定化酶活力达到最大,之后固定化酶的活力迅速下降,这可能是脂肪酶的活性部位因温度的升高而遭到破坏,导致酶失去部分活性。因此,以改性核桃壳为载体的固定化脂肪酶最佳固定温度为30 ℃。
2.3 固定化酶的稳定性
2.3.1 固定化酶的热稳定性 将固定化脂肪酶和游离酶缓冲溶液浸入60 ℃的水浴锅中,每隔1 h取样测其活力。由图8可以看出,随着保温时间的延长,游离酶的相对活力迅速降低,下降速度远大于固定化酶,6 h后,相对活力趋近于零,几乎完全失活。固定化酶在水浴时间小于2 h时,活力几乎没有下降,保温6 h后,相对活力仍然保持在50%以上。可见脂肪酶经固定化以后,热稳定性有了明显提高,这主要是由于固定化过程增强了酶与载体之间的氢键、疏水相互作用及静电相互作用,稳定了酶分子构象,从而减少了其热致构象变化的可能性,提高了酶分子的抗热失活能力。
2.3.2 固定化酶的重复使用性 固定化脂肪酶的重复使用性对于它的应用是非常重要的,将固定化酶重复用于橄榄油乳化液的水解反应,测定其酶活力。由图9可以看出,通过催化水解橄榄油来测定固定化酶的活力,在重复使用10次后,其相对酶活仍为原来的60%以上,表明固定化酶具有良好的重复使用性。
3 结论
以核桃壳为原料,通过改性处理制得疏水性载体,将其用于固定化脂肪酶,最适条件为酶质量浓度 16 mg/mL,缓冲液pH值5.0,固定化时间3 h,固定化温度30 ℃。在此条件下,固定化脂肪酶活力最大,酶活力达166 U/g。稳定性试验表明,固定化脂肪酶具有较好的热稳定性,并且反复使用10次后,固定化脂肪酶的酶活力仍可达60%以上。表明制得的改性核桃壳是固定化脂肪酶的良好载体。
参考文献:
[1]Grochulski P,Li Y,Schrag J D,et al. Insights into interfacial activation from an open structure of Candida rugosa lipase[J]. Journal of Biological Chemistry,1993,268(17):12843-12847.
[2]Salihu A,Alam M Z. Solvent tolerant lipases:a review[J]. Process Biochemistry,2015,50(1):86-96.
[3]Schaechter M. Encyclopedia of microbiology[M]. 3rd ed. Oxford:Academic Press,2009:385-392.
[4]Mojovic L,Knezevic Z,Popadic R,et al. Immobilization of lipase from Candida rugosa on a polymer support[J]. Applied Microbiology and Biotechnology,1998,50(6):676-681.
[5]Kuo C H,Liu Y C,Chang C,et al. Optimum conditions for lipase immobilization on chitosan-coated Fe3O4 nanoparticles[J]. Carbohydrate Polymers,2012,87(4):2538-2545.
[6]茅羽佳,欧先金,杜 伟,等. 大肠杆菌高水平表达脂肪酶BTL2及其催化油脂制备生物柴油[J]. 化工学报,2012,63(7):2100-2105.
[7]安思源,朱晶莹,卢滇楠,等. 酶催化合成高分子量聚丁二酸丁二醇酯(PBS)及其材料特性[J]. 化工学报,2013,64(5):1855-1861.
[8]Osborn J A,Ianniello R M,Wieck H J,et al. Use of chemically modified activated carbon as a support for immobilized enzymes[J]. Biotechnology and Bioengineering,1982,24(7):1653-1669.
[9]Zaidan U H,Rahman M B,Basri M,et al. Silylation of mica for lipase immobilization as biocatalysts in esterification[J]. Applied Clay Science,2010,47(3/4):276-282.
[10]董 瑞,肖凯军,任 源. H3PO4法制备核桃壳活性炭及其处理啤酒废水的研究[J]. 现代食品科技,2011,27(8):960-964,1024.
[11]汪 沙. 椰壳活性炭共价固载脲酶及尿素废水处理的研究[D]. 海南海口:海南大学,2012.
[12]时镜镜,马文石,林晓丹. KH-570功能化石墨烯的制备与表征[J]. 无机化学学报,2012,28(1):131-136.
[13]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[14]Huang J,Liu Y,Wang X. Influence of differently modified palygorskites in the immobilization of a lipase[J]. Journal of Molecular Catalysis B - Enzymatic,2008,55(1/2):49-54.
[15]赵雪霞,郭兴梅,李 莎,等. KH-570改性碳微球[J]. 中国材料进展,2012,31(10):43-46.
[16]杨 娟,丘克强. 核桃壳真空化学活化制备活性炭[J]. 中南大学学报(自然科学版),2012,43(4):1233-1238.
[17]Nowicki P,Pietrzak R,Wachowska H. Sorption properties of active carbons obtained from walnut shells by chemical and physical activation[J]. Catalysis Today,2010,150(1/2):107-114.
[18]Gao S,Wang Y,Diao X,et al. Effect of pore diameter and cross-linking method on the immobilization efficiency of Candida rugosa lipase in SBA-15[J]. Bioresource Technology,2010,101(11):3830-3837.
[19]王海雄,吳 侯,翁新楚. 活性炭吸附法固定猪胰脂酶的初步研究[J]. 上海大学学报(自然科学版),2003,9(5):428-432.
[20]Ison A P,Macrae A R,Smith C G,et al. Mass transfer effects in solvent-free fat interesterification reactions:Influences on catalyst design[J]. Biotechnology and Bioengineering,1994,43(2):122-130.
[21]Kandasamy R,Kennedy L J,Vidya C A,et al. Immobilization of acidic lipase derived from Pseudomonas gessardii onto mesoporous activated carbon for the hydrolysis of olive oil[J]. Journal of Molecular Catalysis B-Enzymatic,2010,62(1):59-66.赵永峰,郑 慧. 内蒙古城市化-社会经济-生态环境时空耦合关系[J]. 江苏农业科学,2020,48(2):287-293.

