一株猪高致病性蓝耳病病毒的分离鉴定与遗传变异分析
张维达,杨康,李自力
(农业微生物学国家重点实验室,华中农业大学动物医学院,湖北省预防兽医学重点实验室,武汉 430070)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起猪的一种繁殖障碍和呼吸系统的高度接触性传染病。病猪和带毒猪是PRRS的主要传染源[1]。PRRSV主要侵害90日龄左右的妊娠母猪和21日龄以下哺乳仔猪,且仔猪和育肥猪是主要的贮存宿主[2]。PRRSV能通过接触[3]、空气[4]、精液[5]和垂直传播进行病毒扩散。初次感染PRRSV后病毒在猪体内存在时间与其个体差异有关。1996-2006年间,PRRS在我国呈散发,很少出现暴发流行。2006年以后在江西、河南、湖南等省发生了高致病性蓝耳病(Highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS),给我国养猪业带来了严重的经济损失,所以对PRRSV的流行病学调查具有重要意义。根据病毒的抗原性,分离地和基因组差异,PRRSV被分为欧洲型(PRRSV 1型)和北美洲型(PRRSV 2型)两个经典的血清型,代表毒株分别为Lelystad(LV)和VR-2332[6-7]。而Nsp2作为监测PRRSV进化和分子流行病学研究的关键蛋白,它是病毒的多功能蛋白,在病毒基因组中具有最高的遗传多样性。本研究通过对新疆某规模化猪场疑似 PRRS发病猪血液中分离获得 1 株 PRRSV 毒株,经Nsp2基因以及全基因组测序鉴定和分析发现该分离毒株属于高致病性PRRSV亚群,其全基因组核苷酸序列与GD、TJ、HuN4、JXA1等高致病性毒株属于同一分支,其同源性在98.4%~99.4%之间,由此确定该分离株为HP-PRRSV。本研究探讨了新疆地区PRRSV分离株的遗传进化规律,对PRRSV 在偏远地区的监测、防控以及对未来猪场PRRS净化具有重要的指导意义。
1 材料与方法
1.1 细胞、病料和载体 非洲绿猴肾细胞(Marc-145)由华中农业大学动物医学院吴斌教授课题组馈赠;临床血样于2018年10月采集于新疆某猪场出现呼吸困难、体温升高的45日保育猪群,经抗凝血处理后保存在-80 ℃;PMD-18T克隆载体(批号6011)购自TaKaRa公司。
1.2 主要试剂 DMEM培养基(批号AE29422248)购自Hyclone公司,胎牛血清(批号10270-106)购自Gbico公司;高致病性猪蓝耳病活疫苗JXA1-R弱毒疫苗购自武汉科前生物股份有限公司(批号20180711),由华中农业大学动物医学院兽医微生物学与免疫学实验室保存;RT-PCR两步法试剂盒(R223-01)购自南京诺唯赞生物科技有限公司;琼脂糖(TSJ001)和DL2000 DNA Marker(TSJ011-100)购自北京擎科生物科技有限公司;凝胶回收试剂盒(批号CW2302M)购自康为世纪有限公司;FITC标记羊抗鼠IgG购自武汉爱博泰克生物科技有限公司。
1.3 引物设计与合成 使用Nsp2鉴定引物[8]对野毒株进行鉴定。根据GenBank公布的PRRSV GD(EU825724.1)全基因组序列以及PRRSV基因结构(图1)开放阅读框顺序设计了12 对扩增 PRRSV 的重叠基因片段引物[9-10](表1),引物A~H用于扩增ORF1a部分,引物H~K用于扩增ORF1b部分,引物L用于扩增ORF2~4部分,引物M用于扩增ORF5~7部分,引物序列由北京擎科生物科技有限公司合成。

图1 PRRSV基因组结构模式图

表1 PRRSV全基因组扩增引物
1.4 病料处理和RNA的提取 将2.5 mL血样病料经过0.22 μm滤膜进行过滤,该试验操作均在冰盒上完成。取过滤后的血样加入 750 μL Trizol 和 200 μL 氯仿,振荡混匀,室温静置,离心 15 min;取 500 μL上清加入等量的异丙醇,颠倒数次,离心 15 min收集沉淀; 75%酒精洗涤沉淀后,离心 10 min,弃上清,超净台室温静置20 min,收集沉淀;20 μL DEPC水溶解沉淀即为样品 RNA,-80 ℃保存备用。
1.5 病毒的分离 将按照步骤1.4处理且RT-PCR检测呈阳性的血样分别接种于长满单层 Marc-145细胞的6孔细胞培养板内。细胞培养板置于37 ℃ 5% CO2培养箱内吸附 1 h后弃接种物,并用 1 mL PBS洗1次后每孔补加2 mL含2% FBS的DMEM 培养基继续培养3~5 d。接种后每天观察细胞状态,将出现细胞病变孔冻融后置于-80 ℃备用。
1.6 间接免疫荧光实验 用盲传三代后出现细胞病变的培养物接种Marc-145细胞,培养48 h后,用 4%的甲醛固定 30 min。甲醇室温穿透10 min,再用2%的BSA 37 ℃温箱封闭1 h。使用1∶200稀释抗 PRRSV GP5蛋白单克隆抗体于37 ℃温箱孵育1 h,再用1∶500稀释的 FITC-羊抗鼠 IgG于37 ℃温箱孵育45 min,用荧光显微镜观察实验结果,同时设正常细胞作为对照。
1.7 RT-PCR扩增与核苷酸测序 通过噬斑实验将病毒纯化后,按照1.4项步骤提取病毒RNA,按照说明书进行RT-PCR扩增。扩增产物用1%琼脂糖凝胶电泳检测,利用胶回收试剂盒纯化回收PCR产物,连接到 pMD-18T载体,转化至大肠杆菌DH5α感受态细胞,挑取单克隆菌落并鉴定。阳性质粒交给北京擎科生物科技有限公司进行测序。
1.8 同源性以及遗传进化分析 采用SeqMan根据测序结果进行序列拼接,采用MegAlign和MEGA等生物信息学软件对分离PRRSV全基因组与GenBank公布的国内外毒株的全基因组序列进行核苷酸同源性及遗传进化分析,使用DNAMAN软件进行序列比对分析。
2 结果与分析
2.1 病毒的分离与鉴定
2.1.1 临床病料的检测 使用PRRSV Nsp2特异性引物对临床血样进行RT-PCR检测,将3号血样扩增产物送至北京擎科生物科技有限公司测序,片段大小为960 bp。根据表1中Nsp2基因引物扩增片段大小,判定为高致病性PRRSV阳性(图2)。

M: DL2000 Marker ;1-3:临床血样;4:阴性对照;5:JXA1-R感染的Marc-145细胞M: DL2000 Marker ;1-3: blood clinical samples;4:negative control;5:Marc-145 cells infected by JXA1-R
2.1.2 病毒在Marc-145细胞上的增殖结果 将检测呈阳性的血样经0.22 μm滤膜过滤后接种Marc-145细胞进行增殖培养。感染72 h后,相对于空白对照,接种病料的Marc-145细胞出现明显的细胞病变(CPE),表现为细胞聚集成簇、变圆和脱落(图3)。
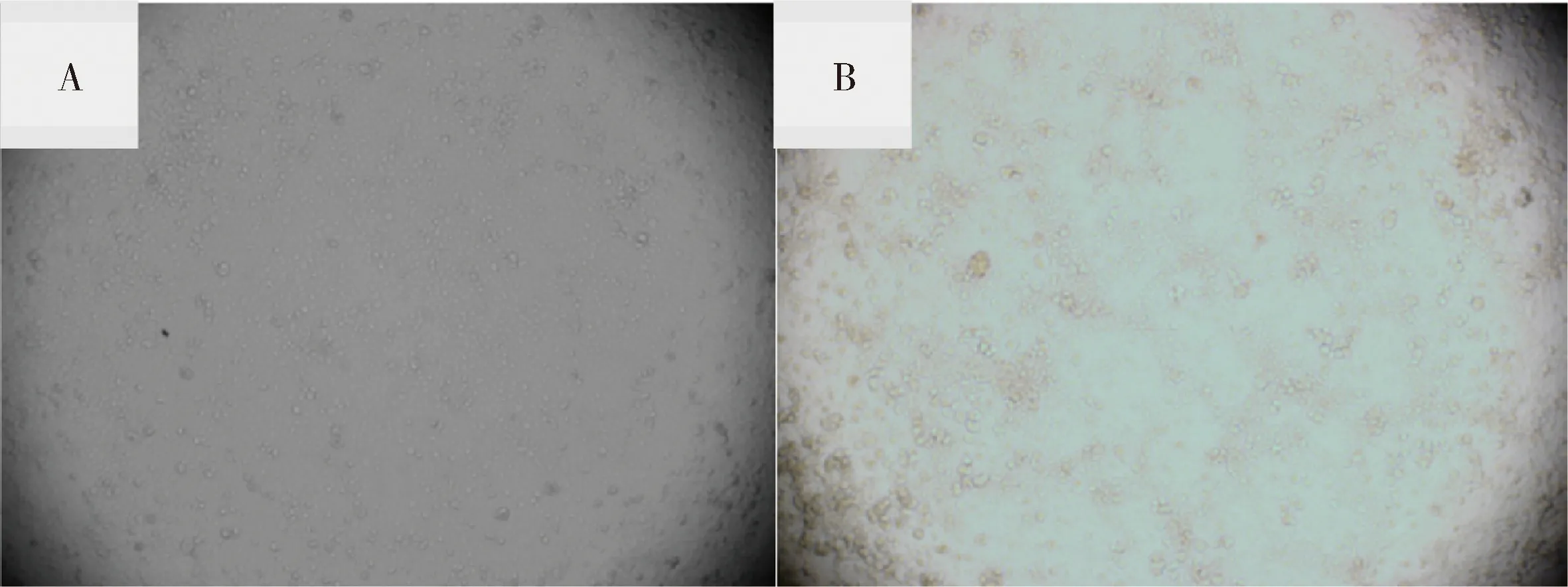
A:正常Marc-145 细胞;B: 接种培养物的Marc-145细胞A:Normal Marc-145 cells ;B: Marc-145 cells infected with culture
2.1.3 间接免疫荧光鉴定 使用鼠抗PRRSV GP5蛋白的单克隆抗体和FITC标记羊抗鼠IgG对感染细胞进行间接免疫荧光鉴定,从图4中能明显看到Marc-145细胞接种盲传三代的细胞培养物后呈绿色,为阳性反应,说明该分离病毒为PRRSV。
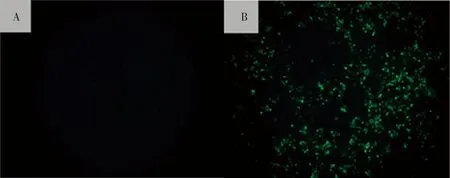
A:正常Marc-145细胞;B:接种PRRSV的Marc-145细胞A: Normal Marc-145 cells;B: Marc-145 cells infected with PRRSV isolate
2.2 病毒的全基因组扩增,同源性及遗传变异分析
2.2.1 病毒的全基因组扩增 将病毒全长约为15.2 kb的全基因组按照参考序列分为13个片段,使用表1中的引物通过RT-PCR进行扩增,扩增结果如图5所示。
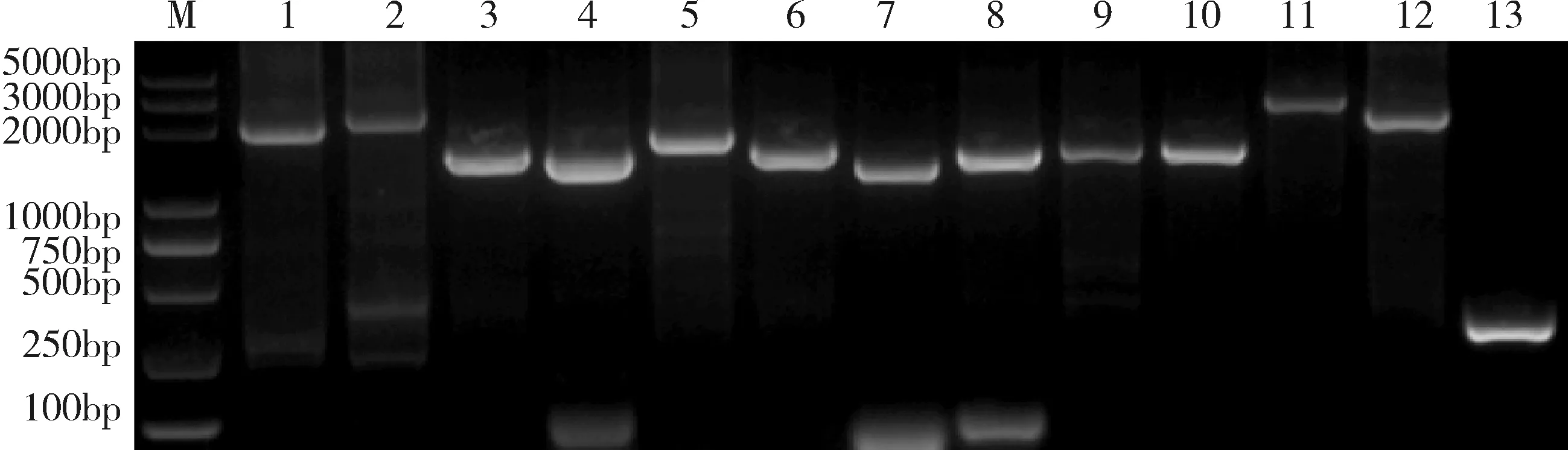
M:DL5000 Marker;1-13: PRRSV 全基因组片段: M、L、K、J、I、H、G、F、E、D、C、B、AM:DL5000 Marker; 1-13: the fragments of PRRSV complete genome: M, L, K, J, I, H, G, F, E, D, C, B, A
2.2.2 病毒全基因组的同源性比较及遗传变异分析将拼接完成的全基因组序列与表2中NCBI已经公布的PRRSV毒株进行同源性比对以及遗传进化分析。由遗传进化树(图6A)和同源性比较(图6B)可以看出,XJ-b分离株属于PRRSV 2型毒株,与国外分离的美洲株(VR2332)和欧洲株(M96262)位于不同分支,与两者同源性分别为89.0%和59.9%。XJ-b株与中国的经典毒株GM2和NADC30-Like毒株JL580的同源性较低,分别为87.5%和84.3%;与中国的高致病性毒株JXA1、TJ、GD、HuN4等同源性较高,其中与2006年中国暴发的JXA1毒株同源性为98.9%,与GD株同源性高达99.4%。综上所述,从全基因组进化分析和同源性比对结果来看,XJ-b属于中国的高致病性PRRSV。

表2 PRRSV参考毒株
2.2.3 病毒的Nsp2基因同源性、遗传进化以及序列比对分析 根据XJ-b全基因组的分析结果,将XJ-b的Nsp2基因进行遗传进化分析(图7A)和同源性比较(图7B),XJ-b与GD株的同源性最高(99.4%);并且与JXA1、GD株等中国高致病性毒株属于同一分支,Nsp2基因与全基因组的遗传进化分析结果一致。
Nsp2基因核苷酸序列比对分析(图8A)显示,XJ-b在Nsp2基因组高变区碱基缺失的位置和数量与JXA1、GD、Xju-1等高致病性蓝耳病病毒株一致,说明XJ-b为高致病性蓝耳病病毒株,这与全基因组的分析结果一致。此外XJ-b与其他毒株最主要的区别在于Nsp2基因在基因组5090~5170 bp位置(图8B红框处)上有一段63 bp的连续碱基缺失;在6470~6479 bp位置(图8C红框处)之间有5处连续碱基缺失和4个碱基突变,分别为:6270(G)→ 6274(T),6471(T)→ 6471(A),6472(A) → 6472(G)和6474(T)→ 6474(C)。
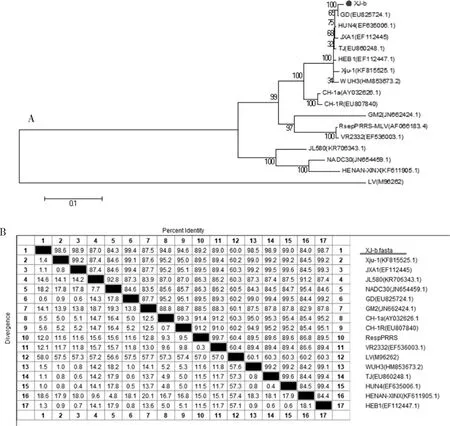
图6 XJ-b株全基因组核苷酸序列遗传进化树(A)与同源性比较结果(%)(B)
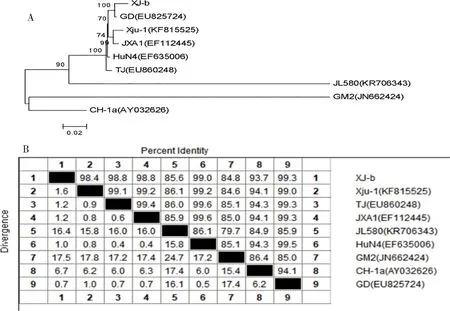
图7 XJ-b株Nsp2基因组核苷酸序列遗传进化树图(A)与同源性比较结果(%)(B)
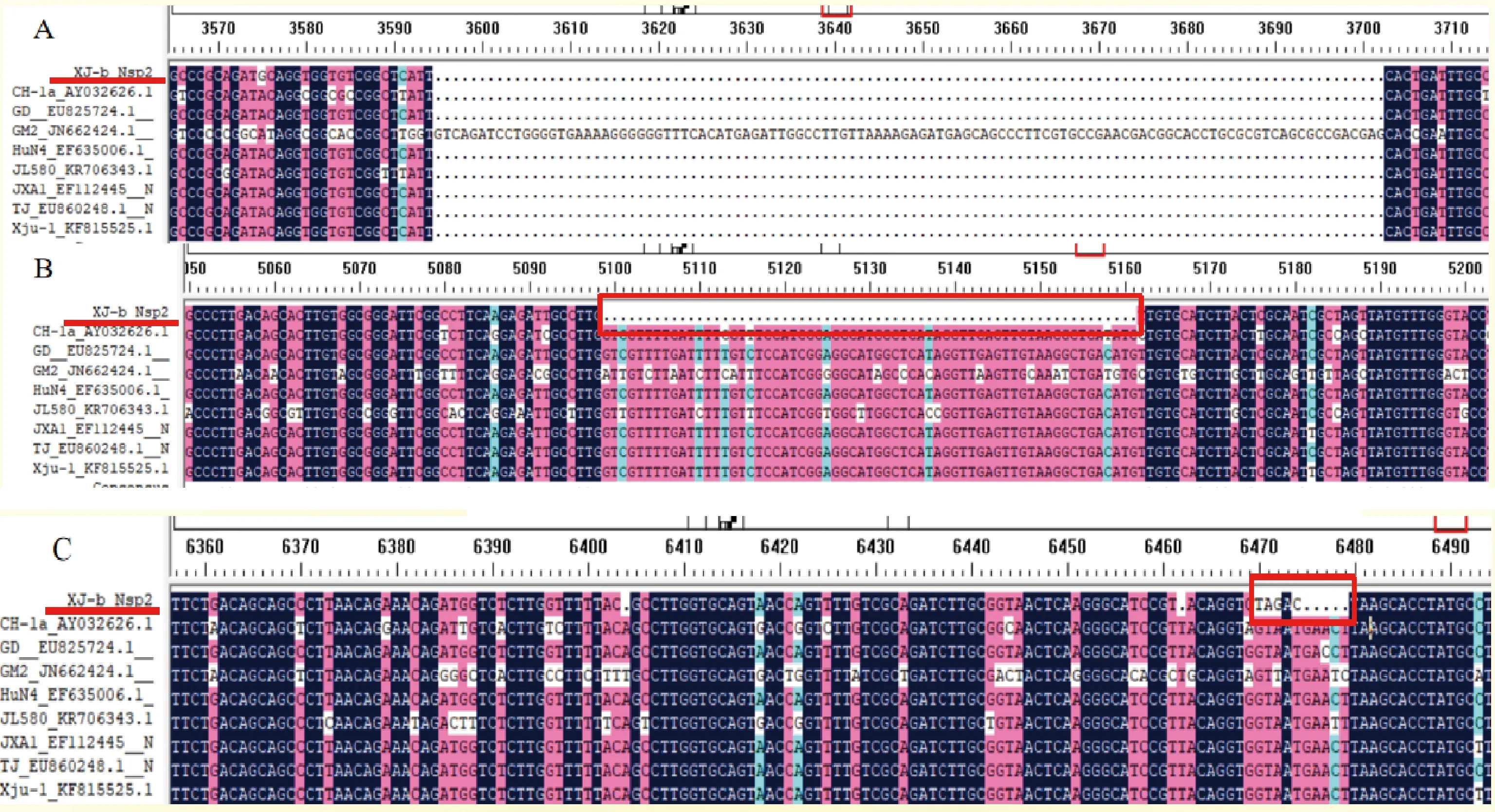
A, B, C:XJ-b Nsp2基因变异缺失位点A, B, C:The variation and deletion sites of XJ-b Nsp2 gene
3 讨论与结论
PRRS是猪的一种急性病毒性传染病[11]。我国于1996年首次分离到PRRSV CH-1a株,该病开始在全国蔓延。2006-2007年在我国江西、河南、湖南等省发生了猪高致病性蓝耳病。2014年后出现了较多的NADC30-like毒株,并逐渐成为目前主要的PRRSV流行毒株[12]。但是HP-PRRSV仍然作为PRRS重要的流行毒株之一,经常与猪瘟病毒、猪圆环病毒2型等混合感染[13-14],我国养猪产业对其防控形势依然严峻。为了研究新疆地区PRRSV的遗传变异情况,本次研究采取实验室诊断方法,从临床病料中成功分离得到一株PRRSV,将其命名为XJ-b。为进一步确定该病原及其属性,经全基因组遗传进化以及同源性分析,XJ-b与JXA1高致病性毒株属于同一亚群,且与2016年分离的高致病性毒株GD株亲缘关系最高。
不同数量碱基插入、缺失和突变具有多态性,是造成PRRSV毒株多样性和持续变异的重要原因[15]。为进一步探究XJ-b的遗传进化规律,本研究对2006年暴发的高致病性毒株JXA1和2015年在新疆分离的Xju-1株作了序列比对。XJ-b相对于JXA1 与Xju-1的Nsp2基因,其最主要的区别是有一段连续63 bp的碱基缺失,其次在近N端有6处碱基缺失和3个碱基突变。这些缺失和突变可能与病毒的复制和毒力有关,需要进一步研究。尽管均是从新疆地区分离,Xju-1与JXA1的Nsp2基因的亲缘关系较近,有99.2%的同源性,而XJ-b与JXA1的同源性为98.8%。除此之外,2015年分离的Xju-1在Nsp2基因中有450 bp的连续缺失[16],而XJ-b的Nsp2基因的缺失位置以及缺失数量都不一样,所以XJ-b并不是由Xju-1进化而来。另外,从已有的新疆PRRSV流行病学报道来看[17-18],新疆地区流行的PRRSV毒株仍然以高致病性蓝耳病病毒株为主。从地域相关性上来看,XJ-b与Xju-1全基因组的同源性只有98.5%,但是与在广东分离的GD毒株,天津分离的TJ株,武汉分离的WUH3株分别有99.4%、98.9%和98.5%的同源性,说明新疆地区不同PRRSV毒株之间差异性较大,而这种差异一方面可能是XJ-b与内陆地区流行的PRRSV高致病性毒株重组所造成的,另一方面也可能是由新疆本地的PRRSV毒株进化变异而来,具体情况有待于实验室对更多新疆地区的PRRSV分离毒株进行进一步的流行病学调查。实验室分子生物学检测是鉴别不同类型猪蓝耳病病毒毒株的最准确方法之一,本研究在一定程度上反映出PRRSV在我国新疆地区的遗传进化规律,相对于中国内陆来说,PRRSV在新疆地区流行的毒株类型相对单一。实验室鉴别诊断和流行病学调查对我国养猪业PRRS的防控与净化具有重要的指导意义。

