氯沙坦对急性肺损伤小鼠肺部组织及肺树突状细胞结构功能的作用
苏华振,魏明
急性肺损伤(ALI)是一类较多见的危急重病,可能进展成为更加危急的急性呼吸窘迫综合征(ARDS)。病因众多,其死亡率能够达到40%[1-2]。当前研究认为其发病的主要因素为不可控制的炎性反应[3]。肾素-血管紧张素系统(RAS)的激活在ALI的发生发展中发挥重要的作用。RAS的主要效应因子血管紧张素Ⅱ(AngⅡ)有显著的促进炎症发生的作用,它是介导ALI肺部炎性反应过程的关键因子[4-5]。作为血管紧张素Ⅱ的1型受体阻断剂,氯沙坦能够显著降低肺部炎症损伤水平[6]。树突状细胞(DC)能够调节肺部免疫反应,并在其中发挥关键性作用。有研究表明,肺部组织感染以及由博来霉素诱发的肺部损伤过程都有肺DC的干预[7-8]。肺部结构RAS能够调节肺DC的作用水平,AngⅡ可促进DC分化成熟[9]。但是氯沙坦能否依赖于抑制AngⅡ诱发的肺DC的激活从而缓解肺部组织炎性反应这仍有待于深究。此实验应用脂多糖(LPS)来构建ALI小鼠的模型,研究在ALI中氯沙坦对肺DC的数目和功能的作用,从而深入探究氯沙坦对ALI产生的保护性机制。本研究符合动物伦理学要求。
1 材料与方法
1.1 实验动物 2016年10月至2018年12月于郑州大学实验动物中心购买72只C57BL/6小鼠,雄性,6~8周,体质量为18~22 g。许可证号:ZYXK(豫)2016-0289。在无特定病原体(SPF级)条件下常规喂养,标准化颗粒饲料、饮用水、垫料及其他相关物品都经灭菌处理。本研究符合动物伦理学要求。
1.2 试剂和器材 脂多糖(E.coli 0111:B4)购自Sigma公司,胶原酶V购自Sigma-Aldrich公司。小鼠CD11c、CD11b,组织相容性复合物(MHC Ⅱ),CD80及同型对照单克隆抗体都购自eBioscience公司。Losartan由Cayman公司提供。小鼠IL-6 ELISA kit购自上海依科赛生物有限公司。流式细胞仪购自美国BD公司(BDFACSCaliburTM)。
1.3 模型制备与分组 将72只SD小鼠按随机数字表法分为健康对照组、ALI模型组和氯沙坦干预组,各24只。健康对照组:向小鼠腹腔中注射50μL的PBS,30 min后向气管中滴加30 μL的PBS;ALI模型组[10-11]:向小鼠腹腔中注射50 μL的PBS,30 min之后向气管中滴加2 mg/kg的脂多糖(溶于30μL PBS中)。成功构建脂多糖(LPS)-ALI模型的标准:肺部组织间质内充血、肿大,肺泡之间的间隙显著增宽,肺部组织间质以及肺泡腔中有弥漫性炎症细胞的包裹、出血,大部分肺泡结构萎缩[11]。氯沙坦干预组:向小鼠腹腔中注射15 mg/kg的氯沙坦(溶于50 μL PBS中),30 min之后构建脂多糖(LPS)-ALI模型。注射脂多糖或者PBS之后的6、12、24 h左右处死标本,留取待检的肺组织。
1.4 标本的采集以及病理研究 于6、12、24 h采用右心室取血的方法处死小鼠(n=6只小鼠/组/时间点)。将右肺部分组织(约0.5 cm×0.5 cm,1~2 g)进行甲醛固定、石蜡片包埋、再经切片、HE染色,由病理科一名医师专门负责观测其病理改变,并将组织小块按照方法[12]对其进行损伤分级评分。规则如下:①肺泡的充血;②出血;③肺泡腔中或者血管壁上有中性粒细胞的包裹;④肺泡壁加厚和(或)有透明质膜的产生四项指标,分别按照病变的严重程度对其评0~4分(0分:没有病理改变或极度轻微病变,1分:轻微病理改变,2分:中等程度病理改变,3分:严重病理改变,4分:极度重症病理改变)。各部分的评分数之和即为急性肺损伤的总分数。
1.5 肺单细胞悬液制备 在灭菌的情况下拿出肺部组织30 mg,将其放于含有Hank′s平衡溶液的培养皿之中,把取到的肺部组织用眼科剪裁成1 mm×1 mm×1 mm大小的小块,把装有肺部组织小块的培养皿放于培养箱中,勇胶原酶V溶液对其进行消化1 h(37℃,每隔3 min轻轻振摇数次),冰浴终止消化,缓缓吸打分离细胞,用200目的不锈钢网格过筛,在EP管中集中收取消化液。再经1 000 r/min的速度离心10 min,去上清,于下层沉淀中注入2 mL的PBS缓缓吸打,相同的速度离心5 min,弃上清,于沉淀里加5 mL的红细胞裂解液,缓缓吸打使细胞分散开来,冰块上静置10 min,相同的速度离心10 min,弃上清,加3 mL的PBS混合版均匀,离心5 min,速度同上。弃上清。用台盼蓝染液对细胞进行染色,细胞计数板涂片,光学显微镜下观测活体细胞数目,之后将细胞的浓度调整到1×106/mL,冰冻保存备用。
1.6 肺湿重/体质量(LW/BW)检测 取肺组织,把肺部组织表层多余的水分用吸水纸吸尽同时清理好血渍之后,称量并算出肺组织LW/BW水平。
1.7 ELISA测定肺部组织IL-6水平 挑选右肺下部组织约10 mg,加入2 mL生理盐水,用电动匀浆机制备肺组织匀浆,4℃,3 000 r/min离心10 min,留上清液,-80℃保存。按照试剂盒的说明书进行严格规范操作,450 nm处测吸光值,计算IL-6水平。
1.8 流式细胞仪测定肺部DC数目以及CD80、主要组织相容性复合物(MHC)Ⅱ的表达 在管中滴加0.5μg的抗CD16/CD32单克隆抗体避光反应10 min,在相对应的管中分别滴加0.25μg的抗CD11c-FITC单抗、0.125μg的CD11b-PE单抗、0.03μg的抗MHCⅡ-APC单抗以及0.06μg的抗CD80-APC单抗。并将FITC荧光标记的抗亚美尼亚仓鼠IgG、PE荧光标记的抗大鼠IgG2b、APC荧光标记的抗大鼠IgG2b设为同型的阴性对照管(抗体在使用之前应该缓慢摇匀),混合均匀,25℃避光反应20 min。1 200 r/min的速度离心5 min,弃去上层清液,向沉淀中滴加1 mL的含有1%BSA PBS混合均匀,同样的速度离心5 min,弃去上层清液,滴加1%的多聚甲醛300μL,放于4℃避光存放,24 h之内上机检测。检测之前应该缓慢吸打,使细胞混合均匀,本研究重复3次。
1.9 统计学方法 计量资料以±s表示,采用SPSS 16.0统计软件进行处理,行秩和检验、重复测量方差分析及LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 氯沙坦对小鼠肺部结构病理学变化产生的效果 6 h各组肺部结构切片进行HE染色,在光学显微镜下观察。健康对照组中小鼠的肺泡间隙均等,肺泡腔中没有明显的渗出以及炎症性包裹。ALI模型组小鼠的肺部组织病理学检查可见其肺泡间隙显著加宽、肺间质内血管有充血、出血同时弥漫的炎症性包裹。氯沙坦干预组中小鼠肺部病理学检查可见肺泡间隔稍稍加宽,产生少部分出血以及炎症性包裹,与ALI模型组相比损伤大大降低。见图1,2。
2.2 氯沙坦对小鼠肺LW/BW比的影响 6 h、12 h和24 h各组小鼠肺LW/BW比较,经方差分析,差异有统计学意义;与健康对照组相比,ALI模型组和氯沙坦干预组小鼠肺LW/BW升高(P<0.05);氯沙坦干预组肺LW/BW较ALI模型组降低(P<0.05),见表1。
表1 氯沙坦对小鼠肺LW/BW比的影响/(%,±s)

表1 氯沙坦对小鼠肺LW/BW比的影响/(%,±s)
注:LW/BW为肺湿重/体质量,ALI为急性肺损伤;与健康对照组比较,a P<0.05;与ALI模型组比较:b P<0.05
24 h 0.50±0.03 0.67±0.05 a 0.58±0.06 ab 5.73 0.005组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 0.49±0.03 0.71±0.04a 0.63±0.04ab 6.38 0.003 12 h 0.51±0.04 0.69±0.05a 0.61±0.03ab 5.96 0.005
2.3 氯沙坦对小鼠肺Smith损伤评分的影响 6 h、12 h和24 h,与健康对照组相比,ALI模型组和氯沙坦干预组小鼠肺组织病理切片评分增高(P<0.05);氯沙坦干预组肺损伤评分较ALI模型组明显降低(P<0.05)见表2。
表2 氯沙坦对小鼠肺Smith损伤评分的影响/(分,±s)

表2 氯沙坦对小鼠肺Smith损伤评分的影响/(分,±s)
注:ALI为急性肺损伤;与健康对照组比较,a P<0.05;与ALI模型组比较,b P<0.05
24 h 0.57±0.19 5.31±0.21 a 3.27±0.33 ab 121.38 0.003组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 0.66±0.23 5.56±0.22a 3.98±0.21ab 127.24 0.003 12 h 0.61±0.20 5.49±0.19a 3.89±0.28ab 118.67 0.004
2.4 氯沙坦对小鼠肺组织匀浆IL-6水平的影响比较6 h、12 h和24 h各组小鼠肺组织匀浆IL-6含量,经方差分析,差异有统计学意义(F=12.34、14.28和16.49,P=0.004、0.003和0.002)。6 h、12 h和24 h ALI模型组小鼠肺组织匀浆中IL-6含量与健康对照组相比,差异有统计学意义(P<0.05);与ALI模型组比较,氯沙坦干预组IL-6含量降低(P<0.05),见表3。
2.5 氯沙坦对小鼠肺组织DC数量的影响 6 h、12 h和24 h各组小鼠肺组织DC数量比较,经方差分析,差异有统计学意义(F=17.64、14.21和12.76,P=0.003、0.004和0.005)。与健康对照组比较,ALI模型组肺组织DC数量和氯沙坦干预组肺组织DC数量均显著升高(P<0.05)。ALI模型组与氯沙坦干预组肺组织DC数量差异无统计学意义(P>0.05),见表4。
表3 氯沙坦对小鼠肺IL-6水平的影响/(pg/mg,±s)

表3 氯沙坦对小鼠肺IL-6水平的影响/(pg/mg,±s)
注:ALI为急性肺损伤;IL-6为白细胞介素-6;与健康对照组比较,a P<0.05;与ALI模型组比较,b P<0.05
24 h 355±108 3 018±264a 1 786±153ab 16.49 0.002组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 396±96 2 864±185a 2 135±193ab 12.34 0.004 12 h 341±72 3 568±369a 2 539±238ab 14.28 0.003
表4 氯沙坦对小鼠肺树突状细胞数量的影响/(%,±s)
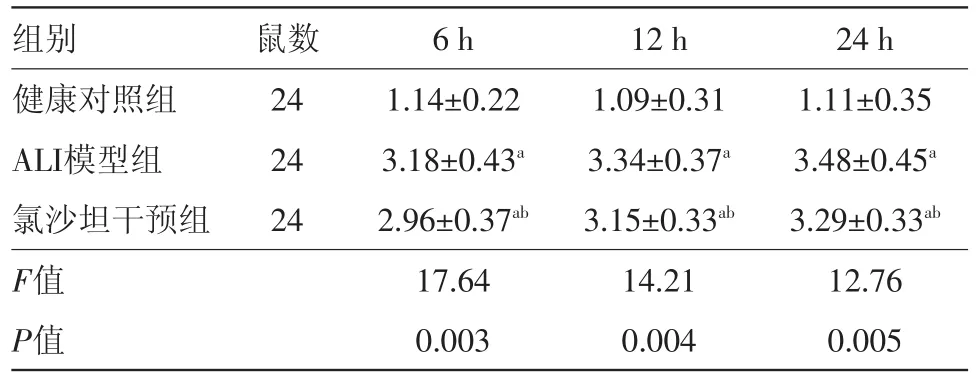
表4 氯沙坦对小鼠肺树突状细胞数量的影响/(%,±s)
注:ALI为急性肺损伤;与健康对照组比较,a P<0.05;与ALI模型组比较,b P>0.05
24 h 1.11±0.35 3.48±0.45a 3.29±0.33ab 12.76 0.005组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 1.14±0.22 3.18±0.43a 2.96±0.37ab 17.64 0.003 12 h 1.09±0.31 3.34±0.37a 3.15±0.33ab 14.21 0.004
2.6 氯沙坦对小鼠肺部组织DC表达CD80的作用 6 h、12 h和24 h各组小鼠肺组织DC表达CD80比较,经方差分析,差异有统计学意义(F=12.42、16.58和21.37,P=0.006、0.004和0.002)。与健康对照组比较,ALI模型组和氯沙坦干预组肺DC表达CD80均升高(P<0.05)。ALI模型组肺DC表达CD80明显高于氯沙坦干预组(P<0.05),见表5和图3。
2.7 氯沙坦对小鼠肺组织DC表达MHCⅡ的影响 6 h、12 h和24 h各组小鼠肺组织DC表达MHCⅡ比较,经方差分析,差异有统计学意义(F=1.45、1.68和1.35,P=0.068、0.061和0.072)。与健康对照组比较,ALI模型组肺DC表达MHCⅡ和氯沙坦干预组肺DC表达MHCⅡ差异无统计学意义(P>0.05),健康对照组和氯沙坦干预组肺DC表达MHCⅡ差异无统计学意义(P>0.05),见表6和图4。
表5 氯沙坦对小鼠肺树突状细胞功能状态的影响/(%,±s)

表5 氯沙坦对小鼠肺树突状细胞功能状态的影响/(%,±s)
注:ALI为急性肺损伤;与健康对照组比较,a P<0.05;与ALI模型组比较,b P<0.05
24 h 3.52±0.98 12.43±3.07a 9.24±3.01ab 21.37 0.002组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 3.51±0.94 9.78±2.37a 7.41±2.64ab 12.42 0.006 12 h 3.56±1.02 10.56±2.69a 8.59±2.86ab 16.58 0.004
表6 氯沙坦对小鼠肺树突状细胞抗原提呈功能的影响/(%,±s)

表6 氯沙坦对小鼠肺树突状细胞抗原提呈功能的影响/(%,±s)
注:ALI为急性肺损伤;与健康对照组比较,a P>0.05;与ALI模型组比较,b P>0.05
24 h 82.33±17.52 80.27±18.16a 79.39±18.05ab 1.35 0.072组别健康对照组ALI模型组氯沙坦干预组F值P值鼠数24 24 24 6 h 81.31±16.94 78.24±18.23a 78.98±18.56ab 1.45 0.068 12 h 83.67±18.15 79.61±17.59a 80.14±18.34ab 1.68 0.061
3 讨论
因为炎症感染等多种原因使肺部多种炎性因子激活,从而使肺部组织的免疫反应失去控制是ALI发生的主要原因[13-14]。与此同时,缺少特异性药物的治疗成为影响其病情发展以及预后主要因素之一[15]。有研究[16]显示,肺部RAS系统的活跃状态在整个ALI的免疫紊乱中起到非常关键的作用。也有研究[6]显示,氯沙坦可以显著降低ALI肺部的炎性损伤,这揭示了其在ALI的临床治疗上可能具有重要的应用价值。而探究氯沙坦对ALI肺部免疫紊乱造成的炎性损伤机制有极其重大的意义。
本研究应用向气管内注射脂多糖复制构建小鼠ALI模型,来重现由于肺部炎症感染所致ALI的整个过程。本研究可见:ALI模型组小鼠肺LW/BW显著升高,肺部切片能够看到肺泡间隙加宽、肺部充血、出血以及弥漫性的炎性细胞的包裹,且IL-6水平也有显著的增高,这都表明ALI模型复制成功[17]。本研究还可见到:与ALI模型组比较,经氯沙坦干预的小组LW/BW降低,肺部组织免疫损伤有所缓解,肺损伤的评分显著降低,并且肺IL-6水平也明显减低,提示氯沙坦能够缓解肺部损伤。此外本研究还发现,与健康对照组相比,经氯沙坦干预组的小鼠肺部炎症损伤水平依旧较高,提示氯沙坦对ALI产生部分保护的效果。
在肺部免疫系统的防御和保护中,肺DC都起到了非常重要的作用,其数目和功能与免疫效能的发挥有着相当密切的联系[18]。目前已知的肺部感染,慢性阻塞性肺疾病以及支气管哮喘等肺部炎性病变的产生与发展都有肺DC的参与[19]。本次实验结果显示,ALI小鼠的肺DC有广泛积聚现象,其中其表达的CD80水平也显著升高,这些均提示在ALI肺部炎性反应中,都有成熟的肺DC的身影。且在调节ALI肺部免疫损伤这一过程中,肺DC可能成为其重要靶点。健康对照组与ALI模型组小鼠肺DC表的达MHCⅡ分子水平都相对较高,并且没有显著差异,提示ALI小鼠肺DC的抗原递呈能力没有很大改变。机体内免疫反应的种类以及水平可能是由其DC的数目和功能来决定的。有研究[7]显示,由博来霉素诱发的小鼠肺损伤模型中肺部成熟DC数目有明显升高并且其同时还参与肺部免疫反应,阻碍肺DC的发育成熟能够明显缓解肺部的炎性损伤及其纤维化。
本研究证明:经氯沙坦干预小组对脂多糖(LPS)-ALI小鼠肺DC数目没有太大影响,但是表达CD80的肺DC比例显著降低,揭示了氯沙坦能够通过阻碍肺DC成熟缓解ALI肺部免疫损伤水平。氯沙坦对ALI肺DC表达的MHCⅡ分子不产生显著影响,提示了氯沙坦可能对DC的抗原递呈功能没有明显影响。也有研究[9]发现,氯沙坦能够显著减轻实验性自身免疫性脑脊髓炎小鼠脑以及脊髓中的免疫损伤主要是依赖于对其组织中DC的激活和成熟的抑制。这也更加深入地说明了氯沙坦能够通过阻碍DC成熟从而实现对ALI的免疫调节。
综上所述,氯沙坦能够通过抑制肺DC的发育成熟从而调节ALI肺部免疫损伤,在治疗ALI的临床手段上可能具有非常重要的应用价值。
(本文图1~4见插图4-1)
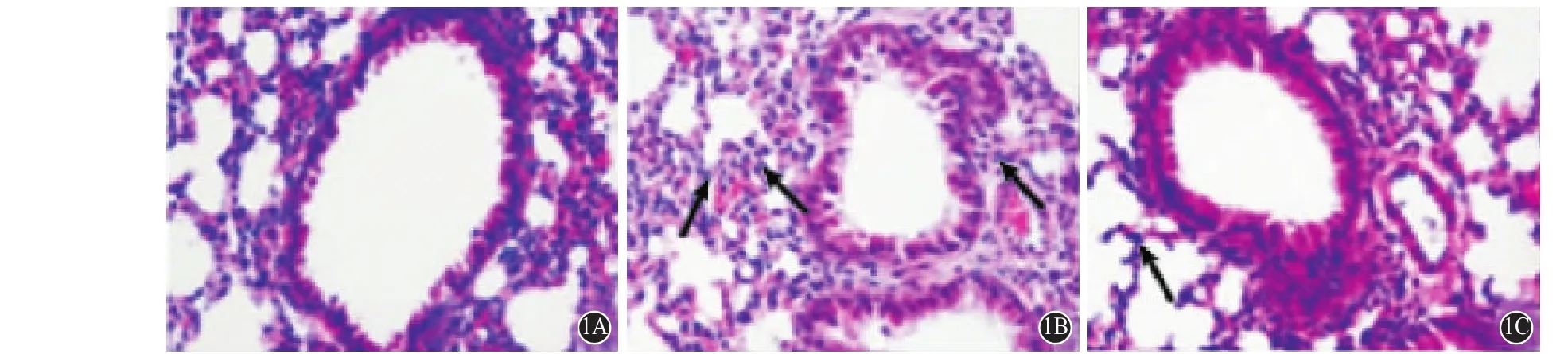
图1 氯沙坦对6h小鼠肺组织病理变化的影响(HE×200):1A为健康对照组,1B为急性肺损伤模型组,1C为氯沙坦干预组(箭头所示为中性粒细胞)

图2 急性肺损伤模型组6h肺部组织的标志性病理变化(HE×400):2A为肺泡间隔增宽,其内可见大量炎症细胞包裹,2B为血管壁和肺泡腔内中性粒细胞等炎性细胞大规模侵袭(箭头所示为中性粒细胞),2C为肺泡腔中有出血,2D为肺部小血管充血、渗出

图3 氯沙坦对6h小鼠肺组织CD80的影响:3A为健康对照组,3B为急性肺损伤模型组,3C为氯沙坦干预组

图4 氯沙坦对6h小鼠肺组织主要组织相容性复合物(MHC)Ⅱ的影响:4A为健康对照组,4B为急性肺损伤模型组,4C为氯沙坦干预组

