不同年龄范围界定下的年轻乳腺癌患者的临床病理特征及预后分析
叶 欣,周晓云,杨 莉,王 杰,何 奇
上海交通大学医学院附属国际和平妇幼保健院乳腺科,上海市胚胎源性疾病重点实验室,上海市临床重点专科(建设项目) - “强主体”妇产科,上海 200030
乳腺癌是女性最为常见的恶性肿瘤之一,随着发病年龄逐渐低龄化,多项研究[1-3]表明年龄是乳腺癌复发和死亡的独立危险因素,且年轻乳腺癌患者的肿瘤具有更强的侵袭性和更差的预后。目前,关于对年轻乳腺癌患者的年龄界限尚存争议。相关文献[1-2,4-6]报道,在发达国家将≤ 40岁的乳腺癌患者定义为年轻乳腺癌患者,其发病率为5%~7%。亦有将年轻乳腺癌患者定义为≤ 35岁的乳腺癌患者[7-12]。在欧美国家≤ 35岁的乳腺癌患者占其总体的2%,在亚洲国家这一比例则较高(约占10%)[13]。在我国,乳腺癌患者的发病年龄高峰期较欧美国家提前10年[14],因此国内多数文献常以35岁作为年轻乳腺癌患者的年龄界限[8-12,15-17]。然而该界限的定义尚存在较多问题待商榷,例如在我国≤ 35岁患者与>35 且≤ 40岁患者的临床病理特征、预后等是否存在差异。基于此,本研究回顾性分析了上海交通大学医学院附属国际和平妇幼保健院诊疗的年龄≤ 40岁的乳腺癌患者,以35岁为分界线,分析不同年龄范围的年轻乳腺癌患者间的临床病理特征、预后的差异及其影响因素,以期为国内年轻乳腺癌患者的年龄界限的划分提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2010年1月1日—2018年12月31日于上海交通大学医学院附属国际和平妇幼保健院诊治并行手术治疗的年龄≤ 40岁的女性乳腺癌患者350例。入组标准:①病理证实为原发性乳腺癌。②初始治疗为手术治疗。③有完整的免疫组织化学的检查结果。④已接受相应的规范化治疗,包括无后续治疗随访、化学治疗、放射治疗、内分泌治疗及靶向治疗。排除标准:①已发生远处转移。②处于妊娠期。③合并第二原发肿瘤。④因肝功能、肾功能及心功能异常而未能接受规范化治疗。
根据上述标准,本研究共纳入336例年轻乳腺癌患者,其中导管原位癌44例,浸润性导管癌277例(非特殊类型浸润性乳腺癌262例、浸润性微乳头状癌9例、浸润性乳头状癌4例、神经内分泌癌及髓样癌各1例),其他类型乳腺癌15例(浸润性小叶癌2例、小叶原位癌2例及黏液腺癌11例)。以35岁为年龄界限,将患者分为≤ 35岁组(137例)及>35 且≤ 40岁组(199例)。
本研究已获得上海交通大学医学院附属国际和平妇幼保健院伦理委员会审批[审批号:(GKLW)2019-23]。所有研究对象均知情同意。
1.2 临床病理特征获取
收集入组患者的术后病理报告,获得其临床病理特征资料,包括组织学类型、细胞组织学分级、肿瘤大小、淋巴结转移、雌激素受体(estrogen receptor,ER)表达、孕激素受体(progesterone receptor,PR)表达、人类表皮生长 因 子 受 体 2(human epidermal growth factor receptor-2,HER2)表达、Ki-67表达情况及脉管内癌浸润程度等。其中,ER、PR、HER2、Ki-67的表达情况和脉管内癌浸润程度均由病理科医师利用免疫组织化学技术进行检测。根据肿瘤细胞中相应受体的表达情况,对染色标记结果进行判定,具体如下。
(1)ER及PR表达 对肿瘤细胞的ER(或PR)进行染色标记,若细胞核内棕黄色染色超过1%,则判定为ER(或PR)阳性表达。
(2)HER2表达 对肿瘤细胞的HER2进行染色标记,以肿瘤细胞膜染色情况判断HER2的表达状态:①0为肿瘤细胞膜无染色或≤ 10%的浸润癌细胞呈不完整的、微弱的细胞膜染色,判定为HER2阴性表达。②+为>10%的浸润癌细胞呈不完整的、微弱的细胞膜染色,判定为HER2阴性表达。③++分为2种情况,第一种为>10%的浸润癌细胞呈不完整和/或弱至中等强度的细胞膜染色,第二种为≤ 10%的浸润癌细胞呈强而完整的细胞膜染色,判定为HER2表达不确定。④+++为>10%的浸润癌细胞呈强而完整的细胞膜染色,判定为HER2阳性表达。
而对于HER2表达不确定者,需行荧光原位杂交(fluorescence in situ hybridization,FISH)进一步验证。取20个肿瘤细胞,根据细胞中HER2信号和第17号染色体计数探针(chromosome 17 enumeration probe,CEP17)信号的数量及比值判断HER2受体的表达。①当HER2/CEP17 ≥ 2.0,提示HER2基因扩增,即FISH阳性。②HER2/CEP17<2.0且平均HER2基因拷贝数≥ 6.0,提示HER2基因扩增,即FISH阳性。③HER2/CEP17<2.0且平均HER2基因拷贝数<4.0,提示HER2基因无扩增,即FISH阴性。④HER2/CEP17<2.0、平均HER2基因拷贝数≥ 4.0 且<6.0,HER2基因扩增不确定。
(3)Ki-67表达 对肿瘤细胞的Ki-67进行染色标记,选取染色标记最为集中的区域(热点区)予以计数,判断其所占百分比(%)。
(4)脉管内癌浸润程度 对肿瘤组织进行苏木精-伊红染色,在淋巴管、神经管及血管内见到形态学上的肿瘤细胞,全部包含或部分包含在管腔内均判定为脉管内癌浸润。
此外,本研究参考2013年St. Gallen共识中关于乳腺癌分子分型的定义[18],即分为Luminal A型(ER阳性、PR表达≥ 20%、HER2阴性且Ki-67<14%)、Luminal B型(ER/PR阳性、HER2阴性且Ki-67>14%或PR表达<20%;ER/PR阳性、HER2阳性且任何状态的Ki-67)、HER2型(ER阴性、PR阴性、HER2阳性且任何状态的Ki-67)及三阴性型(ER阴性、PR阴性、HER2阴性且任何状态的Ki-67)共4个亚型,对浸润性导管癌患者进行分子分型。同时,参照美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7 版肿瘤分期系统,对该类患者进行病理分期(pTNM)。
1.3 随访及预后分析
所有患者随访至2019年4月1日,随访时间6~100个月,中位随访时间50个月。观察并记录在随访期间患者是否出现局部及区域复发、远处转移、对侧乳腺癌、第二原发肿瘤及死亡等事件。比较浸润性导管癌患者中≤ 35岁组及>35 且≤ 40岁组之间的无病生存期(disease-free survival,DFS)并探究其影响因素。DFS的定义为诊断时至出现局部及区域复发、远处转移、对侧乳腺癌、第二原发肿瘤及任何原因死亡的时间。
1.4 统计学方法
采用SPSS 22.0对研究数据进行统计分析。定性资料以频数和百分率表示,采用χ2检验。采用Kaplan-Meier法对DFS进行分析。采用比例风险回归模型(proportional hazards model,Cox模型)对生存相关性进行多因素分析。上述方法均采用双侧检验,检验水准α=0.05。在χ2检验和Kaplan-Meier法中,P<0.05表示差异具有统计学意义。在Cox模型中,P<0.1表示差异具有统计学意义。
2 结果
2.1 临床病理特征分析
2.1.1 所有患者的组织学类型分析 本研究采用χ2检验对336例患者的组织学类型占比进行分析,结果显示2组患者在不同组织学类型占比间差异均无统计学意义(χ2=3.884,P=0.143,表 1)。
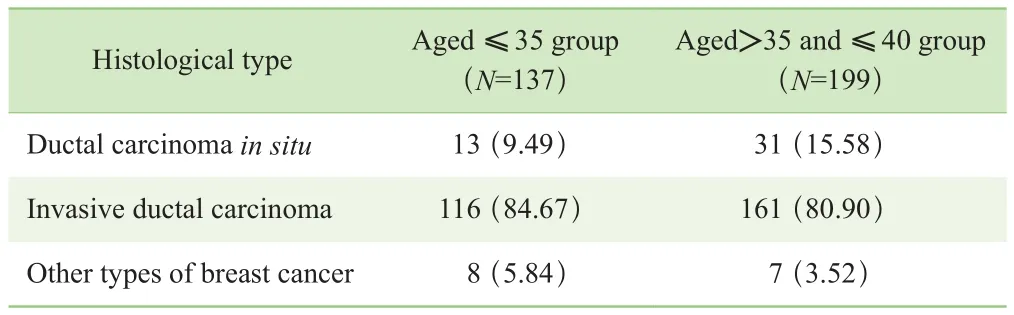
表1 入组患者的组织学类型分析[n (%) ]Tab 1 Analysis of the histological types of all the patients [n (%)]
2.1.2 导管原位癌患者的细胞组织学特征分析 本研究采用χ2检验对44例导管原位癌患者的细胞组织学分级占比进行分析,结果显示2组患者的该占比间差异均无统计学意义(χ2=3.611,P=0.164);其中,5例患者的组织学分级为未知(表2)。由于该5例患者均为外院行肿块切除活检术后的病理结果,后经我院病理科会诊定性,因此无法追溯其组织学分级。

表2 2组导管原位癌患者的细胞组织学分级分析[n (%) ]Tab 2 Analysis of the histological classification of ductal carcinoma in situ between the two groups [n (%)]
2.1.3 浸润性导管癌患者的临床病理特征分析 本研究采用χ2检验对277例浸润性导管癌患者的临床病理特征进行分析,结果显示2组患者在细胞组织学分级、肿瘤大小、淋巴结转移、ER表达、PR表达、HER2表达、Ki-67表达、脉管内癌浸润程度、pTNM及分子分型间差异均无统计学意义(表3)。其中,在组织学分级中有15例患者为未知,即为特殊类型浸润性导管癌;在HER2表达及分子分型分析中均有2例未知者,该患者均因经济困难而未行FISH检测。

表3 2组浸润性导管癌患者的临床病理特征分析[n (%) ]Tab 3 Analysis of the clinicopathological features of invasive ductal carcinoma between the two groups [n (%)]

Continued Tab
2.2 浸润性导管癌患者的DFS分析
本研究共计入选年轻乳腺癌患者336例,失访28例,总体随访率为91.67%。在277例浸润性导管癌患者中,失访26例,随访率为90.61%。其中,该类患者发生复发转移20例,包括局部复发5例、肝转移5例、骨转移2例、肺转移2例、对侧转移2例、肝转移合并肺转移2例、肝转移合并骨转移1例、局部复发合并骨转移1例;该类患者合并发生第二原发肿瘤2例,包括白血病1例和甲状腺癌1例;最终,该类患者共计死亡7例,即由第二原发肿瘤死亡1例(白血病),复发转移死亡6例。
采用Kaplan-Meier 法对277例浸润性导管癌患者的DFS进行分析,结果显示≤ 35岁组患者与>35且≤ 40岁组患者的3年DFS分别为89.66%和95.03%,且差异无统计学意义(图1)。继续对该2组患者的分子分型进行分析,结果显示在Luminal A型、Luminal B型、三阴性型及HER2型中2组患者的3年DFS间差异均无统计学意义(图2)。

图1 2组浸润性导管癌患者的DFS曲线分析Fig 1 Analysis of DFS curves in the two groups of invasive ductal carcinoma

图2 2组浸润性导管癌患者不同分子分型的DFS曲线分析Fig 2 Analysis of DFS curves of different molecular subtypes in the two groups of invasive ductal carcinoma
随后,本研究采用Cox模型对影响2组浸润性导管癌患者DFS的相关性因素进行多因素分析,结果显示脉管内癌浸润和淋巴结转移是DFS的独立危险因素(表4)。

表4 277例浸润性导管癌患者DFS影响因素的Cox模型分析Tab 4 Cox model analysis of influence factors of DFS in 277 patients with invasive ductal carcinoma
3 讨论
在我国,乳腺癌的平均发病年龄为48.7岁[19],发病年龄高峰较欧美国家趋于年轻化。在欧美国家,≤ 40岁的乳腺癌患者被定义为年轻乳腺癌患者,≤ 35岁则被定义为极年轻乳腺癌患者[5];而在我国,多数研究将≤ 35岁的乳腺癌患者定义为年轻乳腺癌患者[8-12,15-17]。目前,尚未有文献就国内的≤ 35岁患者与>35 且≤ 40岁患者间是否存在预后差异进行报道。基于此,本研究对该2个年龄范围的患者进行分析,以探究不同年龄界限下的年轻乳腺癌患者的临床病理特征及预后。
年轻化的乳腺癌被认为具有较强的侵袭性,预后较差且极易合并发生第二原发乳腺癌或卵巢癌[4]。国外相关文献[4]发现,与年龄>45岁或年龄≥ 65岁的乳腺癌患者相比,年龄≤ 40岁的乳腺癌患者表现为ER低表达、HER2高表达,肿瘤体积较大,且呈现组织学分级、淋巴结转移率均较高的特点。在我国,相关文献多以35岁作为年龄界限值,定义≤ 35岁的乳腺癌患者为年轻乳腺癌患者,但得到的结果尚不一致;究其原因,主要是各研究中对照组年龄范围的设定有所不同,包括>35岁、35~60岁、>60岁、>65岁等。而对于能够获得一致性结果的研究进行分析发现,其均以年龄>60岁的乳腺癌患者为对照组,并显示≤ 35岁的乳腺癌患者可呈现ER低表达、HER2高表达、组织学分级较高、肿瘤体积较大的特性[8-10,12,20]。与此同时,并未发现针对35~40岁乳腺癌患者的相关研究,即该年龄范围患者的预后情况以及其与其他年龄范围患者之间的临床病理特征和预后差异。Collins等[21]的前瞻性研究将乳腺癌患者按年龄≤ 30岁、>30且≤ 35岁和>35且≤ 40岁分组并进行组间的分析比较,结果显示3组患者在组织学特征、ER表达、PR表达及HER2表达间的差异均无统计学意义。本研究亦得到了同样的结果,即≤ 35岁乳腺癌患者与>35 且≤ 40岁乳腺癌患者在组织学类型、细胞组织学分级、肿瘤大小、淋巴结转移、ER表达、PR表达、HER2表达、Ki-67表达、脉管内癌浸润程度、分子分型及pTNM间差异均无统计学意义,≤ 35岁乳腺癌患者相较于>35 且≤ 40岁患者并未表现出更具侵袭性的特点。
多项大型研究[1]显示,低龄是乳腺癌复发和死亡的独立危险因素,且年轻乳腺癌患者即使接受了较激进的治疗,仍然具有较高的复发和死亡风险。同时,亦有研究显示出相反的结果。Partridge等[22]和Ademuyiwa等[23]研究均认为,与ER表达和或PR表达阳性的乳腺癌患者相比,ER表达和PR表达均为阴性的乳腺癌患者以及HER2表达阳性的乳腺癌患者的预后较差,且该2类患者的5年总生存率并未随年龄的增加而出现较大差异,提示较差的预后与年龄无关。国内研究[10]显示,虽然≤ 35岁乳腺癌患者的5年DFS低于>60岁的乳腺癌患者(76.2% vs 92.2%,P=0.002),但将上述≤ 35岁的105例患者进一步按年龄划分为3组,(即≤ 25岁、>25且≤ 30岁、>30且≤ 35岁)进行研究发现,该3组患者的临床病理特征、5年DFS和5年总生存率间差异均无统计学意义;且经多因素分析发现,肿瘤直径>5 cm、腋窝淋巴结转移是≤ 35岁乳腺癌患者5年DFS的独立危险因素。继而提示,更低龄的患者并未呈现出更差的预后,影响预后的主要因素是较大的肿瘤负荷和腋窝淋巴结转移。在本研究中,针对≤ 35岁的乳腺癌患者与>35且≤ 40岁的乳腺癌患者的DFS曲线分析发现,该2组患者的总体DFS及各分子分型中DFS间差异均无统计学意义;Cox模型分析显示,脉管内癌浸润和淋巴结转移是DFS的独立危险因素。由此可见,影响DFS的独立危险因素仍然是淋巴结转移和脉管内癌浸润,而非年龄。
此外本研究还存在一定的局限性:①本研究为单中心研究,样本量较少,使得各分子分型的样本量亦较小,从而可能导致各分子分型患者占比相较于总体人群、各分子分型对2组患者的预后影响均存在一定偏倚。因此在进行Cox模型分析时,本研究将界值(P值)适当放宽以探究差异,若界值为0.05,则可能无法得到有统计学意义的结果。后续,我们将扩大样本量并延长随访时间,对该结果加以验证。②复发转移及死亡事件发生的例数较少,使得DFS的探究可能得不到有意义的结果,未来仍需通过延长随访时间进一步分析。③本研究着重于不同年龄范围界定下的年轻乳腺癌患者的预后差异,未设置≥ 40岁的乳腺癌患者为对照组。后续,我们将纳入该年龄范围的患者,以探究年龄在乳腺癌预后中的影响。
综上,≤ 35岁的年轻乳腺癌患者与>35且≤ 40岁的乳腺癌患者具有相似的病理特征及预后,应给予该2个年龄范围患者同样的更为积极有效的治疗,以降低复发转移风险、提高生存率。同时,基于我国和欧美国家对于年轻乳腺癌患者的年龄界限的差异,后续或将开展进一步的研究,分析不同年龄范围下乳腺癌患者的预后情况,从而为我国寻找适合的年轻乳腺癌患者的界限值提供参考。

