鸦胆子油口服乳液对甲基苄基亚硝胺诱发的大鼠食管癌变的作用及氧化应激的影响
施文荣,涂春香,陈 玲,余文珍,刘 艳
(福建中医药大学中西医结合学院,福建 福州350122)
药理研究发现:鸦胆子油口服乳液(brucea java oil emulsion,BJOE)有抗肿瘤作用,目前临床已应用于食管癌、胃癌、肝癌、肺癌等多种恶性肿瘤的治疗[1-5],但是BJOE 应用于肿瘤治疗中通常是与化疗剂连用,起到辅助作用,单独应用BJOE 治疗肿瘤的报道不多。 另外,关于鸦胆子作用机理方面研究发现,鸦胆子可通过抑制细胞增殖、诱导细胞凋亡、抑制肿瘤转移和血管生成等机制抗肿瘤[6]。 抗氧化应激也是肿瘤治疗的常见机制,已知鸦胆子油具有一定的抗氧化作用[7],但是也有报道指出,鸦胆子油能通过增强肿瘤组织的氧化损伤起到抗肿瘤作用[8],存在矛盾。 所以有必要弄清氧化应激在鸦胆子油抗癌效应中的作用。
已知氧化应激是食管癌的形成过程的重要因素[9-10],亚硝胺类化合物是环境中普遍存在的强致癌污染物,是食管癌的常见诱因。 甲基苄基亚硝胺(MBNA)诱发的大鼠食管癌模型是目前公认的食管癌化学预防模型,该模型病理形态改变与人食管鳞癌的发生顺序平行[11]。本研究利用MBNA 诱发的大鼠食管癌模型探讨BJOE 的抗肿瘤作用及与氧化应激的关系,为BJOE 的药理研究提供参数,也为BJOE的临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级Wistar 雄性大鼠(上海斯莱克实验动物有限公司),体质量180~200 g,生产许可证:SCXK(沪)2012-0002。
1.1.2 药物与试剂 MBNA 由本实验室有机合成;BJOE(沈阳药大雷允上药业有限责任公司,批号:271601051);RNA 组织保存液(上海华舜生物工程公司);Trizol 试剂、SuperScript Ⅲ逆转录试剂盒、定量PCR 检测试剂盒[赛默飞世尔科技(中国)有限公司];总抗氧化能力检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、BCA 蛋白定量试剂盒(上海碧云天生物技术有限公司);谷胱甘肽过氧化酶(GSH-Px)测试盒(南京建成生物工程研究所);丙二醛(MDA)检测试剂盒(江苏凯基生物技术股份有限公司);所用引物由上海生工生物工程公司根据设计合成。
1.1.3 主要仪器 SDS-PAGE 电泳仪、转膜仪(美国Bio-Rad 公司);荧光定量PCR 仪(德国Eppendorf 公司)。
1.2 方法
1.2.1 分组与给药 参考文献[12]制备Wistar 大鼠食管癌模型,32 只大鼠随机分成正常组8 只和造模组24 只,造模组以MBNA 3.5 mg/kg 每周2 次颈背部皮下注射,正常组颈背部皮下注射等体积氯化钠注射液连续注射15 周。 成模大鼠按体重分层随机分为模型组、BJOE 高剂量组(高剂量组)、BJOE低剂量组(低剂量组),每组8 只。 于第16 周开始,高、低剂量组分别以BJOE 12、6 mL/kg 灌胃给药,模型组和正常组以6 mL/kg 蒸馏水灌胃,每日1 次,共10 周。 根据实验动物等效临床剂量换算,高、低剂量组中药给药剂量相当于成人日剂量(1 mL/kg)的2 倍和1 倍。
1.2.2 食管黏膜病理观察 实验结束时处死4 组大鼠,沿食管纵行剖开,于解剖镜下观察食管黏膜病变情况,拍照记录。 取典型病变组织用10%中性福尔马林固定液固定,常规制片,HE 染色,光镜观察病理组织学变化。 余下食管保存于RNA 保存液中,用于提取食管组织总RNA。
1.2.3 氧化应激指标检测 各组大鼠食管癌造模15 周末,尾静脉采血,分离各组血清;实验结束后处死大鼠,分离各组血清待测。 取大鼠肝组织约200 mg液氮反复冻融3 次,加入0.1 moL/mL PBS(pH 7.2)1 mL,低温研磨制备20%肝组织匀浆,4 ℃3 000 r/min 离心15 min,取上清于-80 ℃冻存备用。血清及肝组织SOD、GSH-Px、总抗氧化能力、MDA 测定按试剂盒说明书进行。
1.2.4 基因转录水平检测 抗氧化通路相关基因细胞色素P450 酶1A1(CYP1A1)、细胞色素P450 酶2E1(CYP2E1)、过氧化氢酶(CAT)、谷胱甘肽S-转硫酶M1(GSTM1)、醌氧化还原酶1(NQO1)、甲基转移酶(MT)、乙酰基转移酶(NAT)、亚甲基四氢叶酸还原酶(MTHFR)、转录因子NF-E2 相关因子2(Nrf2)、Kelch 样环氧氯丙烷相关蛋白-1(Keap1)转录水平检测采用Real-time RT-PCR 法。 实验结束后用Trizol 法提取4 组大鼠食管组织总RNA,核酸蛋白分析仪检测A260 nm/A280 nm 比值,计算RNA 浓度;琼脂糖凝胶电泳检测RNA 完整性。使用SuperScript Ⅲ逆转录试剂盒将总RNA 中的mRNA逆转录为cDNA,再以cDNA 为模板进行荧光实时定量PCR 检测(SYBR 染料法),扩增条件为:95 ℃预变性2 min,95 ℃20 s,60 ℃20 s,72 ℃30 s,40 个循环。 反应结束后确认扩增曲线和熔解曲线,以β-actin 为内参基因, 用2-△△Ct值表示目的基因转录水平。 各基因引物及扩增产物片段长度见表1。
1.3 统计学方法 采用SPSS 20.0 进行数据分析,计量资料属正态分布的以(±s)表示,采用单因素方差分析。
2 结 果
2.1 一般情况观察 实验过程中,正常组大鼠皮毛柔顺,有光泽,对外界刺激反应较灵敏;其余各组大鼠逐渐出现活动减少,食量下降,耸毛,毛色无光泽、易脱落,对外界刺激反应较迟钝等现象。
2.2 MBNA 诱变15 周及BJOE 作用10 周后造模组与正常组体质量比较 见表2、表3。
表2 MBNA 诱变15 周造模组与正常组体质量比较(±s)g

表2 MBNA 诱变15 周造模组与正常组体质量比较(±s)g
注:与正常组比较,1) P<0.01。
组别正常组造模组n 8 24造模前212.143±6.769 214.286±7.488造模后390.357±15.250 332.180±44.8751)
2.3 食管大体形态学及病理组织学变化 正常组大鼠食管黏膜光滑平整,未见明显异常;模型组,高、低剂量组大鼠食管黏膜均出现全段病变,食管黏膜粗糙,黏膜表面有细小颗粒样突起,出现乳突瘤样改变,成瘤率为100%。实验结束后,高、低剂量组食管黏膜的病变程度与模型组比较未见明显差异,结果见图1。 病理组织学显示:正常组大鼠食管黏膜上皮细胞1~3 层,细胞排列均匀,基底细胞层规整,未见异常改变;高、低剂量组病理组织学检查结果与模型组无明显差异,均表现为上皮细胞明显增生,层次增多,细胞排列紊乱,细胞向管腔方向增生。 结果见图2。
表3 BJOE 作用10 周造模组与正常组体质量比较(±s)g
表3 BJOE 作用10 周造模组与正常组体质量比较(±s)g
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.01。
组别正常组n 8造模组24治疗前390.357±15.250 330.385±45.892 342.692±44.563 323.462±44.845治疗后424.714±11.789 329.167±46.6101)338.100±41.9691)283.556±42.8961)2)
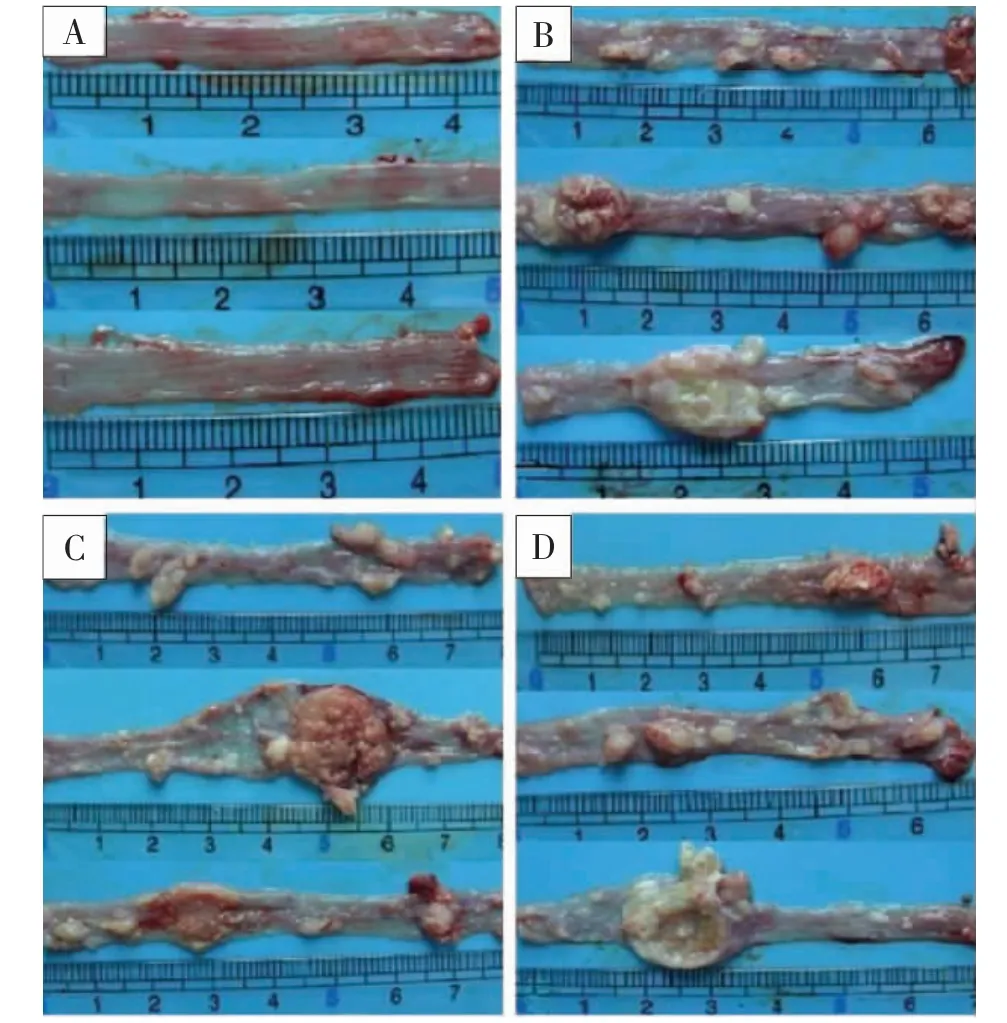
图1 4 组大鼠食管黏膜大体形态观察图

图2 4 组大鼠食管黏膜病理组织学光镜图(HE 染色,×200)
2.4 MBNA 诱变15 周2 组大鼠血清氧化应激指标及BJOE 作用10 周4 组大鼠血清及肝组织氧化应激指标比较 见表4~表6。
2.5 4 组大鼠食管组织抗氧化相关基因转录水平比较 见表7。
表4 MBNA 诱变15 周2 组大鼠血清氧化应激指标比较(±s)

表4 MBNA 诱变15 周2 组大鼠血清氧化应激指标比较(±s)
注:与正常组比较,1) P<0.05,2) P<0.01。
组别正常组造模组n 8 24 SOD/U 5.254±2.668 5.021±0.901 MDA/(mmol/L)87.767±5.899 156.306±42.2812)GSH-Px/U 1287.342±147.439 1443.987±147.2401)总抗氧化能力/(mmol/L)1.595±0.154 1.569±0.174
表5 BJOE 作用10 周4 组大鼠血清氧化应激指标比较(±s)

表5 BJOE 作用10 周4 组大鼠血清氧化应激指标比较(±s)
组别正 常 组模 型 组低剂量组高剂量组n 8 8 8 8 SOD/U 2.309±0.293 2.188±0.409 1.924±0.288 2.359±0.125 MDA/(mmol/L)236.561±21.980 253.166±30.055 250.236±68.908 255.119±19.946 GSH-Px/U 1246.078±80.947 1272.549±113.495 1223.529±119.399 1345.098±55.598总抗氧化能力/(mmol/L)1.057±0.176 0.952±0.071 0.808±0.152 0.944±0.212
表6 BJOE 作用10 周4 组大鼠肝组织氧化应激指标比较(±s)

表6 BJOE 作用10 周4 组大鼠肝组织氧化应激指标比较(±s)
注:与正常组比较,1) P<0.01;与模型组比较,2) P<0.05。
组别正 常 组模 型 组低剂量组高剂量组n 8 8 8 8 SOD/U 35.270±7.421 28.634±3.451 32.126±5.918 31.752±5.908 MDA/(mmol/L)18.446±2.657 22.263±5.515 18.421±3.930 30.422±10.3401)2)GSH-Px/U 243.345±33.750 223.441±56.195 179.836±57.228 232.266±46.722总抗氧化能力/(mmol/L)30.706±1.133 31.590±3.240 28.764±0.863 31.992±0.872
3 讨 论
鸦胆子为苦木科植物,产于我国广东、广西、海南等地。BJOE 是以鸦胆子石油醚提取物为原料,以大豆磷脂为乳化剂制成的水包油型乳剂,主要成分为鸦胆子油和豆磷脂。 现代药理研究表明:鸦胆子油具有一定的抗肿瘤作用,BJOE 可显著抑制肝癌细胞、宫颈癌细胞、肺癌细胞等肿瘤细胞的生长[13],可抑制S180 小鼠移植瘤的生长,对Lewis 肺癌、Heps肝癌裸鼠移植瘤模型也有明显的抑制作用[14]。但是,本研究结果发现,高、低剂量组与模型组比较,病理形态学与组织学均未有明显改变:表明BJOE不能阻断MBNA 诱导的大鼠食管癌变。可见,BJOE 虽然具有一定的抑癌作用,但是具有一定的选择性,对MBNA 诱发的大鼠食管癌模型无效。考虑到目前单独应用BJOE 抗癌作用的研究对象多是体外细胞模型和小鼠移植瘤模型, 对化学预防模型无阻断作用,所以BJOE 的抗癌作用尚存在疑义,需要进一步实验来证实。
表7 4 组大鼠食管组织抗氧化相关基因转录水平(±s)

表7 4 组大鼠食管组织抗氧化相关基因转录水平(±s)
注:与正常组比较,1) P<0.05,2) P<0.01;与模型组比较,3) P<0.05,4) P<0.01。
组别正 常 组模 型 组低剂量组高剂量组组别正 常 组模 型 组低剂量组高剂量组n 8 8 8 8 n 8 8 8 8 CYP1A1 1.000±1.305 0.499±0.632 0.810±1.017 1.488±1.816 MT 1.000±1.300 0.453±0.284 1.999±2.917 1.593±2.167 CYP2E1 1.000±1.325 0.565±0.891 1.384±1.510 1.347±2.042 NAT 1.000±0.617 6.712±9.197 0.395±0.439 0.488±0.444 CAT 1.000±0.819 9.028±3.4601)7.627±8.056 2.034±0.7384)MTHFR 1.000±0.774 11.242±13.945 32.775±23.9041)46.954±6.0662)3)GSTM1 1.000±0.680 0.852±0.584 1.142±0.911 0.906±0.405 Nrf2 1.000±0.796 3.551±3.270 3.543±0.672 3.577±1.945 NQO1 1.000±0.733 0.188±0.167 0.614±0.714 0.740±0.885 Keap1 1.000±0.656 1.235±1.557 2.264±2.274 1.513±1.947
药理研究表明:鸦胆子油具有一定的抗氧化作用。 然而我们前期研究发现:鸦胆子油提取物是通过增强肿瘤组织的氧化损伤起到抗肿瘤作用的,存在矛盾。 本研究探讨商品化生产的BJOE 是否具有抗氧化作用,发现BJOE 作用10 周后,高剂量组肝匀浆MDA 含量显著高于模型组,食管组织CAT 基因转录水平显著低于模型组。 MDA 作为脂质过氧化产物,其含量增加表明体内过氧化程度加剧[15-16],CAT 基因转录水平降低说明体内抗氧化的保护系统遭到一定的破坏,说明BJOE 对MBNA 诱发的模型大鼠食管癌变无抗氧化损伤作用,甚至加重了氧化应激程度。
在食管癌诱变过程中,氧化应激具有重要作用。诱变剂MBNA 在诱发食管癌模型过程中产生大量的自由基,引发的氧化应激对食管癌病变具有重要的促进作用。 另外,BJOE 在治疗过程中也体现了加重氧化应激的作用,已知抗癌药抗肿瘤机制之一就是诱导肿瘤细胞产生活性氧,损伤线粒体导致肿瘤细胞凋亡[17],可见氧化应激对食管癌的发展进程是把双刃剑。
另外,我们研究发现,商品化生产的BJOE 与实验室经乙醚浸提的鸦胆子油对MBNA 诱发的食管癌模型大鼠抗肿瘤作用有一定的差异:乙醚浸提的鸦胆子油显示出更强的毒性作用,对模型大鼠有微弱的抗肿瘤作用[8];而商品化生产的BJOE 对该模型未显示出可见的抗肿瘤效应。 出现这种结果,笔者认为主要是因为两种药物提取方法不同引起成分不同导致,乙醚浸提的鸦胆子油含有更多毒性物质。
最后,BJOE 在临床多与化疗联用,以后相关抗癌药理研究也应当结合化疗剂综合判定。

