酵母菌株及陈酿时间对桑葚酒主要理化指标和抗氧化能力的影响
孔燕,杨蕊羽,张明慧,付云云,廖丽,姜林君,陈安均
(四川农业大学 食品学院,四川 雅安,625000)
桑葚(Mulberry)又名桑枣、桑果、文武实等,为桑树(MorusalbaL.)所结的聚合型多肉浆果[1]。果肉柔嫩多汁,营养丰富,风味独特,而且色泽诱人[2]。桑葚中含有丰富的酚酸类物质,主要有花色苷、白黎芦醇、黄酮等[3]。酚酸类物质可以清除人体内自由基,起到舒展血管的作用;还具有抗癌、抗过敏的作用;能够抑制脂肪氧化酶等酶的活性[1]。
桑葚酒的酿造主要是在酵母的作用下,通过酒精发酵将桑葚变成桑葚酒。在桑葚酒生产中,酵母菌株的选择尤为重要,与发酵工艺共同影响着桑葚酒的品质[4]。
刚发酵后的桑葚酒不适宜直接饮用,需经过储藏一定时间,使不良风味消除或减少,同时生成新的芳香物质,使酒体绵软适口,醇厚香浓,口味协调。陈酿过程中发生复杂且缓慢的物理化学和生物化学变化[5]。包括单宁与单宁、单宁与花色苷、花色苷与花色苷之间的聚合与解离,桑葚酒的果香逐渐降低,醇香逐渐上升等。同时,在储藏期间,褐变与氧化反应对桑葚酒产生重要影响,二者会影响桑葚酒的感官特征及抗氧化特性[6]。
本实验采用RC212、D254、71B、F15和KD五株商业酿酒酵母酿制桑葚酒,再将桑葚酒陈酿,研究不同酵母菌株和陈酿时间对桑葚酒主要理化指标和抗氧化能力的影响。目前人们对果酒的需求除了口感和品质之外,保健功能也是人们日益关注的问题。因此,选择能发酵出具有较高抗氧化能力的桑葚酒的菌株,并且明确桑葚酒在陈酿过程中抗氧化能力的变化规律具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
新鲜桑葚,购自雅安农贸市场,品种为黑珍珠;酵母D254、RC212、71B,法国拉曼公司;酵母F15,法国拉氧德公司;酵母KD,法国马丁威兰特公司。
焦亚硫酸钠(食品级),一诺生物科技有限公司;NaOH、葡萄糖、乙醇、HCl、醋酸钠、KCl、Na2CO3、铁氰化钾、NaH2PO4、Na2HPO4、焦性没食子酸、福林酚试剂、三氯乙酸、ABTS(2,2-联氮基-双-(3-乙基苯丙二氢噻唑啉-6-磺酸)二铵盐)、过硫酸钾、VC、DPPH(1,1-二苯基-2-三硝基苯肼)(均为分析纯),成都市科隆化学品有限公司。
1.1.2 仪器与设备
SHP型生化恒温培养箱,北京中兴伟业仪器有限公司;Varioskan Flash荧光酶标仪,美国Thermo公司;Ulupure超纯水仪,成都优普;DZKW-D-4型电热恒温水浴锅,北京市永光明医疗仪器厂;DHG-9101型电热鼓风干燥箱,上海三发科学仪器有限公司。
1.2 实验方法
1.2.1 桑葚酒的酿制工艺
挑选无病虫害的新鲜桑葚,清洗干净,加入80 mg/kg SO2,室温密封处理3 h,添加蔗糖,调整糖分为20 Brix,分别接种0.03%酵母RC212、D254、71B、F15和KD,20 ℃发酵,酒精发酵结束后,皮渣分离,调整SO2浓度为80 mg/kg,室温下避光陈酿,发酵结束和陈酿的第2、3、6月进行倒罐、取样、-20 ℃保存。
1.2.2 主要理化指标的测定
测定5株菌株发酵桑葚酒的酒精度、总糖、总酸,测定方法按照国标GB/T15038—2006中的方法测定。
1.2.3 总酚含量的测定
参照朱明明等[7]的方法,采用福林-酚(Folin-Ciocalteu)法测定桑葚酒中总酚的含量。以焦性没食子酸为标准品绘制标准曲线。用蒸馏水将桑葚酒样品稀释50倍,取1 mL稀释溶液至10 mL刻度试管中,加入1 mL福林酚显色剂,再加入3 mL质量分数为7.5%的Na2CO3溶液,用蒸馏水定容至10 mL,摇匀,室温避光静置1 h,于波长760 nm处测定吸光值,以不加福林酚的酒样作为空白对照。根据焦性没食子酸标准曲线回归方程,计算样品中总酚含量,桑葚酒中总酚含量以每升桑葚酒毫克焦性没食子酸当量表示(g GAE/L)。
1.2.4 总花色苷含量的测定
参照焦扬等[8]的方法,采用pH示差法测定桑葚酒中总花色苷的含量。将桑葚酒样品稀释5倍。取1 mL稀释溶液,分别用pH=1的KCl-HCl缓冲溶液和pH=4.5的醋酸-醋酸钠缓冲溶液定容至10 mL,混匀,避光条件下静置30 min,分别在520和700 nm处测定吸光值,以蒸馏水为空白。总花色苷含量的计算公式(1)、(2)为:
ΔA=(A520-A700)pH=1.0-(A520-A700)pH=4.5
(1)
(2)
式中:DF,稀释倍数;MW,矢车菊素-3-葡萄糖苷(Cy-3-Glu)的相对分子质量,449.2;ε,Cy-3-Glu的消光系数,26 900 L/(mol·cm);n,液层的厚度,cm。
1.2.5 还原铁能力的测定
参照屈慧鸽等[9]的方法,采用普鲁士蓝法测定桑葚酒中还原铁的能力。以焦性没食子酸为标准品绘制标准曲线。用蒸馏水将桑葚酒样品稀释25倍,取1 mL稀释液,依次加入2 mL磷酸缓冲液(pH=7.8),2 mL铁氰化钾溶液(0.25%),混匀,60 ℃水浴25 min,再加入1 mL三氯乙酸溶液(9%),冷却至室温,分别移取1 mL反应液至2支10 mL具塞比色管中,其中一支用蒸馏水定容至10 mL做空白,另一支加入1.6 mL FeCl3溶液(0.05%),再用蒸馏水定容至10 mL,混匀,静置20 min后,在波长691 nm处测定吸光度值。根据焦性没食子酸标准曲线回归方程,计算样品还原铁的能力。
1.2.6 DPPH自由基清除能力的测定
参照牛广财等[10]的方法,以焦性没食子酸为标准物质绘制标准曲线。将酒样稀释300倍后,取2 mL样品稀释液,加入0.2 mmol/L DPPH溶液2 mL,摇匀,避光静置40 min,以无水乙醇为空白,于517 nm处测定吸光度,再在相同波长下测定2 mL DPPH溶液与2 mL无水乙醇混合液的吸光度。根据焦性没食子酸标准曲线回归方程,计算样品清除DPPH自由基的能力。
1.2.7 ABTS自由基清除能力的测定
参照徐艳岩[11]的方法,将7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液各取100 mL混合,置于暗处反应12 h,产生ABTS+,配置成ABTS+储备液,用无水乙醇将ABTS+溶液稀释,使其在734 nm波长条件下的吸光度为0.70±0.02。以VC为标准物质绘制标准曲线。用蒸馏水将酒液稀释100倍,取2支试管,1号管加入0.4 mL无水乙醇,再加入3.6 mL ABTS+工作液;2号管加入0.4 mL酒样待测液,再加入3.6 mL ABTS+工作液,混匀后2管均暗处反应10 min。以无水乙醇作为空白对照,在734 nm波长处测量吸光度。根据VC标准曲线回归方程,计算样品清除ABTS自由基的能力。
1.2.8 实验数理统计分析
实验至少重复3次,各指标均为3组平行,结果表示为平均值±SD,采用IBM SPSS Statistics 24软件对数据进行统计分析,采用Origin 8.5软件作图,相关性分析采用相关系数法,显著性界值为P<0.05,极显著界值为P<0.01。
2 结果与分析
2.1 桑葚酒在陈酿过程中主要理化指标分析
2.1.1 陈酿过程中酒精度的变化
不同菌株发酵的桑葚酒在陈酿过程中酒精度的变化情况如表1所示。KD发酵酒酒精度最高,为8.87%vol,D254发酵酒酒精最低,为7.49%vol。这可能是由于不同酵母自身代谢存在差异,利用发酵醪中营养成分的能力也有所不同引起的[12]。RC212和F15发酵酒在陈酿过程中酒精度的变化差异不显著,另外3株菌株发酵酒酒精度差异显著(P<0.05)。陈酿过程中酒精度减少的原因可能是:(1)乙醇与酸(主要有乙酸与乳酸)缓慢反应生成酯,增加酒的陈香;同时乙醇也可氧化成醛,醛再氧化成酸,为酯化创造了条件;(2)在陈酿贮存的过程中,乙醇会挥发逸走[13]。酒精度增加的原因可能是在陈酿的过程中总糖分解转化成乙醇[14]。
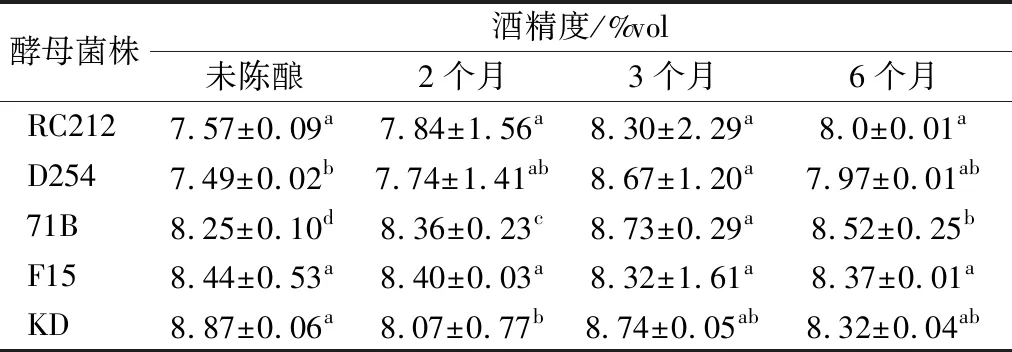
表1 不同菌株发酵的桑葚酒在陈酿过程中酒精度的变化
注:小写字母不同表示同一行之间差异显著(P<0.05)(下同)
2.1.2 陈酿过程中总糖的变化
由表2可知,发酵结束后,F15发酵酒总糖含量最高,为4.10 g/L,71B发酵酒总糖含量最低,为3.40 g/L,说明在酒精发酵的过程中,不同酵母转化糖的情况存在差异。在陈酿过程中,71B菌株发酵酒总糖含量的变化不显著,另外4株菌株发酵酒变化显著(P<0.05)。糖含量降低的原因在于桑葚酒贮存过程中糖转化为乙醇,或与氨基酸发生美拉德反应,生成葡萄糖酸,消耗部分糖,但受贮存条件如氧、温度的限制,该反应非常缓慢[13]。糖含量增加的原因可能是酒液在贮存过程中挥发逸出,浓度增加,也使糖分相应提高[14]。
2.1.3 陈酿过程中总酸的变化
不同菌株发酵结束后总酸的含量如表3所示,F15发酵酒总酸含量最高,为9.28 g/L,71B发酵酒总酸含量最低,为8.71 g/L,这和不同菌株代谢差异有关。在陈酿过程中,5株菌株发酵酒中总酸的含量均呈显著性变化(P<0.05)。陈酿过程中总酸含量增加的原因,一方面是由于酒的挥发造成桑葚酒体积的减少;另一方面是在陈酿过程中醛类物质会逐渐氧化而生成酸[13]。而总酸降低的原因可能是酒石酸沉淀引起的[15]。NY/T 1508-2017《绿色食品 果酒》规定,果酒中总酸的含量为4~9 g/L(以酒石酸计)[16],5株酵母菌株发酵的桑葚酒在陈酿过程中总酸含量部分超过了9 g/L,因此,在酿造过程中应进行降酸处理[17]。
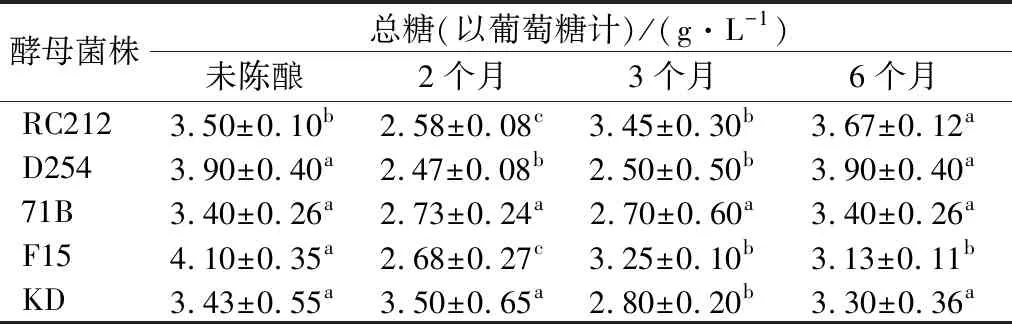
表2 不同菌株发酵的桑葚酒在陈酿过程中总糖的变化
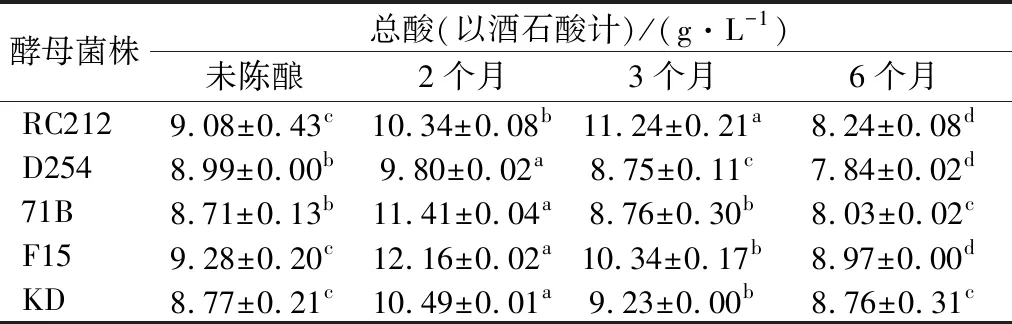
表3 不同菌株发酵的桑葚酒在陈酿过程中总酸的变化
2.2 桑葚酒在陈酿过程中抗氧化活性分析
2.2.1 陈酿过程中总酚含量的变化
总酚是对桑葚酒中的酚含量的综合评价。由图1可知,发酵结束时,RC212和71B发酵酒中总酚含量较高,分别为4.07 g GAE/L和3.69 g GAE/L。这可能是因为不同菌株适应桑葚发酵醪体系的能力不同,RC212和71B在发酵过程中,对打破整个体系平衡的能力和对具有抗氧化性物质的破坏能力较低,因此使得桑葚中原有的一些活性物质能够较好地保存下来[18]。刘寅[19]发现在发酵过程中,不同酵母对多酚物质的吸附作用不同;李蒙蒙等[20-22]认为,不同菌种的酶系组成会导致其酶解催化作用各异,溶出的酚类物质含量也有所差异。随着陈酿时间的延长,总酚浓度呈逐渐下降的趋势,这与欧燕等[22]的研究结果一致。当陈酿至6个月时,KD发酵酒中总酚浓度最高,为2.08 g GAE/L。这表明,在陈酿过程中,5株菌株对桑葚酒中总酚浓度下降速率影响不一致。陈酿过程中总酚浓度下降的原因可能是,单宁类等物质聚合、酚类物质氧化、微生物产生的酶促反应使多酚类物质发生降解,多酚类物质的水溶性下降,产生沉淀现象,也就是常说的酒脚,从而使桑葚酒中总酚浓度呈下降趋势[5,21-22]。
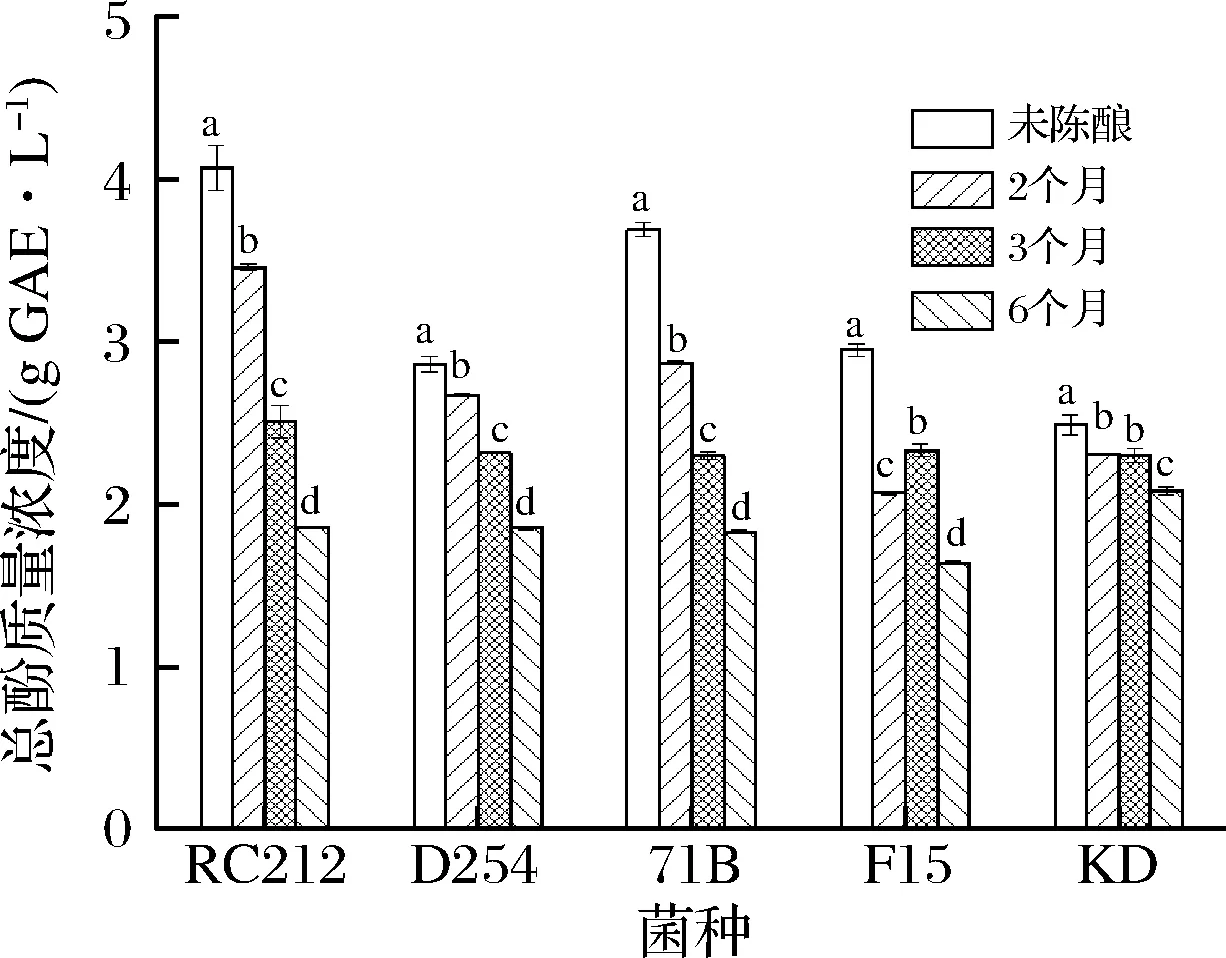
图1 酵母菌株和陈酿时间对桑葚酒中总酚含量的影响
2.2.2 陈酿过程中总花色苷含量的变化
花色苷是桑葚酒主要的呈色物质,对桑葚酒的感官品质和功能活性具有重要的影响。由图2可知,发酵结束时,71B菌株发酵酒中花色苷含量最高,为825.85 mg/L,菌株D254发酵酒中花色苷含量最低,为489.65 mg/L。这可能是不同菌株对花色苷的浸提作用不一致导致的,β-葡萄糖苷酶活力低的菌株发酵酒中花色苷含量较高,相反,β-葡萄糖苷酶活力高的菌株发酵酒中花色苷含量较低[23]。随着陈酿时间延长,花色苷的含量逐渐下降,这与房玉林等[6]、王宏等[24]的研究结果相似。SILVIA等[25]研究发现,葡萄酒在陈酿的过程中,游离花青素含量下降,花青素衍生物的含量增加。经过6个月的陈酿,菌株KD和D254发酵酒中花色苷含量相对较高,这表明,在陈酿过程中,不同菌株发酵酒中的花色苷下降的速率不一样。PERI等[26]发现,Kalecik karasi、Shiraz、Bogazkere、Okuzgozu葡萄酒在陈酿1~7年后总花青素含量降低了44%~88%(P<0.05)。总花色苷含量在陈酿过程中逐渐下降,可能是因为花色苷类间相互聚合或者同酒中的其他酚类物质相互聚合,进而形成了稳定的缩合单宁(即原花青素类),且酵母也会对果酒中的花色苷具有吸收作用,导致花色苷含量降低,与此同时,随着陈酿时间的增加,桑葚酒中的酸度值有所变化,花色苷的溶解受到影响并破坏各种花色苷间的平衡,多种因素的共同作用,导致花色苷含量下降[27]。
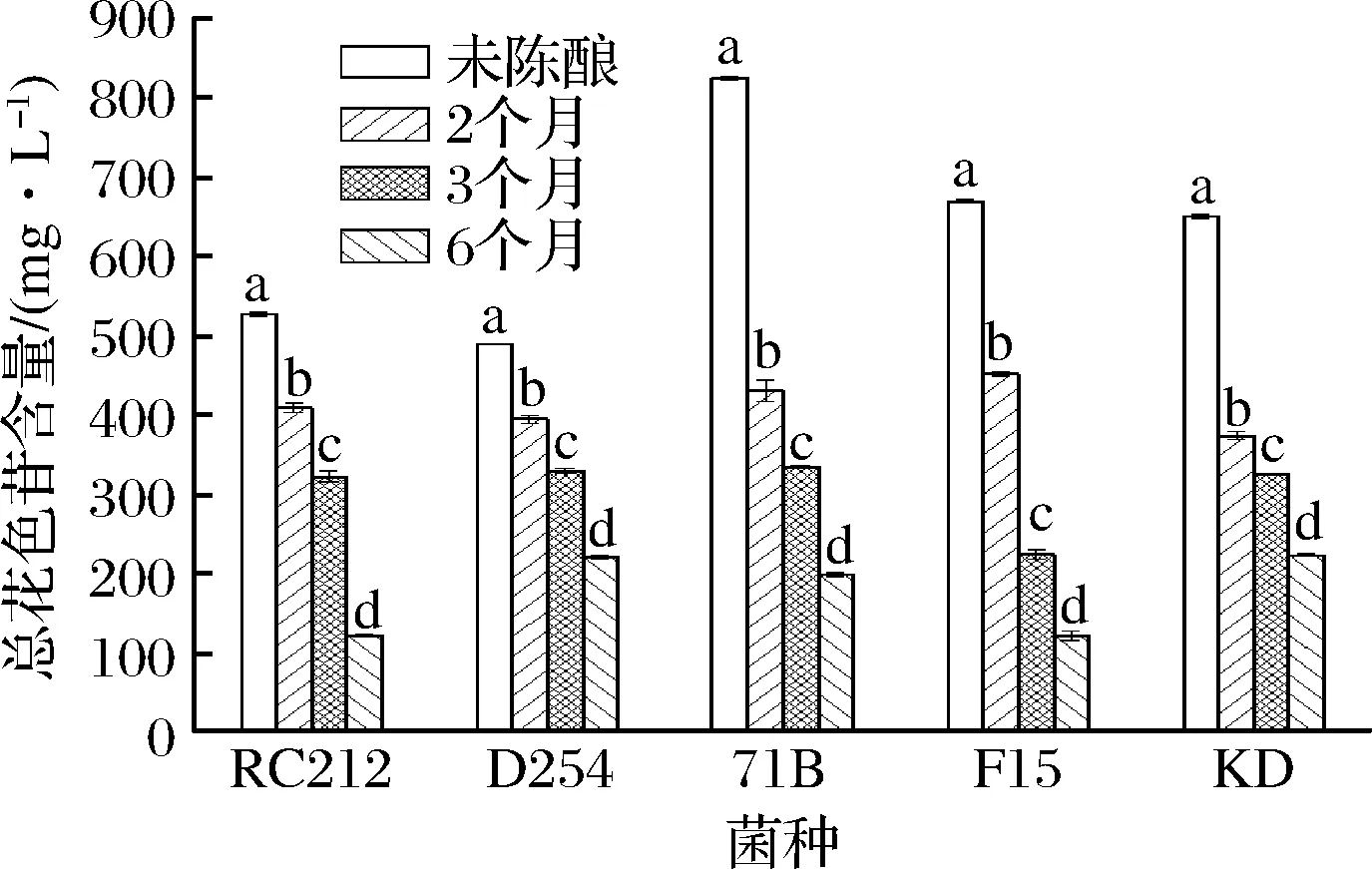
图2 酵母菌株和陈酿时间对桑葚酒中总花色苷含量的影响
2.2.3 陈酿过程中还原铁(ferric reducing ability of plasma,FRAP)能力的变化
天然化合物的抗氧化性与其还原能力具有一定的相关性,因此测定物质还原能力可反映它们的抗氧化性[28]。由图3可知,未陈酿的桑葚酒比陈酿后的桑葚酒还原铁能力强,其中菌株F15还原铁的能力最高,为3.51 g GAE/L,可能和不同菌株发酵酒中总酚和总花色苷的含量和种类不同有关。随着陈酿时间的延长,还原铁的能力逐渐下降,这与TSAI等[29]的研究结果一致,他们发现,桑葚酒陈酿12个月之后,FRAP能力从5 720 μmol/L降至4 630 μmol/L。在陈酿的第6个月,菌株KD发酵酒还原铁的能力最高,为2.48 g GAE/L,表明在陈酿过程中,不同菌株发酵酒还原铁的能力呈现不同程度的下降趋势。
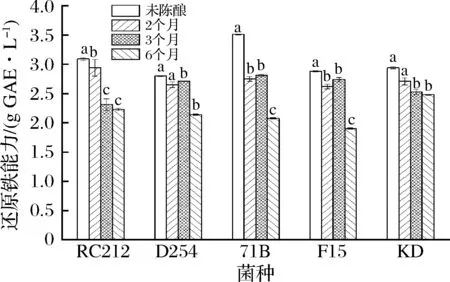
图3 酵母菌株和陈酿时间对桑葚酒还原铁能力的影响
2.2.4 陈酿过程中清除DPPH自由基能力的变化
DPPH自由基通过抗氧化化合物提供氢原子从而被还原[6]。对自由基的清除能力越强,表明酒体的抗氧化能力越强。由图4可知,F15菌株发酵结束后的桑葚酒清除DPPH自由基的能力最强,为2.16 g GAE/L。在陈酿至第6个月时,菌株RC212、D254、71B和F15发酵酒清除DPPH自由基的能力均低于发酵结束时的桑葚酒,而KD菌株发酵的桑葚酒清除DPPH自由基的能力有所上升。有报道表明,桑葚细胞壁在微生物酶的作用下解聚并释放出蛋白质、糖苷等植物胞内成分,一定程度上会影响其DPPH自由基清除能力[30]。
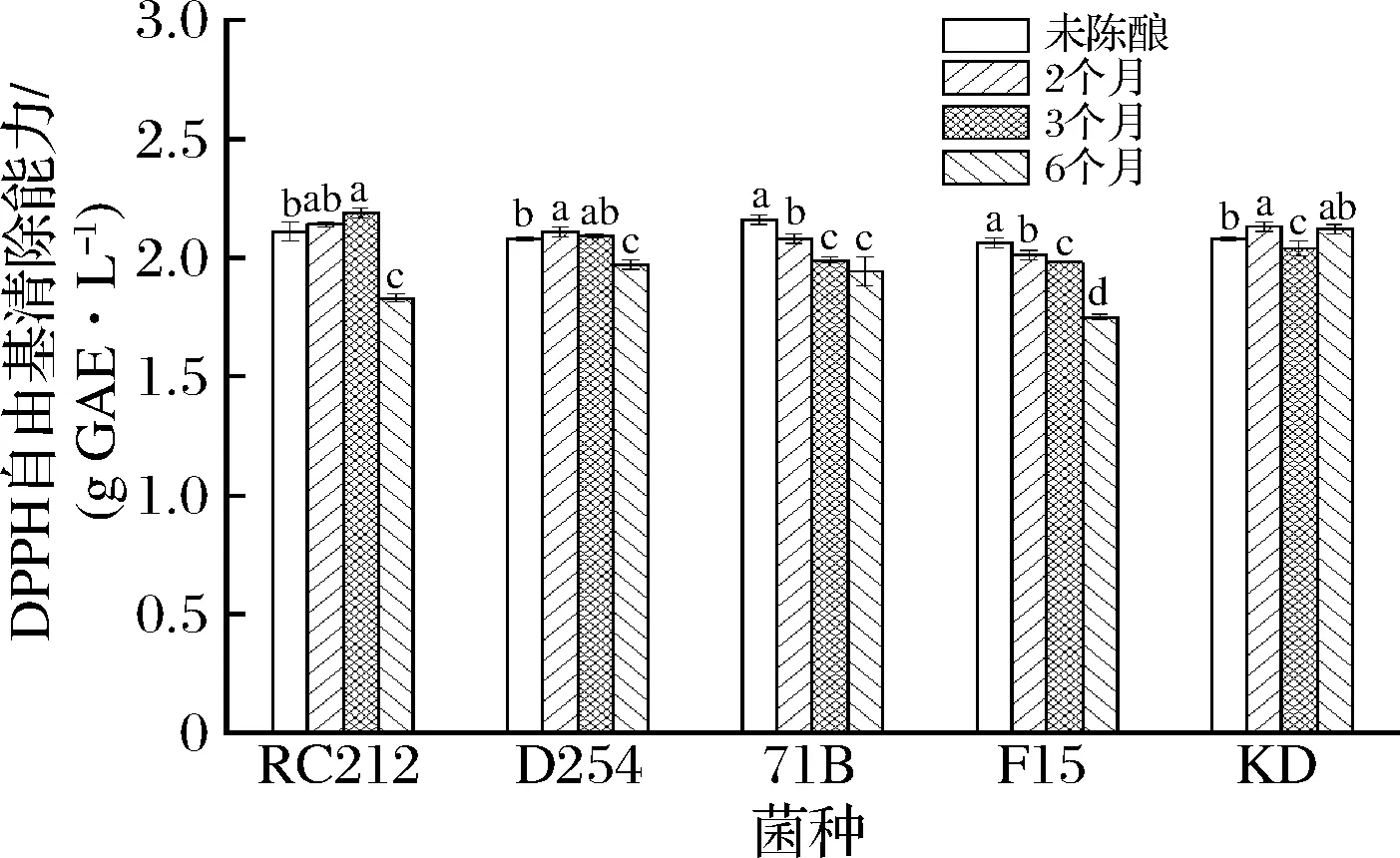
图4 酵母菌株和陈酿时间对桑葚酒清除DPPH自由基能力的影响
2.2.5 陈酿过程中清除ABTS自由基能力的变化
由图5可知,F15菌株发酵结束后的桑葚酒清除ABTS自由基的能力最强,为5.52 g VC/L,这与还原铁能力和DPPH自由基清除能力的测定结果一致。LIU等[21]研究了SF、SY、RW、D254和RC212五株菌株对发酵桑葚酒抗氧化活性的影响,发现D254和RC212清除ABTS自由基的能力分别为360.39和434.83 mg TE/100 mL,这与本研究相似。LI等[31]研究发现,CR476、JH-2、WLP77、RC212、RA17和BM4X4六株菌株发酵的猕猴桃酒中,RC212发酵的猕猴桃酒清除ABTS自由基的能力最强,并且总酚含量最高、清除DPPH自由基的能力也最强。随着陈酿时间的延长,各菌株发酵的桑葚酒清除ABTS自由基的能力逐渐下降,当陈酿至第6个月时,菌株KD发酵的桑葚酒清除ABTS自由基的能力最强,为4.25 g VC/L。
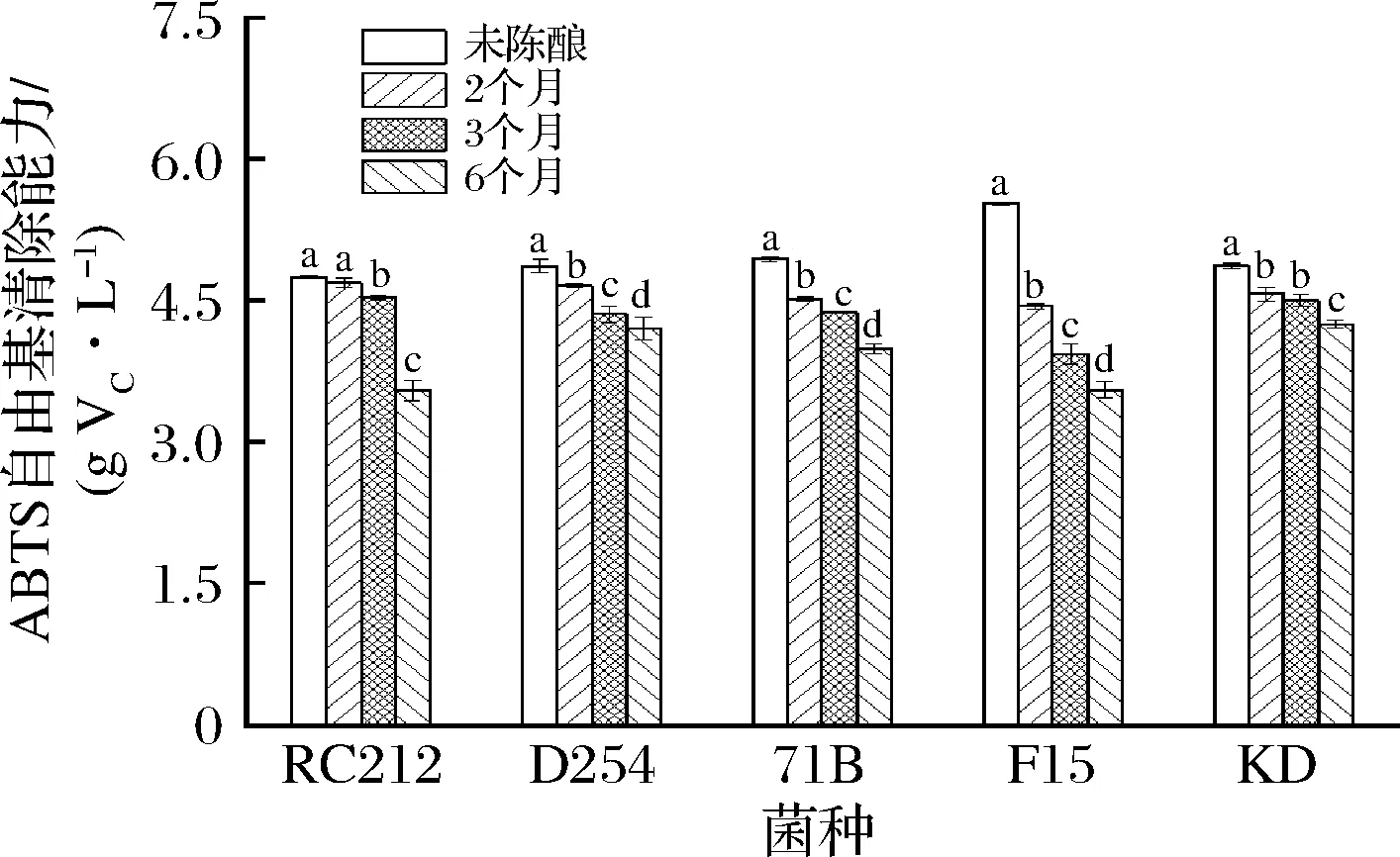
图5 酵母菌株和陈酿时间对桑葚酒清除ABTS自由基能力的影响
2.2.6 相关性分析
由表4可知,总酚、总花色苷、FRAP、DPPH和ABTS自由基清除能力5个指标两两均呈极显著的正相关(P<0.01)。焦扬等[8]发现果酒中多酚和总花色苷含量与ABTS自由基的清除率呈正相关,DPPH自由基的清除率与果酒中总花色苷的含量呈正相关,而总酚、总花色苷含量与FRAP均无显著性关系(P<0.05)。郭玉呈等[32]发现发酵柿子酒中的总酚含量与其清除ABTS自由基活性极显著正相关(r=1,P<0.01)。
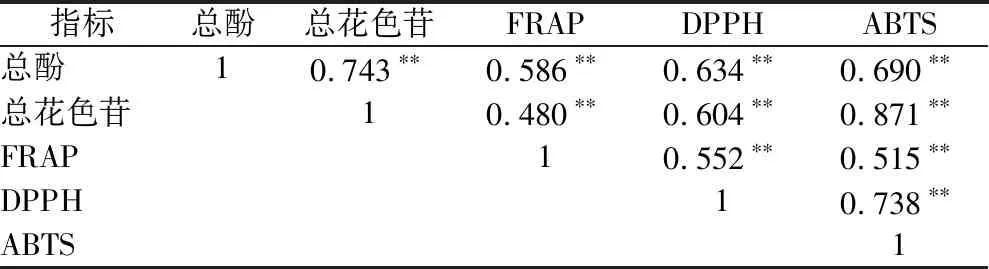
表4 活性物质含量与抗氧化能力的相关性
注:**表示在0.01级别(双尾)相关性显著
3 结论
酵母菌株和陈酿时间对桑葚酒的酒精度、总糖和总酸均有影响。在陈酿过程中,RC212和F15发酵酒酒精度变化不显著,D254、71B和KD变化显著(P<0.05);71B菌株发酵酒中总糖含量的变化不显著,RC212、D254、F15和KD变化显著(P<0.05);5株菌株发酵酒中总酸的含量均呈显著性变化(P<0.05)。
酵母菌株和陈酿时间对桑葚酒的抗氧化能力也有影响,酵母菌株对发酵醪的适应情况不同,对酒中抗氧化物质的破坏程度也不一样,导致酒体中的抗氧化能力存在差异。随陈酿时间的延长,桑葚酒中的总花色苷含量、FRAP、DPPH和ABTS自由基清除能力都有一定程度的降低,与总酚含量的变化趋势相似,说明桑葚酒陈酿时间越长,抗氧化能力越弱。由相关性分析可知,5个指标的相关性极显著(P<0.01)。5株酵母菌株中,71B和F15发酵酒抗氧化能力相对较高。
本实验比较了5株酿酒酵母和陈酿时间对桑葚酒的主要理化指标和抗氧化能力的影响,筛选出了发酵酒体抗氧化能力较优的菌株,明确了陈酿时间对桑葚酒抗氧化能力的影响规律,为桑葚酒的工业生产提供了理论依据。

