单核细胞增生李斯特菌感染对Bewo细胞炎症因子及迁移能力的影响
朱昱蓉,史 倩,卢 叶,凌 薇,袁 琳,杨诗娴,王蓓蕾,姜旭淦,陈盛霞
单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)简称单增李斯特菌,是一种革兰阳性胞内寄生杆菌,在2000年被WHO列为四大食源性致病菌之一[1]。临床上Lm感染率低,但致死率极高[2]。Lm可通过人体的3大屏障:血脑屏障,血肠屏障(肠道屏障)以及胎盘屏障,引起细菌性脑膜炎、细菌性肠胃炎、流产、死胎等疾病[1]。胎盘屏障主要由滋养层细胞、微血管内皮细胞以及两者之间的基底膜构成,是药物、病毒、细菌以及营养物质在胎儿与母体之间传递的必经之路[3]。其中,作为胎盘屏障第一道屏障的滋养层细胞直接与母体接触,在胎盘屏障中起重要作用。滋养层细胞向子宫的适度迁移对正常妊娠的维持起重要作用。滋养层细胞迁移受严格的时空限制,细胞异常迁移与流产、子痫和胎儿异常生长等病理状态的发生发展密切相关[4],其中基质金属蛋白酶(matrix metalloproteinase,MMPs)在调控滋养层细胞的侵袭迁移过程中起重要作用[5]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)参与细胞的增殖、分化、凋亡、炎症和转化等生理过程[6-8],是胞内外转导的关键环节,主要包括p38MAPK、ERK1/2及JNK等3条通路。研究表明,MAPK家族在胎盘屏障抵御外界病原体感染以及调控MMPs[9]的表达中发挥着重要作用。本文以胎盘滋养层细胞系Bewo细胞为模型,研究Lm感染引起滋养层细胞相关炎症反应及其对滋养层细胞迁移能力、迁移相关蛋白的影响,并对其机制进行研究,为Lm感染所致的流产等疾病提供理论基础。
1 材料与方法
1.1 材 料
1.1.1细胞与菌株 实验用单核细胞增生李斯特菌EGD株由天津医科大学申艳娜博士惠赠,胎盘滋养层细胞Bewo细胞购自中国典型培养物保藏中心(CCTCC)(武汉)。
1.1.2主要试剂 胎牛血清和F12-K培养基购自Gibco,脑心浸出液肉汤(BHI)购自北京路桥技术股份有限公司,PCR引物由上海生工合成,Trizol、逆转录试剂盒及荧光定量PCR试剂均购自南京Vazyme公司,MMP2、MMP9抗体购自美国CST公司,p38MAPK、p-p38MAPK、ERK1/2、p-ERK1/2、TIMP-1抗体购自万类生物,HRP标记的羊抗兔二抗、HRP标记的羊抗鼠二抗购自康为世纪,ECL显色液购自Millipore公司。
1.1.3主要仪器 二氧化碳细胞培养箱购自美国Thermofisher公司,恒温空气浴摇床购自福玛公司,普通PCR仪购自天能公司,荧光定量PCR仪购自美国ABI StepOnePlus公司, Western Blot电泳仪购自美国BioRad公司,Imge Quant LAS 4000 mini购自美国GE公司。
1.2 方 法
1.2.1Lm及Bewo细胞的培养 Lm接种于BHI培养液中,37 ℃ 250 r/min恒温空气浴摇床过夜培养。Bewo细胞接种于细胞培养瓶中,用含10%胎牛血清的F12-K培养基培养于37 ℃ 5% CO2培养箱中,4~5 d传代1次,传代时用含EDTA的0.25%胰酶消化5 min。
1.2.2Bewo细胞炎症因子检测 采用荧光定量PCR SYBR green法进行检测,相关引物序列见表1。Bewo细胞以5×105/孔接种于6孔板中,将过夜培养的Lm用灭菌PBS清洗2遍,调整至OD600=1.000(109CFU/mL),以感染复数(multiplieity of infection,MOI)=10感染Bewo细胞,共孵育1 h后加入庆大霉素杀灭细胞外细菌,杀菌0.5 h后换无抗生素的培养液培养。以加入细菌为计时起点,收集Lm感染1 h、3 h、6 h、12 h的细胞,用Trizol法提取RNA,逆转录成cDNA,实时荧光定量PCR法(qRT-PCR)检测IL-1β、IL-6、TNF-α的mRNA水平。结果分析采用相对定量分析方法,根据2-△△Ct值来确定基因的相对表达量。所有标本设置3个复孔并进行3次独立重复实验。

表1 炎症因子及MMP2转录水平检测用qRT-PCR引物Tab.1 Primers for qRT-PCR to detect the expression of inflammatory cytokines and MMP2
1.2.3Bweo细胞迁移能力的检测 划痕试验,六孔板中接种106个/孔细胞,次日,以MOI=10 Lm感染Bewo细胞。共孵育1 h后,用10 μL枪头垂直划线,PBS清洗3次,以去除漂浮细胞。以此时为计时起点,在0 h、6 h、9 h、12 h用倒置显微镜观察并拍照。Transwell试验,同1.2.2操作获得Lm感染的Bewo细胞,收集Bewo细胞,以无血清F12-K培养液重悬至5×105/mL。在小室上室接种200 μL Bewo细胞悬液,下室加30% F12-K培养液,培养24 h后取出小室,用4%多聚甲醛室温固定细胞,结晶紫染色,显微镜观察并拍照。Image-Pro Plus软件测量划痕宽度并计数小室细胞数。每组设置3个复孔并进行3次独立重复实验。
1.2.4Lm感染所致Bewo细胞功能改变的相关机制 同1.2.2操作方法收集Lm感染的Bewo细胞,常规方法提取细胞总蛋白,将各样本蛋白浓度调整一致后,用12% SDS-聚丙烯酰胺凝胶进行电泳,然后350 mA、90 min将蛋白转印至PVDF膜,5%脱脂牛奶封闭1 h,一抗4 ℃过夜孵育后,TBST洗膜,HRP标记的二抗室温孵育1 h,TBST洗膜后ECL显色,检测迁移相关蛋白MMP2、MMP9、TIMP-1的表达,以及MAPK家族蛋白p38MAPK及ERK1/2的表达及活化水平的变化。同时,用qRT-PCR检测MMP2转录水平的变化(引物见表1)。Image-Pro Plus软件进行蛋白灰度扫描分析。实验均进行3次独立重复实验。
1.2.5统计学分析 用GraphPad Prism6进行统计分析,两组间比较采用t检验(student’s test),多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1Bewo细胞炎症因子mRNA水平的改变 用qRT-PCR法检测Lm感染Bewo细胞1 h、3 h、6 h、12 h炎症因子(图1),结果表明,随着感染时间的延长,炎症因子IL-1β、IL-6和TNF-α的mRNA水平与1 h相比均增高,且均在3 h mRNA水平最高。
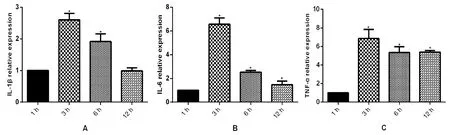
A: mRNA expression of IL-1β, B: mRNA expression of IL-6, C: mRNA expression of TNF-α;(*P<0.05)图1 Lm感染Bewo细胞炎症因子转录水平的变化Fig.1 Transcription levels of inflammatory cytokines in Bewo infected by Listeria monocytogenes
2.2Bewo细胞迁移能力的变化 用划痕试验和Transwell试验检测Lm感染Bewo细胞后对细胞迁移能力的改变,结果显示,Lm感染Bewo细胞后,划痕宽度随着时间延长变窄;Transwell试验结果显示Lm感染之后穿过小室的细胞增多,细胞的迁移能力增强(图2)。
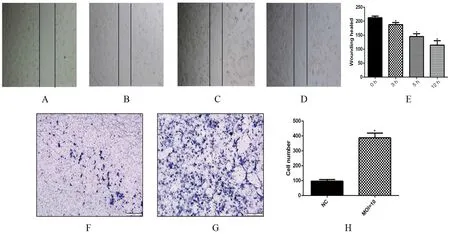
A: Wounding healing-0 h, B: Wounding healing-3 h, C: Wounding healing-6 h, D: Wounding healing-12 h, E: Scratch width, F: Transwell-Control, G: Transwell-MOI=10, H: Count of migration results;(*P<0.05)图2 Lm感染Bewo后迁移能力的变化Fig.2 Changes in migration ability of Bewo infected by Listeria monocytogenes
2.3Lm感染Bewo细胞MMPs的改变 Western Blot结果表明,随着Lm感染时间延长,MMP2蛋白水平升高;MMP9和TIMP-1表达水平先上升,随后下降(图3 A)。qRT-PCR检测MMP2在mRNA水平的变化,结果显示MMP2的mRNA水平先下降后上升(图3B)。
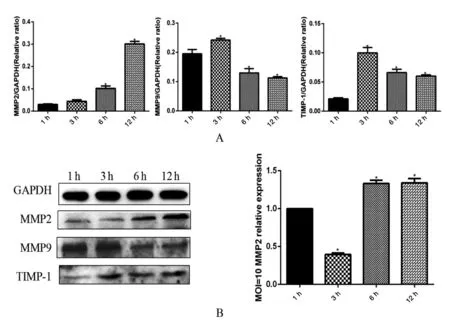
A: Protein expression of MMPs, B: mRNA expression of MMP2; (*P<0.05)图3 Lm感染Bewo细胞MMPs表达水平Fig.3 The expression levels of MMPs proteins in Bewo infected by Listeria monocytogenes
2.4Lm感染所致Bewo细胞功能改变的机制 Western Blot结果显示(图4),随着Lm感染时间的延长,p38MAPK及ERK1/2蛋白磷酸化的水平发生改变,p38MAPK随着感染时间的延长逐渐被激活,磷酸化水平呈上升趋势;ERK1/2随着感染时间的延长,磷酸化水平升高,在感染3 h达到高峰后稍有下降。
3 讨 论
Lm作为胞内寄生菌,可穿越机体3大屏障而致病[10-12]。虽然Lm感染率低,但致死率极高[13],因此对Lm致病机制的研究尤为重要。本研究主要探讨Lm感染对胎盘屏障的影响。胎盘屏障[14]是多种物质从母体进入胎儿的必经之路,其中滋养层细胞为屏障的最外层,在胎盘的形成、抵抗病原微生物的入侵以及妊娠识别都具有重要的作用[2]。 Bewo细胞的形态学特性和生化指标均与正常滋养细胞相同,Bewo 细胞作为体外模型常应用于滋养细胞功能的研究[15-16]。因此,本研究选用Bewo细胞为滋养层细胞模型,研究Lm感染与滋养层细胞之间的关系。
本研究发现,Lm感染Bewo细胞激活了炎症反应,细菌感染相关的炎症因子转录水平上调,与其他研究报道一致[11]。IL-1β、TNF-α、IL-6在细菌感染之后相继被激活,表明Lm成功感染Bewo细胞并产生抗感染免疫反应。有研究表明[17],外界病原体刺激胎盘相关细胞时,IL-6水平上升会导致流产,这提示单增李斯特菌感染所致的流产可能与炎症因子水平的升高相关,滋养层细胞可能参与炎症致流产的过程。我们通过划痕试验及Transwell试验发现,Lm感染会导致Bewo细胞迁移能力增强;Western Blot结果表明,Lm感染对Bewo细胞迁移能力的影响主要是由滋养层细胞基质金属蛋白酶MMP2、MMP9及相关的组织型基质金属蛋白酶抑制剂TIMP-1的变化所致。Lm感染导致Bewo细胞迁移能力增强,MMP2水平升高,MMP9水平先上升后稍有下降,说明MMP2在Lm感染引起的Bewo细胞迁移能力改变中发挥着重要作用;表达和分泌MMP9 的细胞可能是滋养层细胞以外的一些其他类型的细胞,如基质细胞、巨噬细胞等[18-20]。
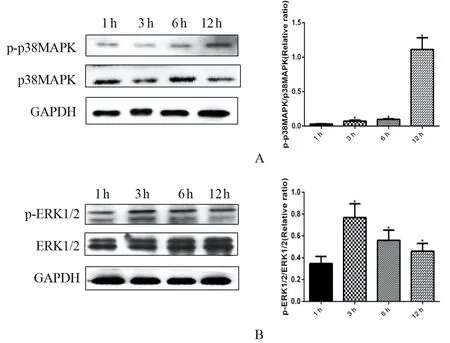
A: Protein expression of p-p38MAPK, p38MAPK; B: Protein expression of p-ERT1/2, ERK1/2;(*P<0.05)图4 Lm感染Bewo细胞 p38MAPK、ERK1/2表达水平的变化Fig.4 Expression levels of p38MAPK、ERK1/2 in Bewo infected by Listeria monocytogenes
已有研究表明,MAPK家族蛋白p38MAPK及ERK1/2参与抗感染免疫的发生并对细胞侵袭迁移能力具有调控作用[21]。因此我们检测了MAPK家族p38MAPK及ERK1/2活化水平,结果表明Bewo细胞在Lm感染后p38MAPK及ERK1/2被不同程度的激活。我们推测MMP9在6 h和9 h的改变可与ERK1/2通路的激活相关,这与陈升平等[19]的报道一致。
综上所述,Lm感染Bewo细胞导致Bewo细胞炎症反应的发生,细胞p38MAPK及ERK1/2通路被激活,同时基质金属蛋白酶的表达亦增高,Bewo细胞迁移功能增强。我们推测Lm感染激活Bewo细胞炎症反应以及细胞迁移能力的变化可能是通过p38MAPK及ERK1/2通路实现的,但p38MAPK以及ERK1/2在Lm感染所致Bewo细胞炎症因子及迁移能力变化中的具体作用仍需进一步研究。本研究为进一步明确Lm的致病机制、开发有效的预防治疗药物奠定了基础。
利益冲突:无
引用本文格式:朱昱蓉,史倩,卢叶,等.单核细胞增生李斯特菌感染对Bewo细胞炎症因子及迁移能力的影响[J].中国人兽共患病学报,2020,36(2):94-99. DOI:10.3969/j.issn.1002-2694.2020.00.032

