从血管内皮生长因子及其受体调控角度探讨地黄梓醇促血管新生作用及分子机制研究
周霞,张文倩,刘炬,李丽,刘付红,刘炳男
研究表明,神经保护剂在临床上未达到理想的治疗效果[1],但其促使神经血管单元(neurovascular unit,NVU)成为缺血性损伤新的治疗方向并受到临床广泛关注[2]。NVU 由LO 等于2002 年提出,指由神经元、微血管、星形胶质细胞及其轴突和其他支持细胞共同组成的复合体,是神经系统的结构和功能单位[3]。神经元的修复必须依赖能量,而微血管网络是能量输送的基础,这可能是单纯应用神经保护剂未达到理想治疗效果的症结所在。基于此,临床上提出了通过促进缺血后病灶区血管新生及微循环网络重建而保护NVU 的构想。血管内皮细胞既是微血管的基本结构,又具有复杂的代谢及内分泌功能。血管内皮生长因子(vascular endothelial growth factor,VEGF)是促血管生长因子,可诱导血管内皮细胞增殖、迁移及局部毛细血管新生等;此外,其还是一个多效性神经保护因子,具有促进脑源性神经营养因子(brain derived neurotrophic factor,BDNF)分泌[4]、抗凋亡[5]及促进轴突生长、神经再生、迁移等作用[6]。因此,通过调控VEGF、促进微血管新生可保护NVU的主要成分[7]。
地黄是治疗中风经典方剂中的常用药,如地黄饮子(宋·《圣济总录》)、大秦艽汤(金·刘完素《素问病机气宜保命集》)等。梓醇是地黄的主要有效成分,以生地黄含量最高。既往采用地黄梓醇干预局灶性脑缺血大鼠模型的实验发现,干预后大鼠脑缺血周围区皮质微血管数量明显增加,提示地黄梓醇具有促血管新生作用[8-9],但其具体机制尚未明确。笔者所在课题组前期研究结果显示,脑出血急性期采用生地注射液治疗有助于神经功能恢复,尤其对阴虚风动型脑出血效果更明显[10]。本研究旨在从VEGF 及其受体调控角度探讨地黄梓醇促血管新生作用及分子机制,现报道如下。
1 材料与方法
1.1 细胞培养 实验时间为2019 年4—8 月,人脐静脉 内 皮 细 胞(human umbilical vein endothelial cells,HUVECs)购自中科院上海细胞库。在含有1%双抗、10% DMEM 的培养基中培养HUVECs,培养箱温度设置为37 ℃恒温,二氧化碳(CO2)含量为5%。
1.2 主要试剂与仪器 梓醇购自上海源叶科技有限公司(纯度≥98%,分子量为362.33),以终浓度为1 mg/ml的梓醇溶液作为神经保护最佳浓度[11];VEGF、血管内皮生长因子受体1(VEGFR-1)、血管内皮生长因子受体2(VEGFR-2)引物购自铂尚生物技术(上海)有限公司,兔抗VEGF(AF5131)、兔抗VEGFR-1(H00002321)、兔抗VEGFR-2(92006)及兔抗GAPDH(14C10)购自Affinity biologicals 公 司,VEGFR-1、VEGFR-2 抗 体 购自Abcam 公司,MTT 试剂盒购自索莱宝公司,RNA 提取试剂盒(Qiagen)购自天根生化科技(北京)有限公司,RNA 反转录cDNA 试剂盒(Applied Biosystems)及ViiA ™ 7 Real-Time PCR System(Applied Biosystems)购自赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 MTT 法 采用MTT 法检测细胞增殖能力,具体如下:将对数期HUVECs 以1×105ml 的密度接种于96 孔板中,细胞长至60%~70%后更换不含血清的培养基并分别加入0.9%氯化钠溶液(对照组)、梓醇溶液1 mg/ml(实验组)继续培养。24 h 后向待测孔中加入MTT 溶液5 mg/ml,4 h 后向每孔加入二甲基亚砜(DMSO),摇床振荡10 min 后在490 nm 波长下测量每孔吸光度值(OD 值),并计算细胞相对增殖率。
1.3.2 细胞迁移实验 采用细胞迁移实验检测细胞迁移能力,具体如下:将HUVECs 均匀接种于6 孔板中,铺板前在板的背面用记号笔划5~6 道平行的横线,细胞长至80%~90%后采用无菌200 μl 枪头管尖(约0.7 mm)在各培养板相同位置划垂直或平行直线,与以上横线垂直,造成几条“伤口”。之后采用磷酸盐缓冲液(PBS)清洗2 次,去除被枪头管尖破坏而脱落的细胞并拍照,然后更换不含血清的培养基并分别加入0.9%氯化钠溶液(对照组)、梓醇溶液1 mg/ml(实验组)进行处理,培养0、12、24 h 后观察细胞迁移情况,并计算100 倍显微镜下4 个独立视野中超过划线的细胞数,实验重复3 次并取平均值。
1.3.3 实时荧光定量聚合酶链反应(qRT-PCR) 分别采用0.9%氯化钠溶液(对照组)、梓醇溶液1 mg/ml(实验组)干预HUVECs 36 h,之后采用qRT-PCR 检测VEGF、VEGFR-1、VEGFR-2 mRNA 表达情况,具体如下:分别采用RNA 提取试剂盒和RNA 反转录cDNA试剂提取RNA 及合成cDNA,采用ViiA ™ 7 Real-Time PCR System 进行qRT-PCR 分析。95 ℃ 30 s,95℃ 10 s、60 ℃ 32 s 重复40 个循环,将GAPDH 作为内参计算目的基因相对表达量,qRT-PCR 重复3 次并取平均值。VEGF、VEGFR-1、VEGFR-2 及GAPDH 引物序列见表1。

表1 VEGF、VEGFR-1、VEGFR-2 及GAPDH 引物序列Table 1 Primer sequences of VEGF,VEGFR-1,VEGFR-2 and GAPDH
1.3.4 免疫印迹法 qRT-PCR 后采用免疫印迹法检测VEGF、VEGFR-1、VEGFR-2 蛋白表达情况,具体如下:(1)提取蛋白:采用4 ℃预冷的PBS 冲洗细胞2 次,根据培养面积不同加入一定体积的0.1% SDSRIPA 裂解液及100 μM PMSF,其中RIPA:PMSF 比例为100:1,将其静置于冰上15 min,然后将细胞裂解液转移至1.5 ml EP 管中反复吹打。4 ℃环境下13.8×g 离心15 min,收取上清液并提取细胞总蛋白质。(2)采用BCA 法检测蛋白浓度。(3)蛋白变性:向蛋白质样品中加入一定体积的上样缓冲液,95 ℃环境下加热5 min使蛋白变性。(4)电泳:将蛋白质加入聚丙烯酰胺凝胶点样孔,并于80 V 恒压下电泳约30 min,然后在120 V恒压下电泳约60 min,当有色染料移至聚丙烯酰胺凝胶末端时停止电泳。(5)转膜:配制1×转膜液,制作转膜“三明治”结构,280 mA 恒流转膜合适时间。(6)封闭:采用5%脱脂牛奶室温封闭1.5 h,封闭完成后采用TBS-T 缓冲液洗涤15 min,共洗涤3 次。(7)抗体孵育:采用抗体稀释液按比例配制一抗工作液,4 ℃孵育过夜,第2 天孵育二抗。(8)显影:将PVDF 膜浸入ECL 发光液中进行显影和分析,采用Image J 软件定量分析蛋白,目的蛋白相对表达量=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.4 统计学方法 应用SPSS 17.0 统计学软件进行数据处理,计量资料以(± s)表示,多组间比较采用单因素方差分析,组间两两比较采用q 检验,两组间比较采用成组t 检验,组内比较采用配对t 检验。检验水准α=0.05。
2 结果
2.1 地黄梓醇对HUVECs 增殖能力的影响 对照组HUVECs 的OD 值 为(0.366±0.103),低 于 实 验 组的(0.674±0.135),差异有统计学意义(t=7.12,P=0.04);与对照组相比,实验组HUVECs 相对增殖率为(1.871±0.152)%。
2.2 地黄梓醇对HUVECs 迁移能力的影响 以培养0 h为对照,实验组HUVECs 培养12、24 h 迁移细胞数量多于对照组,差异有统计学意义(P<0.05);两组HUVECs 培养24 h 迁移细胞数量均多于培养12 h,差异有统计学意义(P<0.05,见表2)。
表2 两组HUVECs 培养12、24 h 迁移细胞数量比较(±s)Table 2 Comparison of number of migrating cells between the two groups 12,24 hours after culture

表2 两组HUVECs 培养12、24 h 迁移细胞数量比较(±s)Table 2 Comparison of number of migrating cells between the two groups 12,24 hours after culture
?
2.3 地黄梓醇对HUVECs VEGF 及其受体表达的影响 两组HUVECs VEGFR-1 的mRNA 及蛋白相对表达量比较,差异无统计学意义(P>0.05);实验组HUVECs VEGF、VEGFR-2 的mRNA 及蛋白相对表达量均高于对照组,差异有统计学意义(P<0.05,见图1~2)。
3 讨论

图1 两组HUVECs VEGF 及其受体mRNA 相对表达量比较Figure 1 Comparison of relative mRNA expression quantity of VEGF and its receptors between two groups
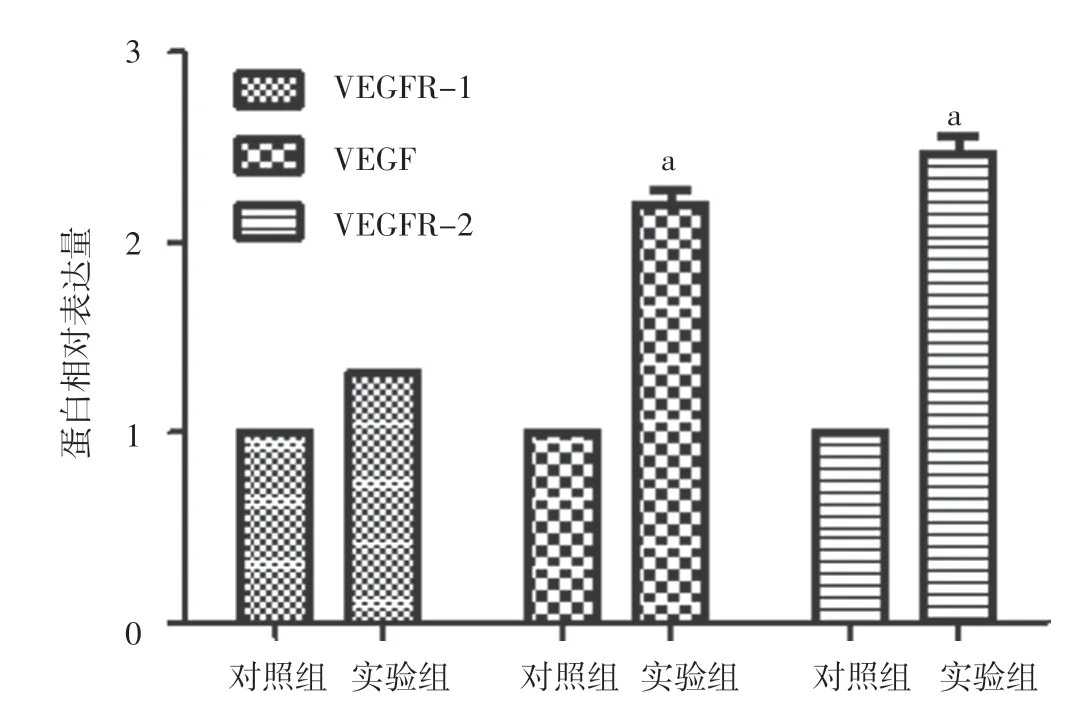
图2 两组HUVECs VEGF 及其受体蛋白相对表达量比较Figure 2 Comparison of relative protein expression quantity of VEGF and its receptors between the two groups
美国神经疾病和脑卒中研究院曾指出,在细胞、分子、基因层面研究脑卒中后NVU 的变化及其机制将为缺血后脑保护研究提供新的方向,但NVU 作为一个功能单位,因细胞间存在大量信号传导及对话而使研究者较难找准研究的切入点。笔者所在课题组认为脑缺血后微血管网络重建与神经结构网络重构在结构和功能上密切相关,其中血管新生是微循环重建的主要途径。
血管新生包括内皮细胞激活、增殖及迁移等一系列过程,其中内皮细胞迁移是血管新生的必要环节。VEGF 可作用于血管内皮细胞表面相应受体并激活相关转导通路,进而促进血管新生,但其配体及受体类型较多,既往研究表明,血管生产效应主要与两个酪氨酸激酶结合有关,即VEGFR-1 和VEGFR-2[6]。尽管与VEGFR-1 相比,VEGFR-2 与VEGF 结合能力较弱,但VEGF/VEGFR-2 激活的细胞信号级联反应仍是VEGF信号通路的主要生物学效应[8],因此VEGFR-1 常被认为是假受体[12]。
生地黄是祖国医学中治疗中风的主要药物之一,现代研究表明其主要有效成分梓醇具有一定神经保护作用[11,13]。《神农本草经》明确记载,“生地味甘寒,主折跌绝筋、伤中、逐血痹。……而除痹生者尤良。”但后世不常用其“活血生新、逐血痹”之功效。正如近代医家张山雷在《本草正义》中记载:“惟唐宋以降,破血逐瘀诸方,已无复采用及此者”,张山雷认为:“地黄……,惟破血一层,似乎寒凉粘滞性质必无破瘀导滞之功,误认为其腻滞物质而遂疑古人之言”[14]。药理学研究表明,生地黄炮制成熟地黄的过程主要为梓醇逐减及糖类递增,且梓醇随着炮制、加热程度加深而逐渐分解或丢失[15-16]。因此,笔者认为生地黄具有活血生新功效,其中梓醇是体现其“活血生新”功效的有效成分[17]。
现代医家认为,“生新”包括“生新血”和“生新脉”两方面,其中“生新脉”具有促血管新生、微循环重建等内涵。本研究结果显示,对照组HUVECs 的OD值低于实验组,且与对照组相比,实验组HUVECs 相对增殖率为(1.871±0.152)%,提示地黄梓醇能有效提高HUVECs 增殖能力;以培养0 h 为对照,实验组HUVECs 培养12、24 h 迁移细胞数量多于对照组,提示地黄梓醇能有效提高HUVECs 迁移能力,进而促进血管新生。本研究结果还显示,两组HUVECs VEGFR-1 的mRNA 及蛋白相对表达量间无统计学差异,但实验组HUVECs VEGF、VEGFR-2 的mRNA 及蛋白相对表达量均高于对照组,提示地黄梓醇通过特异性上调VEGF 及VEGFR-2 表达而发挥促血管新生作用,这也从分子生物学层面阐示了地黄“活血生新”功效的内涵:地黄梓醇通过调控VEGF 和VEGFR-2 靶向性结合而促进血管新生。
综上所述,地黄梓醇通过上调VEGF、VEGFR-2表达而促进HUVECs 增殖、迁移,进而发挥促血管新生作用,但VEGF 与VEGFR-2 结合后如何激活下游因子及受哪种上游因子调控尚未明确,仍有待课题组进一步探究。
作者贡献:周霞、张文倩进行文章的构思与设计,负责文章的质量控制及审校;张文倩、刘炬、李丽进行研究的实施与可行性分析;张文倩、刘炳男进行数据收集、整理、分析;周霞、张文倩、刘付红负责撰写论文;周霞对文章整体负责,监督管理。
本文无利益冲突。

