1例男性乳腺癌患者的临床特征及基因突变分析*
杨晓晨,张颂文,周沁,胡韬,邵启祥
(1.江苏大学附属昆山医院甲乳外科,江苏昆山215300;2.江苏大学医学院免疫学教研室,江苏镇江 212013;3.江苏省检验医学重点实验室,江苏镇江212013)
男性乳腺癌是一种罕见的恶性肿瘤,其发病率约占所有乳腺癌的1%[1]。研究表明,超过10%的男性乳腺癌由已知的乳腺癌易感基因胚系突变引起。其中,BRCA2基因胚系突变具有最高的已知风险[2-3]。BRCA2是遗传性乳腺/卵巢癌综合征的致病基因之一,胚系突变携带者发生乳腺癌、卵巢癌和前列腺癌等肿瘤的风险显著增加[4]。
研究表明,约20%~30%的结直肠癌具有家族性,其中约5%~10%患者与已知的遗传综合征有关[5]。Lynch综合征是由DNA错配修复基因胚系突变引起的最常见的遗传性结直肠癌综合征,突变基因携带者对结直肠癌及其他一些肿瘤易感[5]。本研究对1例异时性男性乳腺癌和结肠癌患者进行全面的基因突变分析,旨在明确病因,为临床指导风险管理和个体化治疗提供依据。
1 研究对象与方法
1.1研究对象 患者,男,52岁,因“发现右乳肿块6个月,增大1个月”就诊。查体:于右乳头外侧乳晕旁可触及直径约1.5 cm肿块,质硬,边界清,活动可,局部皮温不高,乳头无溢液,无橘皮征;查乳腺B超(图1A)示:右乳乳头旁实质性团块。于2017年3月13日行右乳肿块切除术,术中冰冻切片示:右乳浸润性癌,遂改行右乳癌改良根治术,术后病理(图1B、1C)示:右乳浸润性导管癌,送检腋下淋巴结(2/11)见癌转移。免疫组化染色示:雌激素受体(estrogen receptor,ER)++,孕激素受体(progesterone receptor,PR)+++,人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)+,增殖指数Ki67+10%。术后给予表柔比星+环磷酰胺序贯多西他赛方案化疗8程,后口服“他莫昔芬”,随访至今无复发及转移。既往史:患者于2010年3月6日行“乙状结肠癌根治术”,术后病理(图1D)示:中分化腺癌,侵及深肌层,淋巴结无转移,术后予Folfox4方案化疗8疗程。于2014年7月及2015年8月复查肠镜时分别发现直肠和结肠多发息肉,予内镜下治疗,病理提示良性。近期复查肠镜未见明显异常。有“高血压”病史。家族史:患者母亲72岁时行“乙状结肠癌根治术”,目前健在。先证者父亲因脑出血已死亡,哥哥、姐姐和2位侄子目前健在。家系图谱见图2A。本研究通过江苏大学附属昆山医院医学伦理委员会审核批准(批准号:2016-03-001-K01),所有研究对象均知情同意。
1.2主要仪器及试剂 Qubit 3.0荧光计(美国Thermo公司);Covaris S220超声破碎仪(美国Covaris公司);MGIEasy外显子组捕获V4探针试剂套装和BGISEQ-500测序仪(华大基因公司);5417R低温台式离心机(德国Eppendorf公司);PTC-200 PCR扩增仪(美国Bio-Rad公司);DYY-8C电泳仪(北京六一仪器厂);UV-IV紫外分析仪(北京市新技术应用研究所);ABI 3730XL型DNA测序仪(美国ABI公司);TIANamp Genomic DNA提取试剂盒(北京天根生化公司);Ex Taq DNA聚合酶(大连TaKaRa公司)。
1.3方法
1.3.1基因组DNA提取 分别采集先证者及其家系成员外周血各2 mL于乙二胺四乙酸盐抗凝管中,按照TIANamp Genomic DNA Kit试剂盒说明书操作提取基因组DNA,经50 μL TE缓冲液洗脱。用Qubit 3.0荧光计检测DNA样本的浓度和纯度,取浓度在50~200 ng/μL,吸光度(A260/280 nm)在1.8~2.0的样本用于后续实验,DNA样本置于-80 ℃保存。
1.3.2全外显子测序与候选基因筛选 用超声波降解法将1 μg基因组DNA随机打断成150~250 bp的片段,在片段两端加接头,进行文库构建。使用MGIEasy外显子组捕获V4探针对带接头的片段进行杂交捕获,捕获的片段采用BGISEQ-500测序平台进行高通量信息采集。将测序获得的原始数据通过BWA和参考基因组hg19进行比对,以SOAPsnp、SAMtools、GATK软件分析突变及变异,包括对单核苷酸多态性(single nucleotide polymorphisms,SNPs)和小的插入或缺失突变(insertions or deletions,InDels)进行检测、注释和统计分析。根据美国医学遗传学与基因组学学会指南[6]对变异进行致病性判断。如果变异具有截短、起始密码子或剪接供体/受体作用,或者已在基因突变相关数据库如乳腺癌信息中心(breast cancer information core,BIC)数据库(https://research.nhgri.nih.gov/bic/)、ClinVar数据库(http://www.nibc.nlm.nih.gov/clinvar)和人类基因突变数据库(human genemutationdatabase,HGMD)中报道,或者在已发表的文献中证实为致病性,则将其分类为致病性或可能致病性变异。应用dbSNP数据库、千人基因组数据库、ESP外显子组数据库和炎黄基因组数据库对数据进行过滤,将等位基因频率大于0.01的变异视为良性或可能良性的变异。剩余的变异则视为意义不明确的变异。对于意义不明确的变异,利用生物信息分析工具(包括SIFT、PolyPhen2)对其功能进行预测。同时,对于致病性或可能致病性变异,结合家系临床特征进一步筛选确定候选突变位点。
1.3.3Sanger测序验证 采用Sanger测序技术验证候选突变位点在先证者及其家系成员中的表型共分离情况。采用NCBI中的Primer-BLAST对BRCA2基因c.6402_6406delTAACT(p.Asn2134fs)(NM_000059.3)突变位点进行在线引物设计,由华大基因公司合成,正向引物序列:5′-TTCATCTGCTTTCTCTGGATTT-3′,反向引物序列:5′-TGTTCTTTTCCCAAAACATGAA-3′。PCR反应体系为30 μL,包括DNA 1 μL,10×PCR buffer 3 μL,dNTP(2.5 mmol/L)2 μL,上、下游引物(10 μmol/L)各1 μL,Taq酶(5 U/μL)0.2 μL,ddH2O补足至30 μL。采用降落PCR进行扩增,扩增条件:94 ℃预变性3 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,10个循环(每个循环退火温度降低1 ℃);94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共30个循环;终延伸10 min。采用PTC-200 PCR扩增仪扩增,产物经10 g/L琼脂糖凝胶电泳进行检测,将纯化后的PCR产物送华大基因公司,采用ABI 3730XL型DNA测序仪进行Sanger测序分析,测序片段序列(5′→3′):AAAGTTAAGGGAGTGTTAGAGGAATTTGATTTAATCAGAACTGAGCATAGTCTTCACTATTCACCTACGTCTAGACAAAATGTATCAAAAATACTTCCTCGTGTTGATAAGAGAAACCCAGAGCACTGTGTAAACTCAGAAATGGAAAAAACCTGCAGTAAAGAATTTAAATTATCAAATAACTTAAATGTTGAAGGTGGTTCTTCAGAAAATAATCACTCTATTAAAGTTTCTCCATATCTCTCTCAATTTCAACAAGACAAACAACAGTTGGTATTAGGAACCAAAGTGTCACTTGTTGAGAACA,测序峰图采用Chromas软件编辑。
2 结果
2.1全外显子测序结果 先证者目标区域平均测序深度为182.04×,目标区域覆盖度达99.73%,其中测序深度达到10×以上的区域占全部芯片目标捕获区域的98.26%。共获得120 270个SNPs和22 730个InDels突变位点,经过滤后共筛选出43个致病性或可能致病性突变位点(表1)。结合患者临床特征,进一步数据分析发现在BRCA2基因第11号外显子的c.6402_6406delTAACT(p.Asn2134fs)(NM_000059.3)缺失突变,该突变位点为5个碱基缺失形成的移码突变,造成终止密码子提前出现,引起翻译提前终止,蛋白质氨基酸序列发生改变,导致蛋白质截短。该突变位点在BIC数据库(https://research.nhgri.nih.gov/bic/)和ClinVar数据库中均有报道,为乳腺癌的致病性突变。结合临床综合分析,最终确定该突变为先证者乳腺癌的致病突变位点,而在其他乳腺癌相关易感基因(包括DNA错配修复基因)中未发现致病性突变。
2.2Sanger测序验证结果 先证者在BRCA2基因第11号外显子上存在c.6402_6406delTAACT(p.Asn2134fs)(NM_000059.3)杂合突变(图2B),其儿子同样携带该杂合突变,而其患有结肠癌的母亲则未携带上述突变(图2C、2D)。

注:A,先证者右乳肿块超声图像;B,先证者乳腺癌组织病理标本;C,先证者淋巴转移组织病理标本;D,先证者结肠癌组织病理标本。
图1 先证者肿瘤的超声及病理结果(×200)
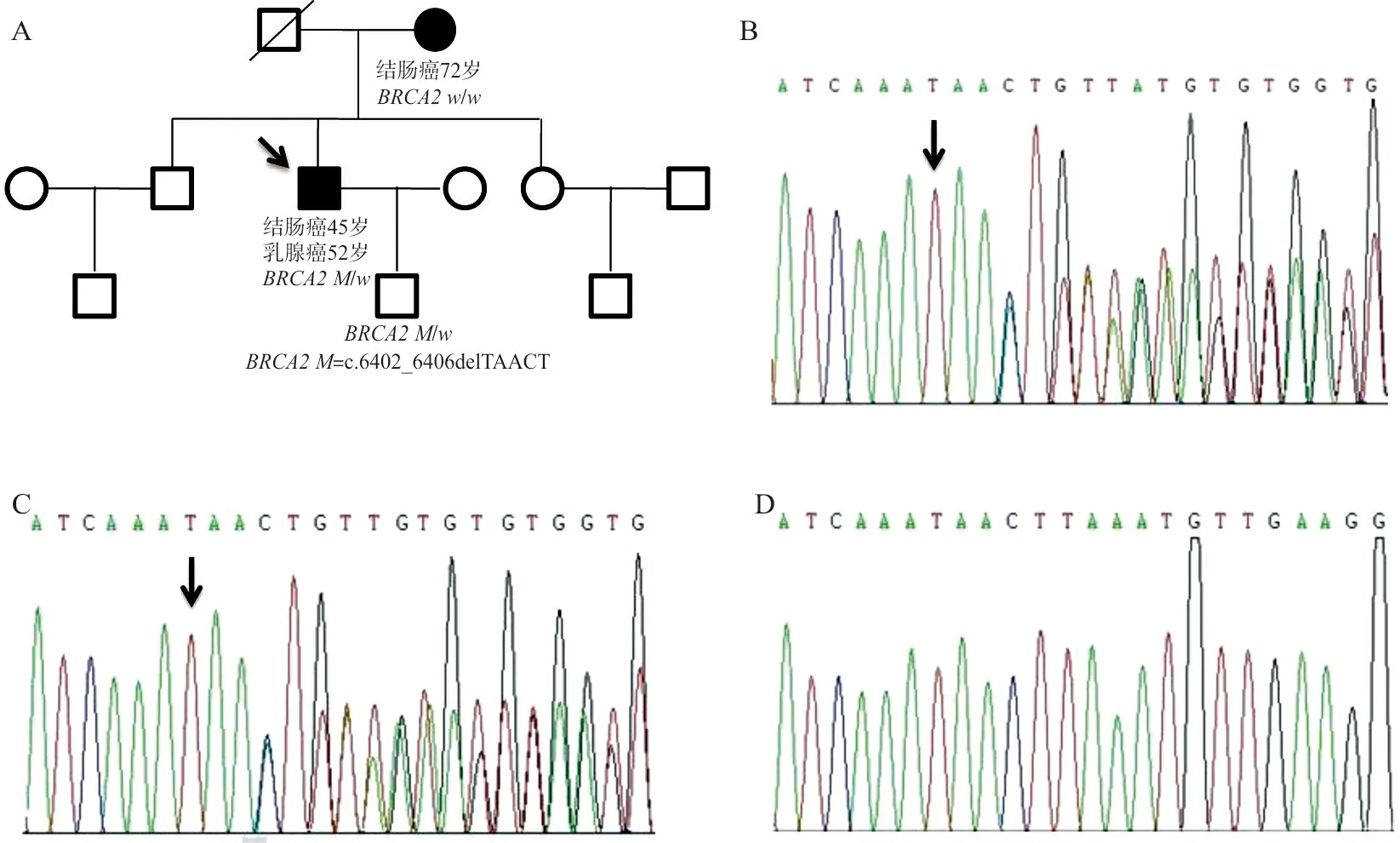
注:A,携带BRCA2c.6402_6406delTAACT突变的家族系谱;箭头示先证者;B,先证者携带BRCA2c.6402_6406delTAACT杂合突变;C,先证者儿子携带BRCA2c.6402_6406delTAACT杂合突变;箭头所指处为突变位点;D,先证者母亲未携带上述突变。
图2 该家族系谱及Sanger测序结果
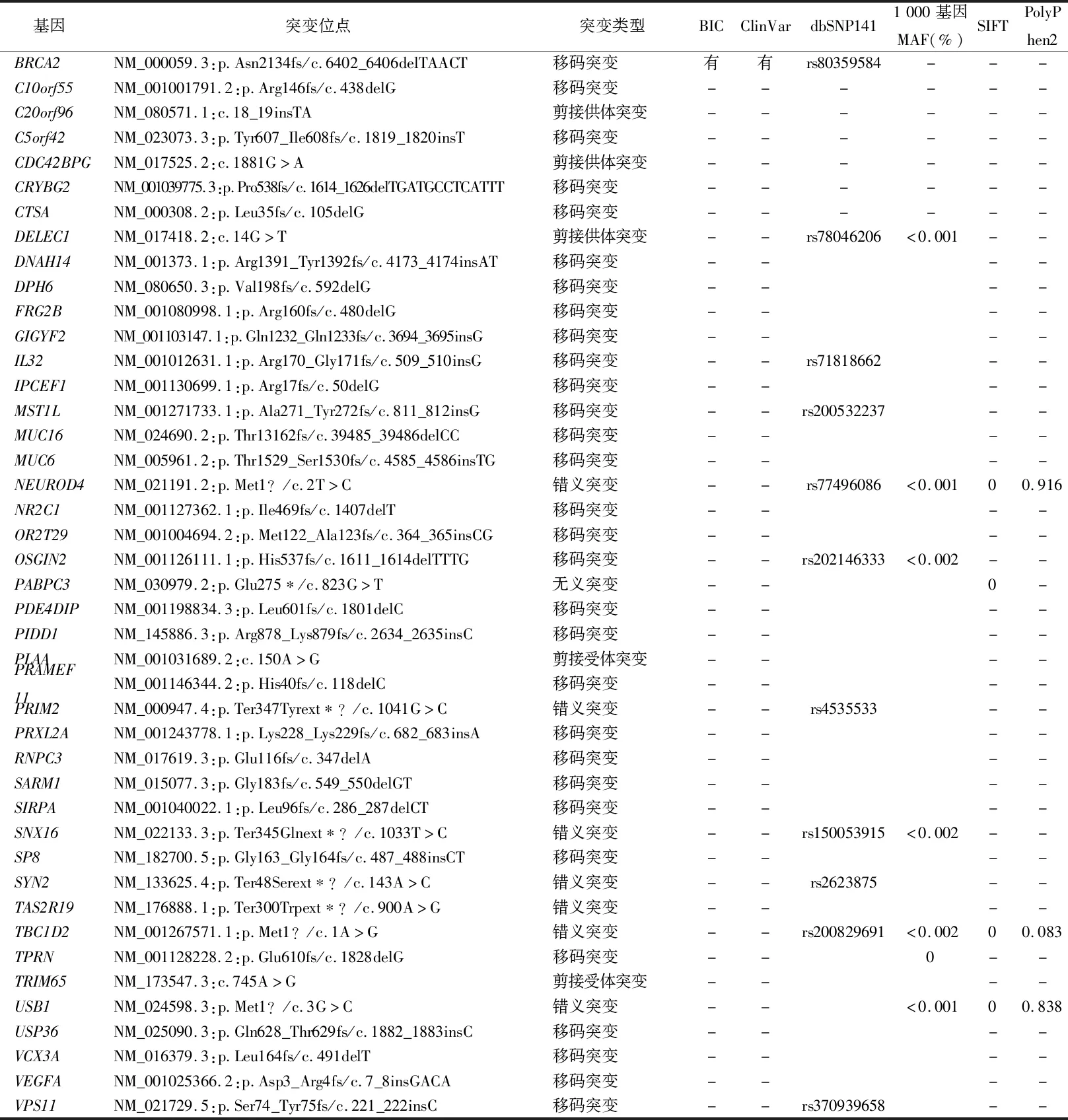
表1 该先证者全外显子测序筛选出的致病性或可能致病性突变位点
注:BIC,乳腺癌信息中心;MAF,最小等位基因频率;-表示无数据。
3 讨论
遗传性肿瘤综合征使个体发生多种肿瘤的风险显著增加,且发病早,多数呈常染色体显性遗传。因此,早发现、早干预和早治疗对降低发病率和死亡率至关重要。BRCA1和BRCA2是高外显性的乳腺癌易感基因,此外还有20余个乳腺癌相关易感基因[7-8]。Rizzolo等[2]应用二代测序技术对523例男性乳腺癌患者的50个肿瘤相关基因进行了胚系突变检测,发现近9%的患者携带致病性突变,其中,BRCA2突变最多,此外,还发现BRCA1、PALB2、ATM、CHEK2、RAD51D和APC等15个基因发生突变。Scarpitta等[3]对81例男性乳腺癌患者的24个DNA损伤修复基因进行了胚系突变检测,也发现BRCA2突变率最高;此外,还存在BRIP1、MUTYH和PMS2基因突变。本研究在1例乳腺癌伴异时性结肠癌的男性患者中发现的BRCA2c.6402_6406delTAACT(p.Asn2134fs)缺失突变为已知突变,该突变是由Gayther等[9]首先在1个家族性乳腺癌家系中发现,之后在乳腺癌和卵巢癌人群中均有报道[10-12]。该突变位于BRCA2基因第11号外显子的卵巢癌群集区域,该区域突变的个体卵巢癌发病率远高于该区域外的突变[9]。本例先证者的家族史仅为母亲患有结肠癌,并无乳腺癌或卵巢癌患者,我们推测可能与家系样本较小且女性较少有关。
本例家系的临床表现符合Lynch综合征的临床诊断标准,且全外显子组测序发现BRCA2胚系缺失突变,而无其他DNA错配修复基因的致病性突变,因此确认先证者乳腺癌的致病基因为BRCA2。目前尚未证实BRCA2胚系突变可增加结肠癌的风险,故而无法肯定先证者结肠癌与此有关,但根据患者和其母亲的测序结果,我们推测先证者及其母亲所患结肠癌为散发,先证者的致病基因可能来自父系。
流行病学调查结果表明,有男性乳腺癌家族史的男性个体,其乳腺癌、前列腺癌等肿瘤的风险显著增加,且发病年龄早。美国国立综合癌症网络(National comprehensive cancer network,NCCN)指南建议其应当接受遗传咨询及基因检测,并从35岁开始进行乳房自我检查,每年进行一次临床乳房体检,从40岁开始进行前列腺癌的筛查。本案例中,先证者的儿子经测序确认为健康BRCA2基因胚系突变携带者,通过今后的干预可最大限度增加其早期诊治的概率。
综上所述,外显子测序技术在遗传疾病诊断中具有良好的应用价值,本研究应用Sanger测序技术明确了1例男性乳腺癌的致病基因,也为临床遗传咨询、早期干预和诊疗提供了实验依据。

