线叶菊黄酮滴丸抗耐青霉素金黄色葡萄球菌感染及免疫调节实验研究*
马睿婷 ,兰耀东 ,包思成 ,王来兵 ,乔俊缠 **,渠 弼 **
(1. 内蒙古医科大学附属医院 呼和浩特 010050;2. 内蒙古医科大学药学院 呼和浩特 010110;3. 包钢第三职工医院 包头 014010)
金黄色葡萄球菌(Staphylococcus aureus,SA)是临床上最常见的产毒素和酶最多致病菌之一,在葡萄球菌中毒力最强,尤其是耐甲氧西林金黄色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA),具有多重耐药性,居院内感染首位。1991年,黄文玉等[1]就筛选了27 种中药对MRSA 的作用,发现大多数中药对SA和MRSA有一定的抑制作用,但是作用强度不一致。中医历来以清热解毒治疗许多急性感染性疾病,因此筛选有效抗MRSA的中药引起了国内中医药工作者的关注。
线叶菊[Filifolium sibiricum (L.)Kitam.]是菊科线叶菊属多年生草本植物,在临床上可用于传染病高热、疔疮痈肿、血瘀刺痛、月经不调、臁疮、心悸、失眠等症[2-4]的治疗,亦可用于治疗慢性支气管炎[5]、肾盂肾炎[6]和各种化脓性感染[7]。研究结果表明,线叶菊的抗菌有效成分主要是黄酮类化合物[8],其对耐青霉素金黄色葡萄球菌、福氏志贺菌、表皮葡萄球菌、金黄色葡萄球菌等均有明显的抑制作用[9]。我们以线叶菊黄酮为原料,利用现代科学技术和方法将其制成滴丸[10,11]。为了给线叶菊黄酮滴丸的临床应用提供基础资料,本实验对其进行了抗MRSA 和抗SA 感染及免疫调节作用的初步研究,未见相关报道,具有一定的创新性,得到的研究成果有望能为开发新的抗MRSA、SA 的中药新药提供基础数据以供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 药品与试剂
线叶菊黄酮滴丸(由赤峰天奇制药有限责任公司提供,批号:20170701)总黄酮含量约为15%,按照实验要求将其用0.5%羧甲基纤维素钠配成所需要浓度的混悬液;阿莫西林胶囊(修正药业集团股份有限公司,批号:160801);营养琼脂粉(上海伊华医学科技有限公司,批号:200120905);营养肉汤粉(北京三药科技开发公司生产中国药品生物制品鉴定所监制,批号:150222);羧甲基纤维素钠(常州市海拓实验仪器有限公司。批号:4014806);胃膜素(江苏普华克胜药业有限公司,批号:20151003);吉姆萨—瑞特染色液(北京诺博莱德科技有限公司,批号:c0352);PBS(北京索莱宝科技有限公司,批号:20150228);甲醛(天津市科盟化工工贸有限公司,批号:20111125);无钙镁无酚红的D-Hank’s 液(北京索莱宝科技有限公司,批号:20150525);贞芪扶正颗粒(吉林敖东药业集团延吉股份有限公司,批号:J20170614)。
1.1.2 菌种
ATCC-25923 金黄色葡萄球菌(中国食品药品检定研究院);耐青霉素金黄色葡萄球菌,由内蒙古医科大学第一附属医院检验科提供,密封保存。
1.1.3 实验动物
SPF 级昆明小鼠,雌雄各半,体质量20±2 g,由内蒙古医科大学研究动物中心提供,动物合格证号:SCXK(蒙)2015-0001,动物饲养于内蒙古医科大学实验动物中心SPF 级动物房;喂养饲料为SPF 级实验用鼠颗粒饲料(江苏省协同医药生物工程有限责任公司,批号:20170826)。
1.1.4 仪器
单人双面净化工作台(SW-CJ-1F,苏州净化设备有限公司);标准型分析天平(AB135-S,梅特勒-托利多仪器(上海)有限公司);移液枪(Ependorf,德国艾本德有限公司);隔水式恒温培养箱(PYX-DHS-35,上海医疗器械七厂);型蒸汽消毒器(YXQG02,山东新华医疗科技有限公司);麦氏比浊管(中国药品生物制品检定所);电热恒温鼓风干燥箱(GZX-9070MBE,上海博讯公司);离子纯水机(DZG-303A,美国摩尔公司);离心机(YDL5M,湘仪离心机厂)。
1.2 小鼠急性毒性试验
取120只禁食不禁水12 h的小鼠,雌雄各半,随机分为6 组,每组20 只,即0.5%羧甲基纤维素钠空白滴丸组、线叶菊黄酮滴丸1、2、3、4、5 组。线叶菊黄酮滴丸1 组按总药量(即滴丸药粉浓度)0.4 g·mL-(1最大浓度)、0.04 mL·g-1小鼠体重(最大体积),灌胃1 次,计算1 日内给药量,0.5%羧甲基纤维素钠空白滴丸组灌胃等体积的0.5%羧甲基纤维素钠空白滴丸溶液。将剂量组间比定为1:0.7。每笼5 只灌胃给药后正常饲养。给药0-2 h,每15 min观察1次;给药后2-4 h,30 min观察1次;给药后4-8 h,1 h观察1次;给药后8-24 h,4 h 观察 1 次;从第 2 天起,每天观察 1 次。称取体重,观察各小鼠的动度进食、饮水情况及14天内可能出现的动度、异常肌肉运动、对外反应、瞳孔改变、异常分泌物、大小便异常、眼球凸出、眼睑下垂、呼吸异常、皮肤颜色改变等的毒性反应和死亡情况。若有小鼠死亡,则将死亡小鼠解剖,肉眼观察心、肝、脾、肺、肾、脑、胃、小肠等脏器的改变。
1.3 抑菌试验
1.3.1 菌液制备
将原菌种接种于普通琼脂培养基上,连续传代2次。取新鲜的菌胎采用密集划线法转接在普通琼脂培养基平皿中,将接种后的平皿放入37℃恒温培养箱,培养24 h,随后将5 mL 灭菌的肉汤培养基倒入普通琼脂培养基上,用灭菌的接种环洗脱菌胎,制备成菌液,将该肉汤菌液转入到无菌的试管中,放入4℃保存备用。
1.3.2 金黄色葡萄球菌的制备
取按照2.2.1方法制备的金黄色葡萄球菌液10 μL溶于5 mL 的生理盐水中与0.5 麦氏比浊管比浊,得出该菌液的浓度为5 × 108。按照标准比浊后的标准指数,将原菌液稀释成为1×109,待用。
1.3.3 耐青霉素金黄色葡萄球菌的制备
取按照2.2.1 方法制备的耐青霉素金黄色葡萄球菌液70 μL 溶于5 mL 的生理盐水中与0.5 麦氏比浊管比浊,得出该菌液的浓度为5×108。按照标准比浊后的标准指数,将原菌液稀释成为1×109,待用。
1.3.4 体外抑菌试验
取10 支灭菌且配有棉塞的试管,1-10 号每管先加入无菌肉汤培养基2 mL,然后在第1 管中加入配好浓度的灭菌受试药物2 mL,混匀后用吸取2 mL 放入第 2 管中,依次稀释到第 8 管,取出 2 mL 弃用;第 9 管不加药物加2 mL 空白滴丸溶液,作为阳性对照;第10管中加受试药物2 mL 混匀,不加细菌,取出2 mL 弃去,作阴性对照。
将肉汤培养6-8 h 的实验菌液(耐青霉素金黄色葡萄球菌和金黄色葡萄球菌),用无菌肉汤将菌液稀释成1×10-3。取0.1 mL 分别加入1-9 管中混匀,放入37℃孵箱中孵育16 - 18 h。18 h 后,第9 管细菌生长溶液浑浊(阳性对照),第10 管无细菌生长呈透明状(阴性对照),在此基础上,观察其它试管的细菌生长情况。
1.3.5 体内抑菌试验
(1)分组
健康SPF 级昆明小鼠120 只,雌雄各半,按体重随机分为受耐青霉素金黄色葡萄球菌感染和受金黄色葡萄球菌感染的线叶菊黄酮滴丸高、中、低剂量组,空白滴丸组,模型组和阿莫西林组,各6组。模型组给予生理盐水,空白滴丸组给予溶于0.5%的羧甲基纤维素钠的空白滴丸溶液10 g·(kg·天)-1,阿莫西林组给予0.1 g·(kg·天)-1,高、中、低剂量组分别给予 16、8、4 g·(kg·天)-1的线叶菊黄酮滴丸羧甲基纤维素钠溶液。
(2)死亡保护率的测定
将不同密度的菌的混悬液分别腹腔注射于体重20±2 g 的昆明种小鼠,每个密度组 6 只,每只 0.5 mL,观察小鼠72 h 内的死亡情况,选用引起小鼠近100%死亡的菌液浓度进行药物防治试验。由预实验得出浓度在1×109时小鼠的死亡率达到90%。故以此细菌的浓度给各组小鼠进行腹腔注射,每只0.5 mL。于注射菌液的前一天及注射菌液后的0、6、12、24 h 治疗组和阿莫西林组灌胃给药,模型组给0.5%的羧甲基纤维素钠空白滴丸溶液,观察72 h。计算死亡率和死亡保护率。(死亡率=死亡动物数/动物总数,死亡保护率=1-死亡率)
1.3.6 免疫试验
(1) 分组及给药方式
取昆明种小鼠60 只,按体重随机分为模型组、空白滴丸组、阳性对照组(贞芪扶正颗粒)及线叶菊黄酮滴丸的高、中、低剂量组,每组10 只,共6 组。每天灌胃给药1次,模型组给予生理盐水,空白滴丸组给予溶于0.5%的羧甲基纤维素钠的空白滴丸溶液10 g·(kg·天)-1,阳性对照组给予贞芪扶正颗粒3 g·(kg·天)-1,高、中、低剂量组分别给予16、8、4 g·(kg·天)-1的线叶菊滴丸,连续灌胃给药21天。
(2)鸡血红细胞的制备
成年雄鸡,取抗凝的鸡血10 mL,加入50 mL 生理盐水,离心洗涤 3 次,前两次离心 5 min,1000 r·min-1,第三次离心 10 min,1000 r·min-1,弃上清,制成压积血。吸压积血2 mL 加入198 mL 生理盐水中混匀,制备1%鸡红细胞悬液。
(3)小鼠外周血液T淋巴细胞转化试验
在21 天给药结束后,取小鼠尾部末梢血制片,晾干经甲醛固定细胞后,用吉姆萨-瑞特染色4 min,随后滴加PBS 液6 min,用大量水冲洗,晾干,封片。40倍油镜下计数,达100个淋巴细胞后,计算淋巴细胞转化率(淋巴细胞转化率=过渡型母细胞/100 淋巴细胞数)。
1.3.7 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
在21 天给药及小鼠尾部末梢取血7 h 后,每只小鼠腹腔注射1%鸡红细胞悬液0.5 mL,轻揉腹部,30 min后将小鼠脱颈椎处死,剖开腹腔,加3 mL 无钙镁的Hangk's液,轻揉1 min,吸取腹腔液约2.5 mL于离心管离心,500 r·min-1,3 min;弃上清,吸取 200 μL 滴于玻片上,涂抹均匀,晾干用甲醛固定。吉姆萨-瑞特染色4 min 后,加PBS,反应6 min,用大量水清洗。在40倍油镜下观察,计算吞噬百分率。
1.4 统计学方法
2 结果与分析
2.1 小鼠急性毒性
小鼠急性毒性试验按0.04 mL·g-1小鼠体重灌胃给药1 次,对照组给予同体积0.5%羧甲基纤维素钠空白滴丸溶液灌胃。在24 h 内,仅线叶菊黄酮滴丸1 组有1只小鼠出现抽搐、腹泻、毛色不顺滑最终死亡的现象,死亡小鼠尸检主要器官肉眼未见病理改变。其余各组没有小鼠死亡。在随后的14天连续观察,无一小鼠死亡。第15 天将其余小鼠解剖未见异常。因此不需测定LD50,改为测定MTD。根据线叶菊黄酮滴丸各组的给药剂量,计算其MTD 值得16 g·kg-1。小鼠灌胃给药16 g·kg-1相当于70 kg的成人24 h 内食用121.1g的线叶菊黄酮滴丸。相当于临床成人用药的100倍。上述研究结果表明该线叶菊黄酮滴丸属于实际无毒(≥ 5000 mg·kg-1)药物。

表1 体外抑菌试验结果

表2 线叶菊黄酮滴丸对感染金葡菌和耐药金葡菌小鼠的保护作用
2.2 体外抑菌试验
采用试管法进行的体外抑菌试验结果表明,从未生长细菌的各管内吸取0.1 mL 培养物,接种于琼脂平板培养基上,恒温培养24 h,观察有无细菌生长,培养基中无细菌生长的最低浓度即为线叶菊黄酮滴丸的最低杀菌浓度。线叶菊黄酮滴丸对金黄色葡萄球菌的药物浓度比例为1∶8,即最低抑菌浓度为12.5 mg·mL-1;对耐青霉素金黄色葡萄球菌的药物浓度比例为1∶16,即最低抑菌浓度为6.25 mg·mL-1。说明线叶菊黄酮滴丸在体外抗耐青霉素金黄色葡萄球菌的效果良好(表1、图1)。
2.3 体内抑菌试验
24 h后感染了金黄色葡萄球菌、耐青霉素金黄色葡萄球菌的模型组的小鼠全部死亡。继续观察至72 h,其余小鼠并未出现死亡(表2)。
体内抑菌试验结果从表2 可以看出,线叶菊黄酮滴丸高、中、低剂量组均对感染金黄色葡萄球菌和耐青霉素金黄色葡萄球菌的小鼠有保护作用,且中剂量组优于高剂量和低剂量组,阿司匹林组对金黄色葡萄球菌感染的小鼠有较高的保护作用,但对耐青霉素金黄色葡萄球菌基本无保护作用,故线叶菊黄酮滴丸对感染金黄色葡萄球菌和耐青霉素金黄色葡萄球菌的小鼠具保护作用。
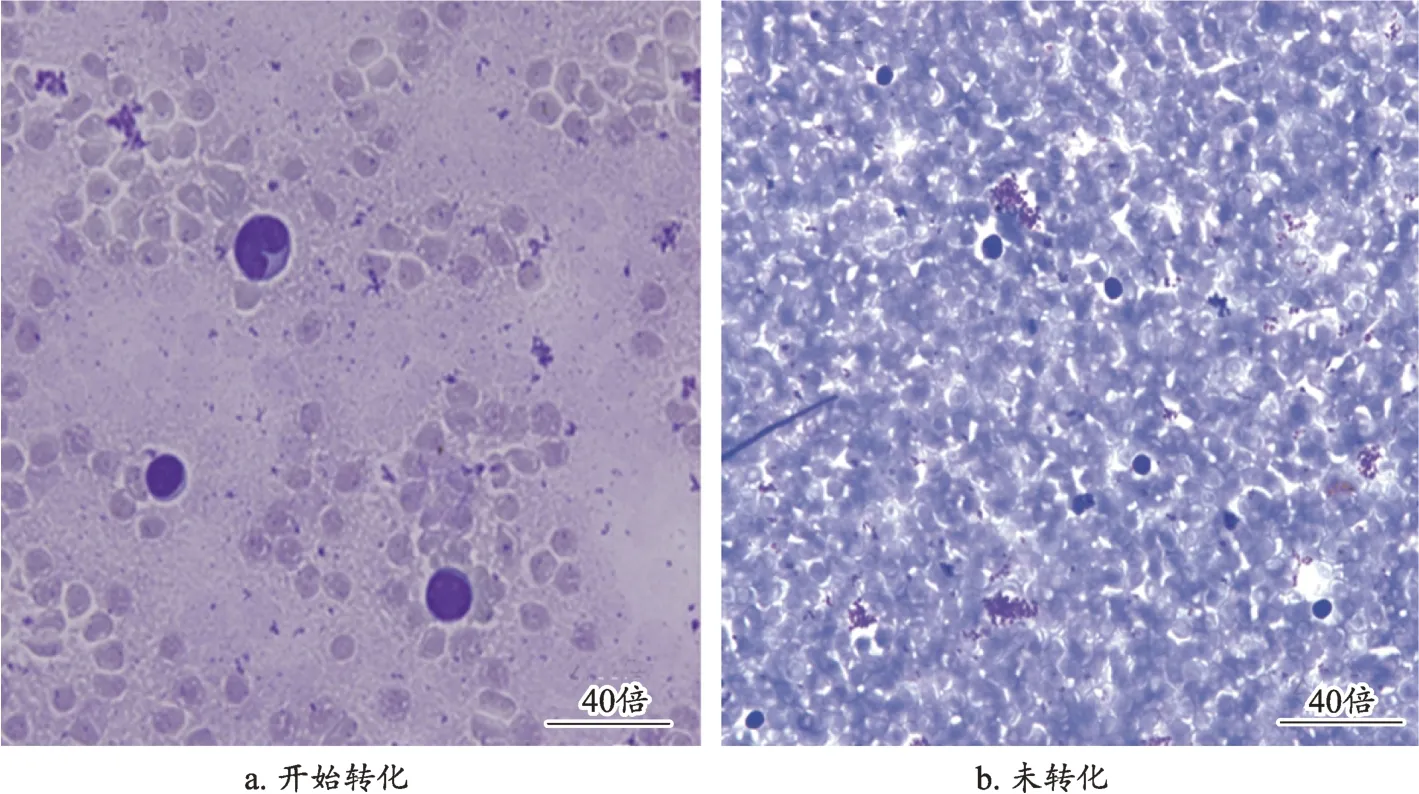
图2 T淋巴细胞转化和未转化对比图
2.4 免疫试验
小鼠外周血液T淋巴细胞转化和巨噬细胞吞噬鸡红细胞经吉姆萨-瑞特染色后40 倍油镜下观察,结果见图2、图3。小鼠的外周血液淋巴细胞转换率和腹腔巨噬细胞吞噬率的结果见表3、表4。线叶菊黄酮滴丸高剂量组和阳性对照组优于线叶菊黄酮滴丸的低剂量组(P<0.05),中剂量组与低剂量组比较差异不显著,线叶菊黄酮滴丸高、中、低剂量组与模型组差异显著(P<0.05),表明线叶菊黄酮滴丸具有提高免疫的作用。
表3 线叶菊黄酮滴丸对小鼠外周血T淋巴细胞转化率的影响(n = 10,)

表3 线叶菊黄酮滴丸对小鼠外周血T淋巴细胞转化率的影响(n = 10,)
注:与模型组比较,△P < 0.05;与低剂量组比较,*P < 0.05
T淋巴细胞转化率/%67.07± 1.36△*60.03± 1.52△*56.03± 1.45△*61.00± 1.49△*32.00±1.34 34.07±1.41剂量(g·(kg·天)-1)16分组线叶菊黄酮滴丸高剂量组线叶菊黄酮滴丸中剂量组线叶菊黄酮滴丸低剂量组阳性对照(贞芪扶正颗粒)空白组(0.5%CMCNa)模型组8 4 3 10等容量的生理盐水
表4 线叶菊黄酮滴丸对小鼠巨噬细胞吞噬率的影响(n = 10,)

表4 线叶菊黄酮滴丸对小鼠巨噬细胞吞噬率的影响(n = 10,)
注:与模型组比较,△P < 0.05;与低剂量组比较,*P < 0.05
巨噬细胞吞噬率/%60.73± 1.27△*55.27± 1.31△*42.47± 1.71△*60.29±1.26△*31.27±1.21 30.53±1.12分组线叶菊黄酮滴丸高剂量组线叶菊黄酮滴丸中剂量组线叶菊黄酮滴丸低剂量组阳性对照(贞芪扶正颗粒)空白组(0.5%CMCNa)模型组剂量/(g·(kg·天)-1)16 8 4 3 1 0等容量的生理盐水
3 讨论
近年来,随着大量抗生素的开发和临床应用,MRSA 居医院内、外感染病原菌首位[12,13],并在 90 年代迅速扩散。由于耐青霉素金黄色葡萄球菌对多种抗菌药物具有广泛耐药性,对其可用的仅为万古霉素等糖肽类抗菌药物,但该类药物毒副作用较大,临床应用受到限制。随后又相继出现了完全耐万古霉素的耐青霉素金黄色葡萄球菌[14-17],这就使得临床上治疗耐青霉素金黄色葡萄球菌感染可选用的药物变得越来越少。
田应彪[18]等结果表明 16 种中药对 MRSA 和 SA 均有不同程度的抑制作用,其敏感性无显著性差异。本研究结果表明,线叶菊黄酮滴丸对MRSA和SA均有良好的抑制作用;对感染MRSA 和SA 的小鼠具保护作用,而阿司匹林仅对SA 感染的小鼠有效。小鼠外周血液淋巴细胞转换率和腹腔巨噬细胞吞噬率实验表明,线叶菊黄酮滴丸具有提高免疫力的功能。同时急性毒性实验结果表明,线叶菊黄酮滴丸无毒。
综上所述,本研究将线叶菊黄酮制成滴丸进行了初步药效学研究,验证了线叶菊黄酮滴丸的临床疗效并且提供科学的实验数据支持,为民族药抗菌新药的研制奠定了基础。同时为临床治疗细菌耐药提供了新的思路,对中药控制MRSA感染有重要的实际意义。但是线叶菊黄酮抗菌机制还有待进一步的研究。

