甘河着生藻类群落结构及其与环境因子的关系
薛浩,郑丙辉,孟凡生,王业耀,,程佩瑄,叶匡旻
1. 中国环境科学研究院,北京 100012;2. 北京师范大学水科学研究院,北京,100875;3. 中国环境监测总站,北京 100012
流域生态系统是一个社会-经济-自然复合生态系统(罗跃初等,2002),环境污染、生境退化和物种入侵是影响流域生态系统健康的主要威胁,它们可以改变河流的生物群落组成、生物多样性和生态功能(Dudgeon et al.,2010)。中国人口、经济的高速增长带来了复杂的环境问题,各流域均呈现不同程度的污染。水生生物群落与水生态系统进行着物质循环和能量流动,其结构特性对水生态系统的干扰具有高度敏感性,反映人类活动对水生态系统的影响程度,因此可以作为水生态健康评价的一个重要方面(焦珂伟等,2015)。
着生藻类作为水生资源和河流生态系统的重要组成部分,已广泛应用于河流监测与评估。其对水化学成分,如离子含量、pH值、营养物质、有机污染和重金属等非常敏感(Venkatachalapathy et al.,2015),因此被认为是河流水生态环境质量评价中合适的指示生物(Lavoie et al.,2014;Rimet,2012)。它们能够对水质退化作出迅速反应,着生藻类群落的完整性可以直接、全面、综合的测量河流生态系统健康状况(Bere,2016)。国外学者对着生藻类、大型无脊椎动物、水生植物和鱼类群落的指示作用进行了对比研究,结果表明,与其它生物相比,着生藻类群落结构差异更加明显(Soininen et al.,2004),与河流富营养化梯度有更强的相关性(Hering et al.,2006;Justus et al.,2010),对水化学变化更敏感(Feio et al.,2009),而且着生藻类是不动的、无所不在的,可以更可靠地表明污染梯度(Beyene et al.,2009),因此在水生态健康监测与评价方面指示作用更好。国内关于着生藻类群落的相关研究也逐渐增多,有学者调查了东江(邓培雁等,2012)、渭河(殷旭旺等,2013)、太子河(殷旭旺等,2012)、梧桐河(薛浩等,2018)等流域的着生藻类并进行了河流生态健康评价,结果表明,在中国广泛应用着生藻类群落进行生物监测与评价是可行的。
这是首次对嫩江支流甘河流域的着生藻类进行调研,综合运用Mcnaughton优势度分析、聚类分析、主成分分析(principal component analysis,PCA)、Spearman相关分析、除趋势对应分析(detrended correspondence analysis,DCA)和冗余分析(redundancy analysis,RDA)等分析方法,研究了甘河流域丰水期着生藻类群落结构及其与环境因子间的响应关系,希望为中国河流着生藻类尤其是着生硅藻的水生态系统健康监测与评价工作提供基础数据与研究案例。
1 研究方法
1.1 研究区概况与点位设置
甘河发源于大兴安岭山脉东侧沃其山麓,是嫩江的主要一级支流,于黑蒙交界处附近汇入嫩江。河长490 km,流域面积1.97×104km2,多年平均流量130 m·s-1。本研究共设置19个采样点(见图1),于2018年8月对甘河干流及其主要支流如克一河、阿里河、吉文河、奎勒河等进行了采样调查。
1.2 着生藻类样品采集、处理与分析
在采样点河流上下游100 m范围内,依据河流生境的不同(流速、水深和透明度),挑选 3个石块(石块上表面积<200 cm2),用底面直径2.8 cm钟形塑料盖划定取样范围,用硬毛刷刮取该范围内着生藻,用纯净水冲刷至不锈钢托盘中,加5%甲醛溶液固定后转移到广口塑料瓶中保存,作为着生藻类的定量样品。对于没有石头的点位,刷取枯枝、落叶等基质的着生藻类样品(薛浩等,2018)。
样品运回实验室,静置沉淀48 h后,取0.1 mL均匀样品于400倍显微镜(OLMPUS BX51)下进行种类鉴定和细胞计数(刘奕伶等,2015)。取部分样品进行酸化处理(浓硝酸和浓硫酸),并制成硅藻封片,在1000倍光学显微镜(OLMPUS BX51)下进行鉴定计数,每张封片观察到的硅藻细胞个数不少于400个(Xue et al.,2019)。400倍视野下样品鉴定到属,1000倍视野下硅藻样品鉴定到种。
1.3 水质、水文和生境指标测定
水温(T)、电导率(Cond)、溶解氧(DO)和pH使用便携式水质分析仪(YSI Professional Plus,Yellow Springs,OH,USA)现场测定。各采样点位同步采集河水样品,预处理后带回实验室,测定化学需氧量(CODCr)、高锰酸盐指数(CODMn)、硝氮(NO3--N)、氨氮(NH4+-N)、总氮(TN)和总磷(TP),水样采集、预处理、保存以及测定参照《水和废水监测分析方法(第 4版)》(国家环境保护总局,2002);按照《栖息地评价指标与评价标准》(郑丙辉等,2007),现场打分,获取底质得分(Bott)和生境得分(QHEI)。
1.4 数据分析
本文采用 Mcnaughton优势度指数来判定优势种的组成,选取Mcnaughton优势度指数(Y)>0.02的藻类为优势种。公式如下:

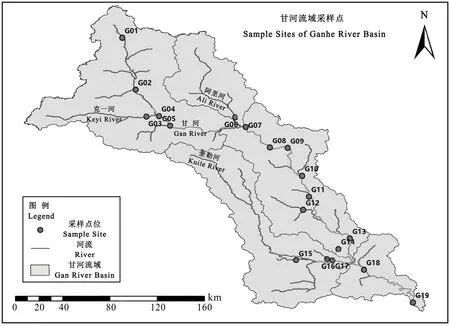
图1 甘河采样点分布Fig. 1 Sampling sites in Gan River
式中:N为所有藻类的总细胞数;ni为第i种藻类的细胞总数;ni/N为第i种藻类的细胞数占所有藻类总细胞数的比值;fi为第i种藻类在样点中出现的频率。
根据着生藻类多度数据计算各采样点香农多样性指数(Shannon-Wiener Index)和Pielou均匀度指数(Pielou Index),对着生硅藻物种多度数据进行弦转化后计算欧氏距离矩阵,使用Ward最小方差法对所有采样点位进行聚类分析,基于簇内误差平方和,使用肘方法确定最佳分类数。
对水环境理化数据和生境质量数据,首先进行PCA,判断影响甘河水环境质量的主要环境因子,对筛选出的主要环境因子进行Spearman相关分析,相关系数>0.75且显著相关的两个水环境理化因子仅保留其一。对着生藻类相对多度数据进行DCA,如果DCA排序前4个轴中最大值超过4,选择单峰模型排序更合适;如果是小于 3,则选择线性模型更好。RDA分析过程中,每个变量的贡献程度通过计算方差膨胀因子(variance inflation factor,VIF)判断,VIF值超过 10则可能存在共线问题。进行PCA、Spearman相关分析和RDA时,除pH以外的所有水体理化数据和着生藻类相对多度数据均进行数据转换(Log10[x+1])(薛浩等,2018)。以上分析均通过R 3.5.2完成,聚类分析、PCA、DCA、RDA通过“vegan”程序包实现,聚类最佳分类数确定通过“factoextra”程序包实现。
2 结果与分析
2.1 着生藻类群落分析
2.1.1 着生藻类群落结构
甘河共鉴定出着生藻类5门32属78种(属)12变种,其中硅藻门18属64种12变种,绿藻门7属,蓝藻门5属,裸藻门和金藻门各1属。从甘河着生藻类生物量比例可以看出,该流域着生藻类以硅藻门、绿藻门和蓝藻门为主;上游(G01—G05)以硅藻门和绿藻门为主,中下游(G06—G19)以硅藻门和蓝藻门为主,少数点位硅藻门占比为100%。甘河各点位着生藻类平均生物量为 66.46×104cells·cm-2,着生藻类生物量比较丰富。各河段生物量呈现由上游到下游逐渐减少的趋势,上游平均生物量为 148.63×104cells·cm-2,下游平均生物量为33.56×104cells·cm-2。
所有采样点位中,G01点位鉴定出着生藻类物种数量最多,为41种(属);G12和G14点位鉴定出物种数量最少,仅15种(属);甘河各点位平均物种数22种,各河段及支流物种数量差别较小。甘河丰水期着生藻类主要优势种为蓝藻门细鞘丝藻属(Leptolyngbya)、绿藻门丝藻属(Ulothrix)以及硅藻门的极小弯壳藻(Achnanthidium minutissimum)和钝脆杆藻(Fragilaria capucina)。
2.1.2 着生硅藻群落结构
甘河共鉴定出着生硅藻76种(变种),其中舟形藻属、菱形藻属和异极藻属鉴定出的分类单元最多,分别为13种、11种和10种。所有采样点位中,G01点位鉴定出着生硅藻物种数量最多,为35种;G06点位鉴定出着生硅藻物种数量最少,仅13种;甘河各点位着生硅藻平均物种数 20种,各河段及支流物种数量差别较小。
甘河丰水期香农多样性指数平均得分 3.04,Pielou均匀度指数平均得分0.71,说明着生硅藻多样性与均匀度状况均较好。其中G01点位香农多样性指数4.1,得分最高;G05点位香农多样性指数与均匀度指数得分均最低,分别为1.39和0.32。各点位香农多样性指数与Pielou均匀度指数结果表明,上游着生藻类多样性和均匀度平均值最低,分别为2.57和0.58,中游着生藻类多样性和均匀度平均值最高,分别为3.29和0.77。
选取 Mcnaughton优势度指数(Y)>0.02为优势种,甘河着生硅藻绝对优势种为Achnanthidium minutissimum,甘河全流域及上、中、下游区域优势种及优势度结果见表 1,各藻类代码参照 IBD(biological diatom index,硅藻生物指数)(Coste et al.,2009)。结果表明,甘河上游、中游的着生硅藻优势种与全流域优势种相似度很高,下游着生硅藻优势种与全流域优势种完全不同,说明下游硅藻群落发生了较大变化。
图2展示了甘河全流域优势种及下游优势种在硅藻生物指数IBD(Coste et al.,2009)划分的7类水质(CL1—CL7)中出现的概率,水质等级越高代表水质越好。其中,RES代表该组所有优势种在7类水质中出现的平均概率。可以看出,全流域优势种在CL5和CL6两类水质条件下出现的概率最高,平均概率在60%以上,上游和中游优势种与全流域优势种类似,说明上游和中游硅藻群落主要由清洁物种构成。下游优势种在CL2—CL4三类水质条件下出现的概率最高,平均概率在75%以上,说明下游藻类群落主要由耐污物种构成。
使用肘方法确定最佳分类数,结果表明,甘河最佳分组数为3组。使用Ward最小方差法对所有采样点位进行聚类分析,聚类分析结果见图 3。组1包含8个点位,主要位于甘河中游;组2包含6个点位,主要位于甘河上游;组3包含5个点位,均位于甘河下游。
2.2 环境因子与藻类群落分析
2.2.1 环境因子分析
甘河水质总体偏好,不考虑CODMn浓度的情况下,上游地区所有采样点位水质指标均满足地表水II类标准,中、下游地区多数点位满足地表水III类标准,仅有个别点位存在TN和NO3--N超标的现象。
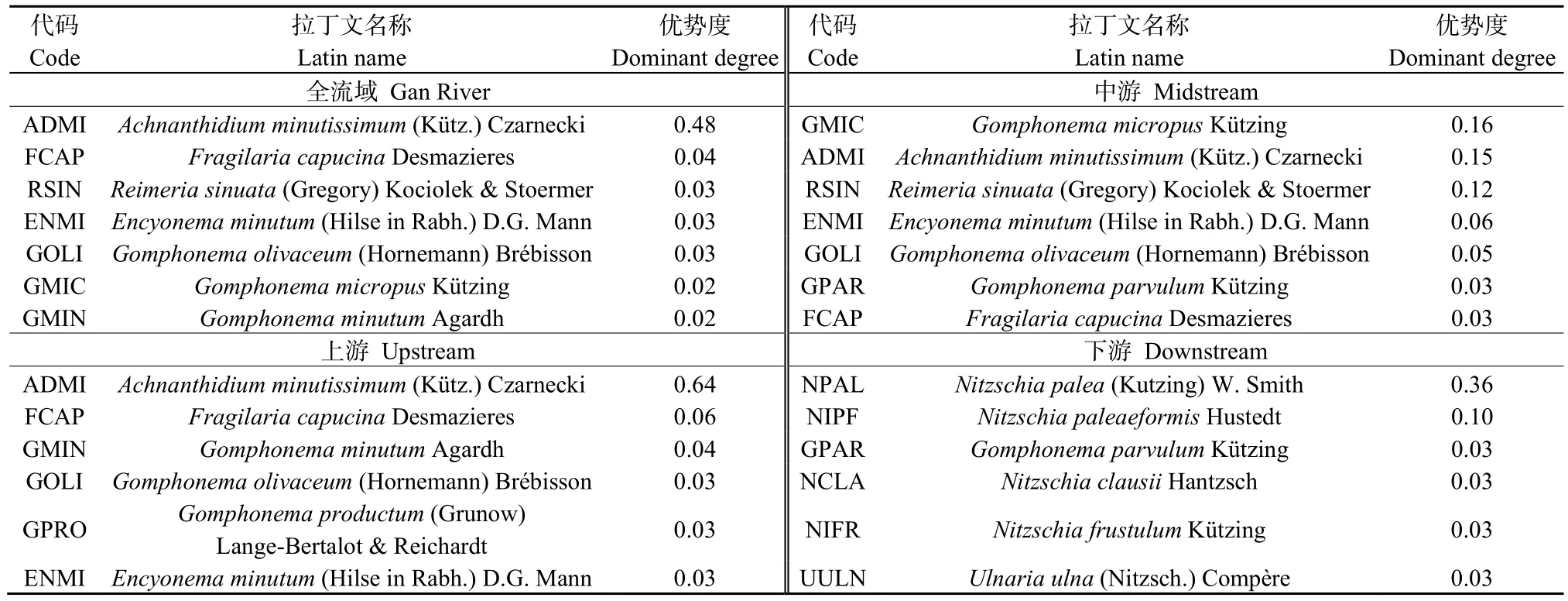
表1 甘河着生硅藻优势种Table 1 Dominant species of benthic diatom in Gan River
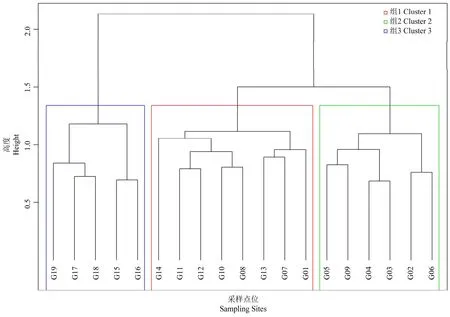
图3 三组分类的聚类树状图Fig. 3 Dendrogram with boxes around the three selected groups
对甘河12项环境因子执行PCA分析,结果表明,第一主成分和第二主成分解释率分别为0.64和0.12,第一、第二主成分累积解释率超过75%,因此保留第一、第二主成分轴绘制排序图。由PCA排序结果(见图 4)可以看出,甘河水环境及生境质量基本呈现由上游到下游逐渐变差的趋势。双序图体现了从左到右的水环境变化梯度,点位 G01—G05可以归为一组,主要位于甘河上游,该组总体生境质量很好,营养盐浓度较低,水质良好。其中G05点位由于附近施工,人为干扰较强,因此生境质量较其他点位稍差。点位G06—G13可以归为一组,与上游点位相比,该组生境变差,营养盐浓度升高。点位G14—G19可以归为一组,主要集中在甘河下游。可以明显看出,下游生境质量和水质最差,尤其是G14点位,TN和CODMn超标严重,水质为劣V类。
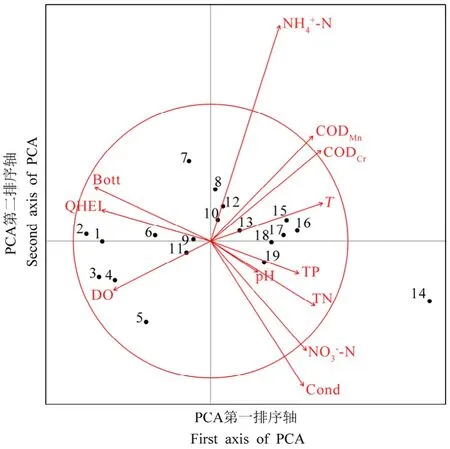
图4 甘河环境数据PCA分析排序图Fig. 4 PCA ordination diagram of the Gan River environmental data
PCA结果表明,共有5个环境变量贡献率大于所有变量的平均贡献率,分别为 NH4+-N、Cond、NO3--N、CODCr和CODMn。pH的贡献率较低予以剔除,剩余11个指标进行相关分析。根据相关分析结果(见表2),相关系数>0.75且显著相关的环境因子仅保留一个,因此保留CODMn、Cond、TP、DO和QHEI进行后续分析。
2.2.2 着生硅藻与水环境因子的关系分析
根据DCA分析结果,DCA排序前4个轴中最大值为 2.70,小于 3,因此选择 RDA分析环境因子、藻类群落及采样点位间的关系。VIF计算结果表明,5个变量的最大VIF值为3.8,说明各变量间线性关系较弱,不存在明显的共线性问题。硅藻物种与环境因子 RDA分析过程中,剔除了甘河流域出现频率较低(<20%)的物种。
样方与环境因子的RDA排序图(见图5a)体现了从左到右的水质、生境变化梯度,以及各采样点位与环境因子间的关系。沿第一轴从左往右,营养盐浓度及CODMn逐渐升高,生境质量逐渐降低。聚类分析组2点位(见图3)全部分布在第一排序轴左侧,说明该组QHEI得分和DO浓度较高;聚类分析组3点位全部分布在第一排序轴右侧,说明该组CODMn和营养盐浓度较高,生境质量较差;聚类分析组1点位主要分布在第一排序轴中侧,说明该组水质和生境质量均属于中等水平。
物种与环境因子的RDA排序图(见图5b)体现了从左到右的水质、生境变化梯度,以及各硅藻物种与环境因子间的关系。上游和中游着生硅藻优势种全部分布在第一排序轴左侧,说明上、中游优势种清洁度较高,喜好生活在QHEI和DO较高的水域;下游着生硅藻优势种主要分布在第一排序轴右侧,说明下游优势种污染耐受性较高,主要存在于CODMn和营养盐浓度较高的水体中,对QHEI和DO需求度不高。

表2 11个环境因子的Spearman相关系数Table 2 Spearman correlation coefficient of 11 environmental factors
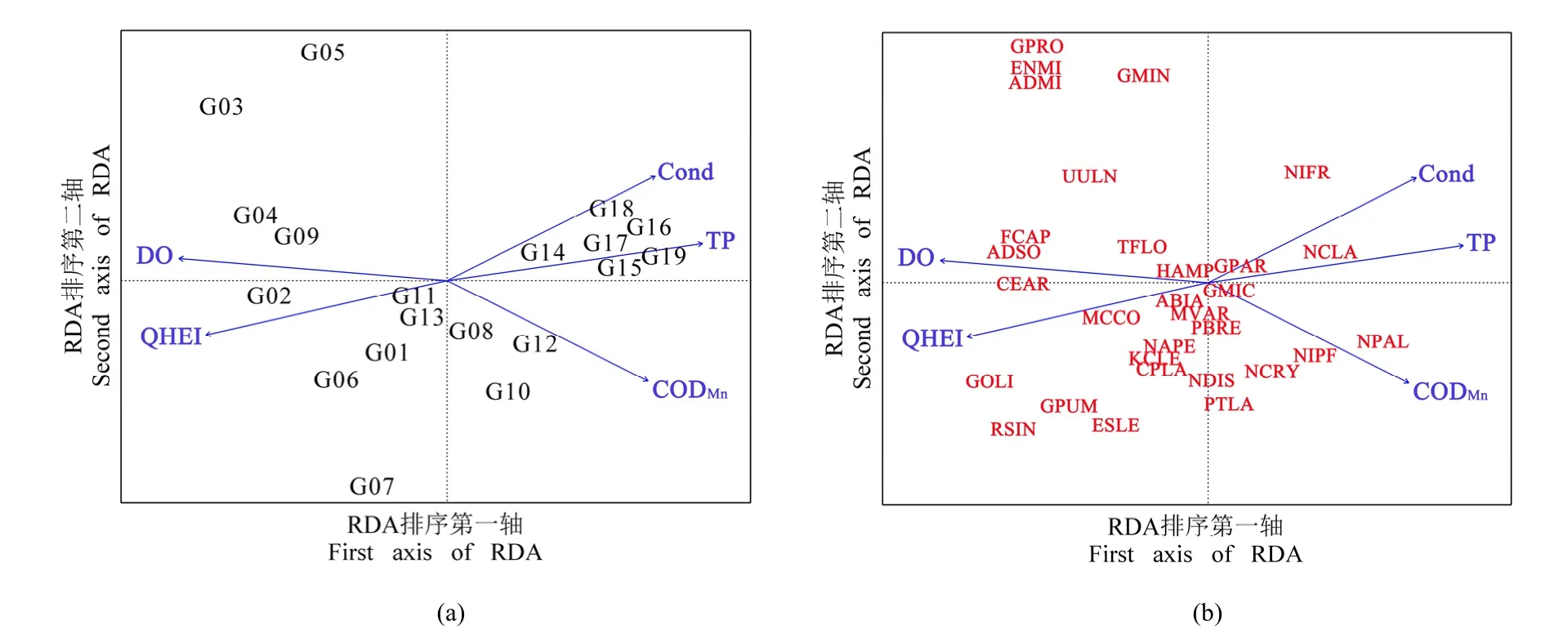
图5 RDA分析排序图Fig. 5 Ordination diagram of RDA
3 讨论
甘河丰水期着生藻类群落结构从上游到下游表现出明显的变化趋势,上游藻类群落主要由硅藻和绿藻构成,下游藻类群落主要由硅藻和蓝藻构成。造成这一现象的主要原因可能有两个,首先,上游位于山林区域,水温较下游地区低 7—8 ℃左右,水体透明度较大,比较适合鼓藻等绿藻的繁殖(孙春梅等,2010);其次,下游地区营养盐浓度比上游地区高,适合蓝藻门颤藻属等中营养-富营养型的指示藻类生长(凌旌瑾等,2008;孙春梅等,2010)。着生藻类生物量从上游到下游表现出明显的下降趋势,这是由于上游生境质量好,水体透明度和溶解氧浓度较高,适宜藻类生长。
甘河丰水期着生硅藻平均物种数为 20种,群落结构相对稳定。各点位香农多样性指数和Pielou均匀度指数得分结果表明,甘河着生硅藻物种多样性与均匀度状况均较好。物种多样性与均匀度呈现由上游到下游先升高后降低的趋势,中游物种多样性升高,是因为中游出现了轻度的人类活动干扰,在群落演替过程中,物种多样性的增加是生态系统对外界轻度干扰的一种良性适应(石娟等,2007)。下游生物多样性降低可能是因为下游外界干扰强度过大,超过了系统自身的调节能力,着生硅藻的生存环境受到一定破坏。倭肯河流域(薛浩等,2019a)与汤旺河流域(薛浩等,2019b)研究结果也表明,随着生境质量和水环境质量的下降,香农多样性指数与Pielou均匀度指数也呈现出先升高后降低的趋势。
Achnanthidium minutissimum等7个物种为甘河丰水期着生硅藻优势种,其中A.minutissimum在超过90%点位中均有出现,且相对丰度较高,为绝对优势种。A.minutissimum广泛分布于世界各地,为很多地区的常见种(Potapova et al.,2010)。根据 IBD指数,A.minutissimum主要出现在水质较好的区域,为清洁种;甘河其余优势种也主要分布在 CL5—CL7三类水质等级中(见图2),均为相对清洁的物种。根据Muscio(2002)建立的美国硅藻耐污指数(pollution tolerance index,PTI),A.minutissimum、Fragilaria capucina、Reimeria sinuata、Encyonema minutum和Gomphonema minutum耐污值均为3(最高分为4),为相对清洁种。此外,澳大利亚河流硅藻指数(diatom species index for Australian rivers,DSIAR)(Chessman et al.,2007)和南美大草原硅藻指数(Pampean diatom index,IDP)(Gómez et al.,2001)物种清单中,A.minutissimum、F.capucina和R.sinuata得分均较高。RDA分析结果(见图5b)表明,甘河丰水期着生硅藻优势种全部分布在第一排序轴左侧,说明甘河优势种偏好生活在QHEI和DO较高的环境中。由此可见,甘河丰水期着生硅藻群落以清洁种为主,说明甘河丰水期整体污染较少,水生态环境质量比较健康。
与全流域优势种相比,上游优势种发生了轻微变化,Gomphonema productum为上游优势种之一。与上游相比,中游主要变化表现为Gomphonema parvulum优势度增加,成为中游优势种。研究表明,G.parvulum为河流富营养化指示种(Salomoni et al.,2006),经常生长在受干扰较强的水体中,说明与上游相比,中游营养盐浓度和人为干扰强度均有所升高。下游优势种与上游完全不同,与中游也仅有G.parvulum一个相同优势种。下游三分之二的优势种为菱形藻,其中优势度最高的为Nitzschia palea和Nitzschia paleaeformis。参照IBD结果(Coste et al.,2009),下游优势种主要分布在水质较差区域(见图2),因此可以判断,下游区域人为干扰严重,存在富营养化趋势。
水质分析结果表明,甘河水质总体偏好,主要的超标水环境因子为CODMn,这是由于甘河CODMn浓度本底值较高导致。陈家厚等(2010)研究表明,松花江流域土壤有机质及腐殖质含量较高,各支流源头属于高CODMn河段。根据PCA分析结果(见图4),甘河水环境及生境质量由上游到下游逐渐变差,这主要是因为与上游相比,中游人类活动干扰强度有所增加,生境和水质质量受人为活动影响变大;下游及库鲁齐河支流,存在大面积的农业活动,面源污染相对严重。
与蓝绿藻相比,着生硅藻能够更快地反映环境变化(Kelly et al.,2008;Schneider et al.,2012),更适合作为水生态健康评价的生物指标(Fetscher et al.,2014),因此本研究主要分析着生硅藻群落与环境因子的响应关系。样方与环境因子 RDA分析结果(见图5a)表明,甘河水质、生境和硅藻群落结构均体现了从左到右的梯度变化。RDA排序图体现出由上游到下游的变化梯度,QHEI和DO逐渐降低,Cond、TP和CODMn逐渐升高。第一排序轴左侧主要是上游点位,硅藻群落主要由A.minutissimum等清洁种构成,随着 Cond、TP和CODMn代表的污染强度增加,硅藻群落中耐污种优势度上升,中游优势种中首次出现了耐污种G.parvulum。下游开始出现营养富集现象,水体呈现富营养化趋势,清洁种优势度明显下降,硅藻群落主要由N.palea等耐污种构成。
物种与环境因子RDA分析结果(见图5b)表明,Ceratoneis arcus、Achnanthidium subatomoides和Fragilaria capucina3个物种与DO相关性最强,尤其是C.arcus和A.subatomoides,仅在DO浓度大于 9 mg·L-1的点位中出现。C.arcus、A.subatomoides、Meridion circularevar.constrictum和Gomphonemaolivaceum4个物种与QHEI相关性最强,主要分布在生境质量较好的区域。N.palea和N.paleaeformis两个物种与CODMn相关性最强,同时与TP具有较强的相关性。研究表明,菱形藻主要生活在水质较差的水体中(Wu,1999),N.palea主要生活在农业活动影响较大(Lavoie et al.,2006)、TP浓度较高(Oeding et al.,2017)的水域,被认为是富营养指示种(Besse-Lototskaya et al.,2011),N.paleaeformis为典型的中营养指示种(Van Dam et al.,1994)。Nitzschia clausii与TP相关性最强,同时与Cond具有较强的相关性,主要出现在TP浓度较高的下游区域。作为中等耐污种,N.clausii在哥斯达黎加一条受污染的河流中出现频次较高(Silva-Benavides,1996),邓培雁等(2015)在东江流域的研究结果也表明,N.clausii是东江TN和TP污染的指示种。作为甘河流域的绝对优势种,A.minutissimum与各环境因子相关性较差,这是因为A.minutissimum几乎出现在所有采样点位,在甘河流域指示作用较低。
由RDA排序图可以看出,CODMn浓度的升高是导致中游着生硅藻群落结构变化的主要原因,TP和 Cond代表的N、P等营养盐浓度的升高是导致下游着生硅藻群落清洁度降低的主要原因。着生硅藻群落结构与甘河的富营养化程度和有机污染程度相关性较强,下游优势种除Ulnariaulna外均与Cond、TP和CODMn代表的营养盐有较强的相关性,可以很好的指示甘河水体污染状况。国外许多研究也表明,着生硅藻群落可以有效的评估低水平的营养富集(Lavoie et al.,2010)和水体富营养化(Passy et al.,1999)。
4 结论
(1)甘河丰水期共鉴定出着生藻类90种(属),以硅藻门、绿藻门和蓝藻门为主,各点位平均生物量为 66.46×104cells·cm-2,生物量丰富。甘河水生态环境质量状况较为健康,着生硅藻主要由清洁种构成,其中Achnanthidium minutissimum优势度0.48,为绝对优势种。
(2)甘河上游和中游丰水期硅藻群落主要由Achnanthidium minutissimum、Fragilaria capucina和Reimeria sinuata等清洁种构成,随着人类活动干扰强度的增加,下游水质和生境变差,硅藻群落逐渐由Nitzschia palea和Nitzschia paleaeformis等耐污种构成。
(3)影响中游着生硅藻群落结构的主要水环境因子是CODMn,影响下游着生硅藻群落结构的主要水环境因子是TP和Cond,着生硅藻群落可以很好的指示甘河水体有机污染程度和营养富集程度。

