农产品中黄曲霉毒素产毒菌标识性分子大容量反应体系提高ELISA灵敏度
魏晓,张奇,张文,李慧,李培武,4,5
农产品中黄曲霉毒素产毒菌标识性分子大容量反应体系提高ELISA灵敏度
魏晓1,2,4,张奇1,2,3,张文1,3,5,李慧1,2,4,李培武1,2,3,4,5
(1中国农业科学院油料作物研究所,武汉 430062;2农业部油料作物生物学与遗传育种重点实验室,武汉 430062;3农业部生物毒素检测重点实验室,武汉 430062;4农业部油料产品质量安全风险评估实验室,武汉 430062;5农业部油料及制品质量监督检验测试中心,武汉 430062)
【】为预防和降低黄曲霉毒素污染,在前期探明黄曲霉毒素产毒菌株鉴别标识性分子PO8蛋白的基础上,欲研究建立高灵敏、大容量反应体系的双抗夹心ELISA检测技术,为污染源头监控提供技术支撑。用干菌丝作标识性分子PO8蛋白的参考物,以高压均质制得的黄曲霉菌裂解液为检测抗原,纯化后的PO8-VHH作包被抗体,产毒菌株多抗作检测抗体,抗原、抗体分别以200 μL/孔加入到96孔酶标板,进行大容量反应体系夹心ELISA法的试验。优化相关理化因素,以阳性孔OD450nm≥1.0,阳性孔OD450nm/阴性孔OD450nm较高为原则,确定最佳试验条件,建立标准曲线。并通过样品添加回收试验、重复性试验、特异性试验,对建立的夹心ELISA方法进行性能评估。通过棋盘格试验确定了最佳包被抗体浓度为3.0 μg∙mL-1,最佳多抗的工作浓度为2.5 μg∙mL-1。优化反应条件确定:最佳抗体包被条件为4℃过夜,最佳封闭液为3%的BSA,最佳封闭条件为37℃封闭2 h,最佳多抗作用条件为37℃反应50 min。在优化后的条件下建立了夹心ELISA方法的标准曲线,对黄曲霉菌检测限可达到0.1 µg∙mL-1,比前期报道的常规容量反应体系灵敏度提高了约10倍。该方法特异性强,与青霉菌、尖孢镰刀菌、串珠镰刀菌、赭曲霉菌均无交叉反应,且检测非产毒黄曲霉菌株信号值较低,接近于阴性值。重复性试验显示,板间变异系数为1.5%—5.8%,板内变异系数为0.4%—3.2%,均小于7%,说明该方法稳定性好。采用该方法对花生、玉米等农产品进行添加回收试验,平均回收率在81.9%—109.0%。本研究建立的大容量反应体系夹心ELISA方法可快速、高灵敏地检测黄曲霉毒素产毒菌,为从源头上控制黄曲霉毒素污染提供了新的快速、方便的检测技术支撑。
农产品;黄曲霉菌;纳米抗体;ELISA;标识性分子
0 引言
【研究意义】部分黄曲霉()和寄生曲霉()能够产生黄曲霉毒素(,),它具有强致癌[1]、致畸、免疫抑制性,并且毒性强、污染广、危害重,是人类迄今发现的污染农产品和食品毒性最大、致癌力最强的一类真菌毒素[2]。黄曲霉菌可侵染大多数农产品,不仅造成巨大的经济损失,还严重危害人类和动物的健康[3]。其中我国的主要油料作物花生受到黄曲霉毒素污染尤为严重,近年来,我国出口的花生及其制品常因黄曲霉毒素含量超标,在国际贸易市场上遭受重大经济损失,严重影响了我国农产品进出口贸易的健康发展[4-5]。目前,黄曲霉毒素检测技术已发展比较成熟[6],但是针对的是已经被AFT污染的农产品和食品。若能在AFT产生之前,检测到具有潜在产毒能力的黄曲霉菌,即黄曲霉毒素产毒菌,从而可以从源头来监控食品安全[7]。因此,建立对黄曲霉毒素产毒菌的高灵敏检测方法,对农产品黄曲霉毒素污染源头控制与现代农业产业高质量发展具有重要意义。【前人研究进展】传统的黄曲霉菌检测主要依赖于形态学特征观察和培养基鉴定,但由于黄曲霉菌种类繁多、形态复杂,误判率高[8-9],现在逐渐用PCR方法[10-12]和免疫学检测方法[13-16]来取代传统的生化鉴定方法。由于PCR检测方法所需仪器、试剂价格较高,且需要专业的技术人员进行操作,因此PCR检测方法实用性不高[17]。黄曲霉菌免疫学检测方法是基于抗体与抗原的特异性相互作用的ELISA检测方法,目前文献报道的真菌 ELISA 检测方法多为双抗体夹心ELISA法。包被抗体、抗原和检测抗体形成“夹心式”复合物[13-14]。双抗夹心ELISA方法要求被检测的抗原有至少两个以上的结合位点,这样才可以同时被包被抗体和检测抗体识别。ELISA检测方法具有灵敏度高、特异性好、筛选通量高、成本低和不依赖昂贵仪器等优点[18-19]。现有研究用黄曲霉菌的菌丝、细胞分泌物等做抗原免疫兔子制得黄曲霉产毒菌多抗,并建立ELISA方法检测黄曲霉菌,灵敏度达1 µg∙mL-1[20-22]。Villamizar等[23]对大米中的黄曲霉菌进行检测,灵敏度达10 µg∙g-1。也有研究者制备黄曲霉菌单克隆抗体,利用ELISA方法检测黄曲霉菌[24-26]。XUE等[27]对花生中黄曲霉菌的最低检测限可达1 µg∙g-1。【本研究切入点】WANG等[7]利用黄曲霉菌表面蛋白、分泌蛋白和胞内蛋白作为抗原免疫羊驼和大耳兔,成功获得黄曲霉菌的纳米抗体和多抗。经试验证明研制出的PO8纳米抗体能够识别黄曲霉和寄生曲霉中的单一条带(45 kD),对非曲霉属真菌和细菌没有交叉反应,并且该蛋白可较为容易地分泌到细胞外,这使得利用PO8-VHH检测黄曲霉毒素产毒菌更加有望成为可能。然而WANG等[7]建立的黄曲霉菌检测方法灵敏度较低(1 µg∙mL-1)。【拟解决的关键问题】建立大容量反应体系的夹心ELISA检测方法,富集PO8蛋白以提高检测灵敏度,并优化相关反应条件,以实现对黄曲霉毒素产毒菌的高灵敏和快速精准测定。
1 材料与方法
试验于2018年在中国农业科学院油料作物研究所进行。
1.1 材料和试剂
黄曲霉菌株3.4408、黄曲霉菌PO8纳米抗体、菌多抗均为本实验室保存,花生、玉米购于武汉中百超市,DNA marker购于宝生物工程有限公司,BSA购于美国Sigma公司,HRP标记羊抗兔IgG购于武汉博士德生物公司,X-Tractor细胞裂解液、HisPur镍柱NTA树脂购于美国Clontech公司,HRP标记抗HA标签鼠单抗购于北京康为世纪有限公司,氨苄青霉素钠盐(Amp)购于美国Amresco公司。
1.2 仪器与设备
恒温培养箱、恒温摇床购于美国Thermo Fisher公司,高压均质机ATS1500购于加拿大ATS公司,水平凝胶电泳仪、凝胶成像分析系统购于北京六一仪器厂,酶标仪购于美国分子仪器公司,全自动洗板机、96孔酶标板购于美国Costar公司。
1.3 抗原的制备
将黄曲霉菌的干菌丝作为标识性分子PO8蛋白的参考物质。将黄曲霉菌3.4408的孢子液加至Czapek培养基中,使终浓度为5×105cfu/mL,于28℃摇床培养5 d后,用灭菌滤纸过滤收集菌丝,并用液氮充分研磨至粉末溶解在PBS中,随后用高压均质仪充分裂解黄曲霉菌菌丝,制得黄曲霉菌裂解液作为抗原,抗原浓度以菌丝量计。
1.4 PO8纳米抗体的纯化与验证
将pComb3x-PO8/Top10F在LB-Amp固体培养基上进行活化。从平板上挑单克隆接种到SB-Amp液体培养基中扩大培养,37℃恒温摇床振荡培养至菌液OD600nm为0.6—0.8,加入1 mol∙mL-1IPTG溶液。次日,3 000×离心30 min,弃上清液收集菌体,将菌体用细胞裂解液裂解,收集上清用PBS(0.01 mol∙L-1,pH 7.4)缓冲液透析过夜。将透析后的溶液离心以去除细胞碎片,取上清液通过镍柱纯化。用SDS-PAGE电泳对各流出液进行分析,混合纯的纳米抗体流出液,用PBS缓冲液透析过夜,超滤浓缩透析液,最后用考马斯亮蓝法测其浓度,分装储存于-20℃[28]。将黄曲霉菌裂解液梯度稀释至10-3、10-2、10-1、1、10、102、103和104µg∙mL-1包被酶标板,用间接ELISA方法测定纯化后的纳米抗体亲和力。
1.5 包被抗体和检测抗体工作浓度设置
将纯化后的PO8-VHH分别以3、2、1和0.5 µg∙mL-1加入96孔酶标板,并设置5个重复孔,包被量为每孔200 μL,4℃包被过夜。次日,用PBST洗板3次。随后加入3% BSA作为封闭液,每孔300 μL,37℃条件下封闭2 h。取出后,用PBST洗板3次。将黄曲霉菌裂解液稀释至100 µg∙mL-1,以200 μL每孔加入酶标板,37℃反应1 h。取出后用PBST洗板3次。用兔多抗做检测抗体,将菌多抗用PBS分别稀释至4、3、2.5、2、1.5、1和0.5 µg∙mL-1。分别以200 μL每孔加入酶标板,37℃反应50 min。取出后,用PBST洗板3次。每孔加入200 μL HRP标记的羊抗兔抗体(1﹕5 000),37℃反应1 h。取出后用PBST洗板6次。最后每孔加入100 μL的TMB显色液,37℃避光反应15 min后加入终止液终止反应,立即于酶标仪上读取OD450nm值。
1.6 抗体包被条件设置
采用确定的抗体包被浓度和多抗稀释度,分别以37℃ 2 h,37℃ 1 h,4℃ 12 h共3种不同的条件包被PO8纳米抗体,用夹心ELISA方法测定OD450nm,并分析P/N值,确定最佳抗体包被条件。
1.7 封闭液设置
分别在37℃以5%脱脂奶粉、3%脱脂奶粉、3%BSA共3种封闭液进行封闭,其他条件不变,进行夹心ELISA方法测定OD450nm,分析P/N值,确定最佳封闭液。
1.8 封闭时间处理
分别以37℃ 3 h、37℃ 2 h 、37℃ 1 h三种不同条件进行封闭,其他条件不变,夹心ELISA方法测定OD450nm,并分析P/N值,确定最佳封闭时间。
1.9 多抗工作时间的确定
将多抗分别在37℃条件下分别作用30、50和60 min,夹心ELISA方法测定OD450nm,分析P/N值,确定最佳多抗工作时间。
1.10 夹心ELISA方法标准曲线的绘制
按照已确定的条件,将黄曲霉菌裂解液梯度稀释至10-3、10-2、10-1、1、10、102、103和104µg∙mL-1,以200 µL/孔加入酶标板,用夹心ELISA法测定OD450nm值。以黄曲霉菌裂解液浓度为横坐标,以OD450nm值为纵坐标,绘制标准曲线。ELISA检测的标准曲线可通过下面的公式进行拟合:
450nm==min+
式中,为实际测定的结合反应吸光度值,B为最小吸光度值,B为最大吸光度值,为测定浓度,50为半最大效应浓度,为斜率。
1.11 夹心ELISA方法特异性的建立
用1.3的方法制备青霉菌(HBHA)、尖孢镰刀菌(FO)、串珠镰刀菌(FV)、赭曲霉菌(AO)细胞裂解液。用优化的反应条件建立的夹心ELISA方法,检测青霉菌、尖孢镰刀菌、串珠镰刀菌、赭曲霉菌细胞裂解液,PBS作为阴性对照,每组设置5个重复,检验该方法的特异性。
用从江西、湖北等地采集的黄曲霉菌株(5种产毒菌株和5种不产毒菌株)分别接种健康、无霉变的花生,15 d后将被菌侵染后的花生粉碎,称取适量花生粉末悬浮于PBS缓冲液中。将样品稀释至0.5 mg∙mL-1,包被ELISA板,用建立的ELISA方法进行测定,以检测该方法与不产毒的黄曲霉菌是否有交叉反应。
1.12 重复性试验
用同批次包被的ELISA板分别检测4份阳性样品和1份阴性样品,并设置5个重复计算批内变异系数。用不同批次包被的ELISA板同时检测4份阳性样品和1份阴性样品,计算批间变异系数,评价该方法的重复性。变异系数CV(%)=标准偏差/平均值×100。
1.13 添加回收率测定
将健康(表皮完整、无霉菌)的花生、玉米粉碎,称取0.1 g加入到10 mL PBST缓冲液中悬浮,添加不同浓度的黄曲霉菌裂解液(100、10和1 µg∙mL-1),取200 µL加入酶标板,通过ELISA方法计算回收率。
2 结果
2.1 黄曲霉菌PO8-VHH的纯化鉴定
将纯化后的PO8-VHH进行SDS-PAGE电泳,结果如图1所示,PO8-VHH分子量约为17 kD,与预期大小相符,且条带单一。用考马斯亮蓝法测蛋白浓度为550 µg∙mL-1,说明纯化效果良好。用间接ELISA方法鉴定纯化的PO8-VHH与制得的黄曲霉菌裂解液的结合力如图2所示,PO8-VHH(5 μg∙mL-1)可最低识别到10 µg∙mL-1的黄曲霉菌丝。
2.2 包被抗体和检测抗体最佳工作浓度
棋盘法确定最佳VHH包被浓度和菌多抗工作浓度(表1)。抗体工作浓度的选择应遵循以下两个原则:①OD450nm值接近于1.0;②抗体用量少为佳;根据表1中结果可确定最佳VHH包被量为3.0 μg∙mL-1,最佳多抗工作浓度为2.5 μg∙mL-1。
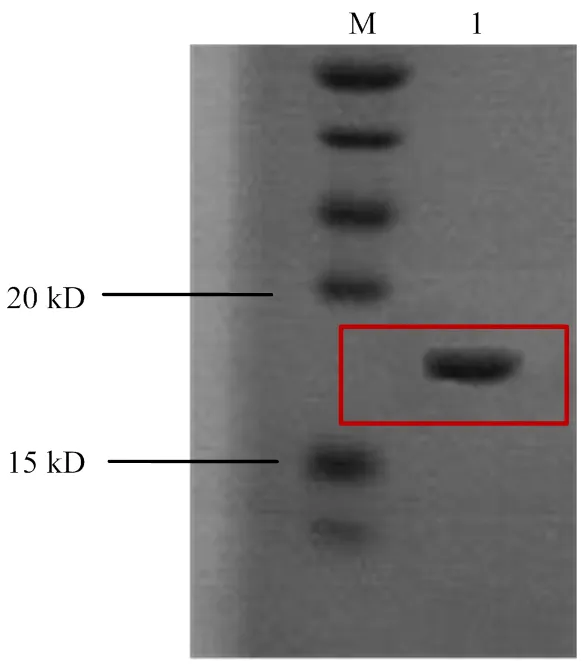
M:蛋白分子量标准 Protein Marker;1:PO8-VHH

图2 纳米抗体与黄曲霉菌的亲和力分析
2.3 抗体包被条件的确定
抗体包被条件的不同会对ELISA反应产生影响,测定结果见图3,4℃包被过夜条件下P(阳性值)/N(阴性值)值平均数最大且P值大于1.0,因此,4℃过夜为最佳抗体包被条件。
2.4 最佳封闭液的确定
封闭试剂的选择能够影响ELISA的非特异性吸附,从而影响ELISA的灵敏度。因为用纳米抗体作包被抗体易出现假阳性,因此本试验加大了封闭液的浓度。由图4可知,3% BSA封闭液的P/N值最高,为最佳封闭液。

表1 不同浓度包被抗体和多抗ELISA结果

图中不同小写字母表示不同处理间差异显著(P<0.05)。下同
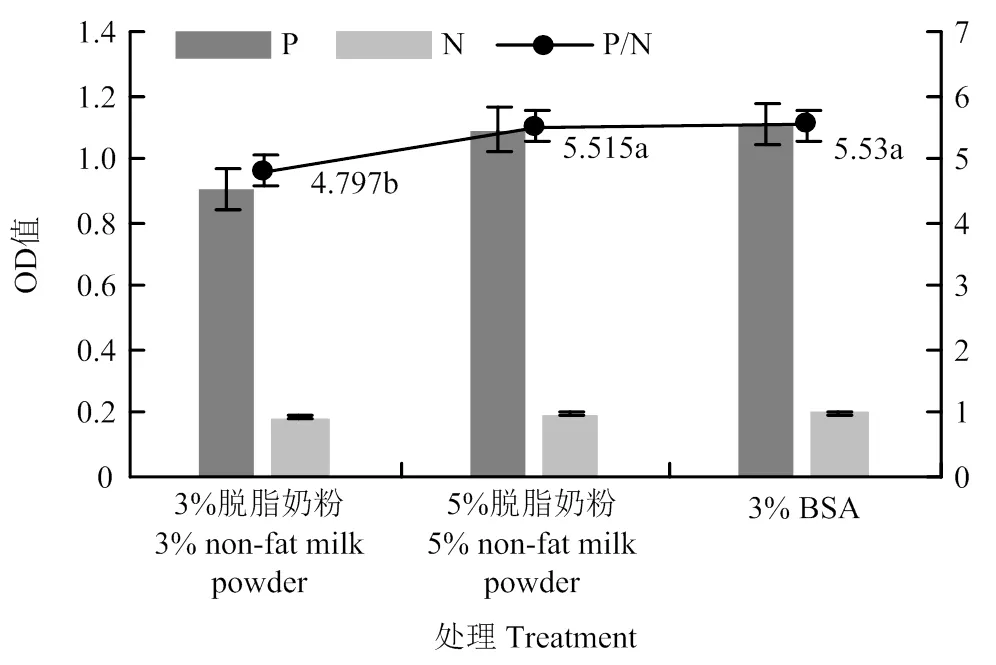
图4 不同封闭液的P/N值
2.5 最佳封闭时间的确定
如图5所示,在37℃封闭2 h条件下P/N值最高,且OD450nm>1.0,所以2 h为最佳封闭时间。
2.6 最佳多抗作用时间的确定
由图6可知,在37℃反应50 min 条件下P/N值最高,且OD450nm>1.0,为最佳多抗作用时间。

图5 不同封闭时间的P/N值
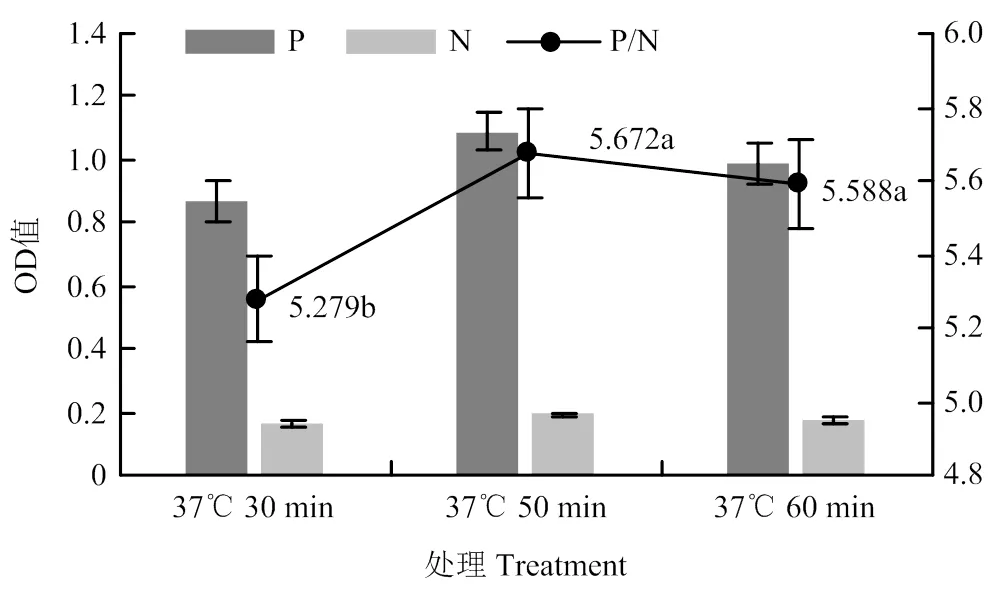
图6 不同多抗工作时间的P/N值
2.7 夹心ELISA方法标准曲线的绘制
建立的该大容量反应体系夹心ELISA方法对黄曲霉菌检测限可达到0.1 µg∙mL-1。黄曲霉菌干菌丝浓度的对数值与OD450nm值之间进行非线性拟合,相关系数较高(2>0.99)(图7),表明建立的标准曲线准确度较高。
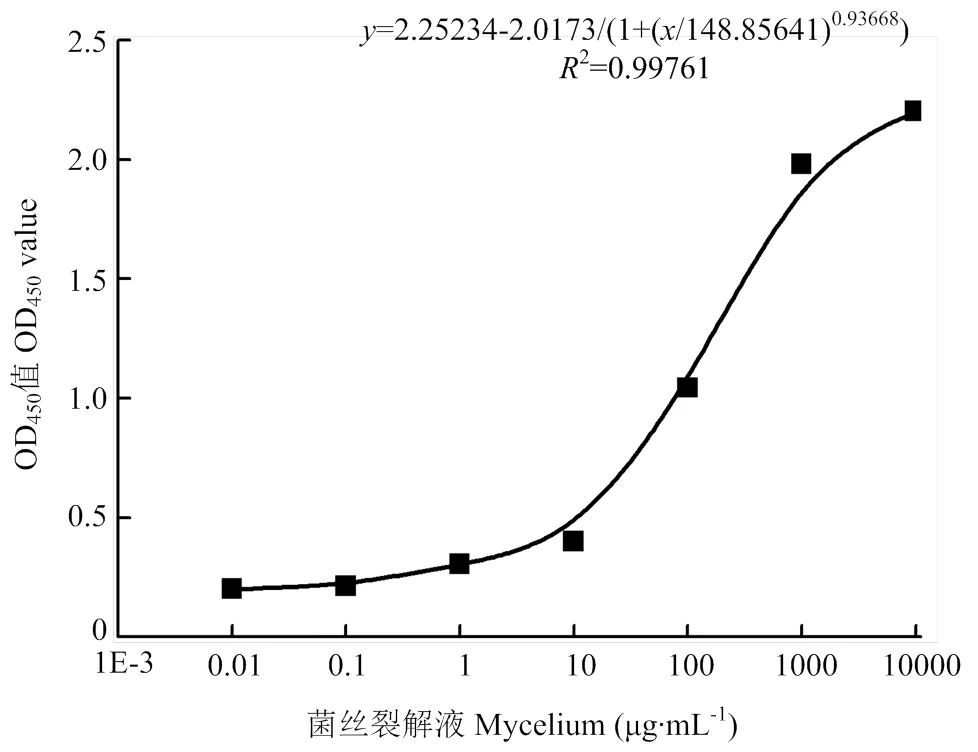
图7 大容量反应体系夹心ELISA方法标准曲线
2.8 夹心ELISA方法特异性的确定
用优化后的双抗体夹心ELISA方法检测青霉菌(HBHA)、尖孢镰刀菌(FO)、串珠镰刀菌(FV)、赭曲霉菌(AO),结果均无交叉反应,阴、阳性均成立(表2)。用建立的ELISA方法分别检测被产毒菌株和非产毒菌株侵染的花生材料,结果显示,非产毒黄曲霉菌株的信号值较低,接近于阴性值(表3)。表明建立的大容量夹心ELISA方法具有良好的特异性。
2.9 重复性试验
用优化后的双抗体夹心ELISA方法对板内、板间重复性进行验证。分别检测5份不同样品的OD值,并计算其变异系数。结果如表3、表4所示,板间变异系数为1.5%—5.8%,板内变异系数为0.4%—3.2%,均小于7%,说明建立的大容量夹心ELISA检测方法具有一定的稳定性。
2.10 添加回收率试验
为评估新建立的黄曲霉毒素产毒菌标识性分子的大容量反应体系ELISA检测方法在样品分析中的有效性,对易染黄曲霉的花生、玉米进行黄曲霉菌丝加标和回收研究试验。本试验的模拟样本中,菌丝的添加浓度分别为100、10和1 µg∙mL-1,用已建立并优化的方法检测,结果如表5所示,样品中黄曲霉菌丝的平均回收率在81.9%—109.0%,符合一般情况。
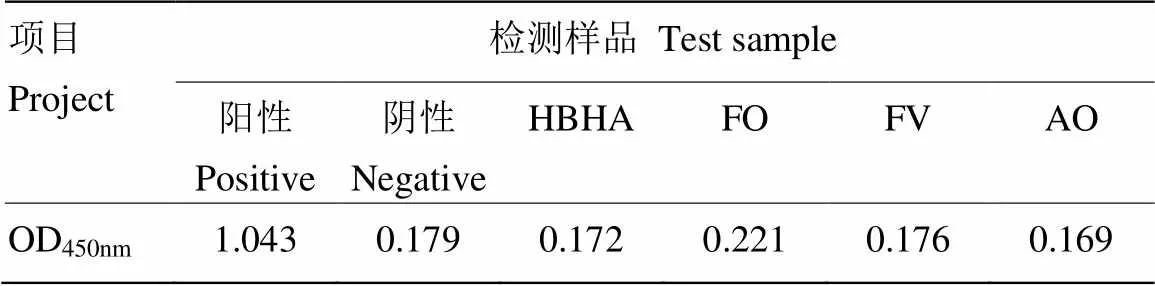
表2 特异性试验结果
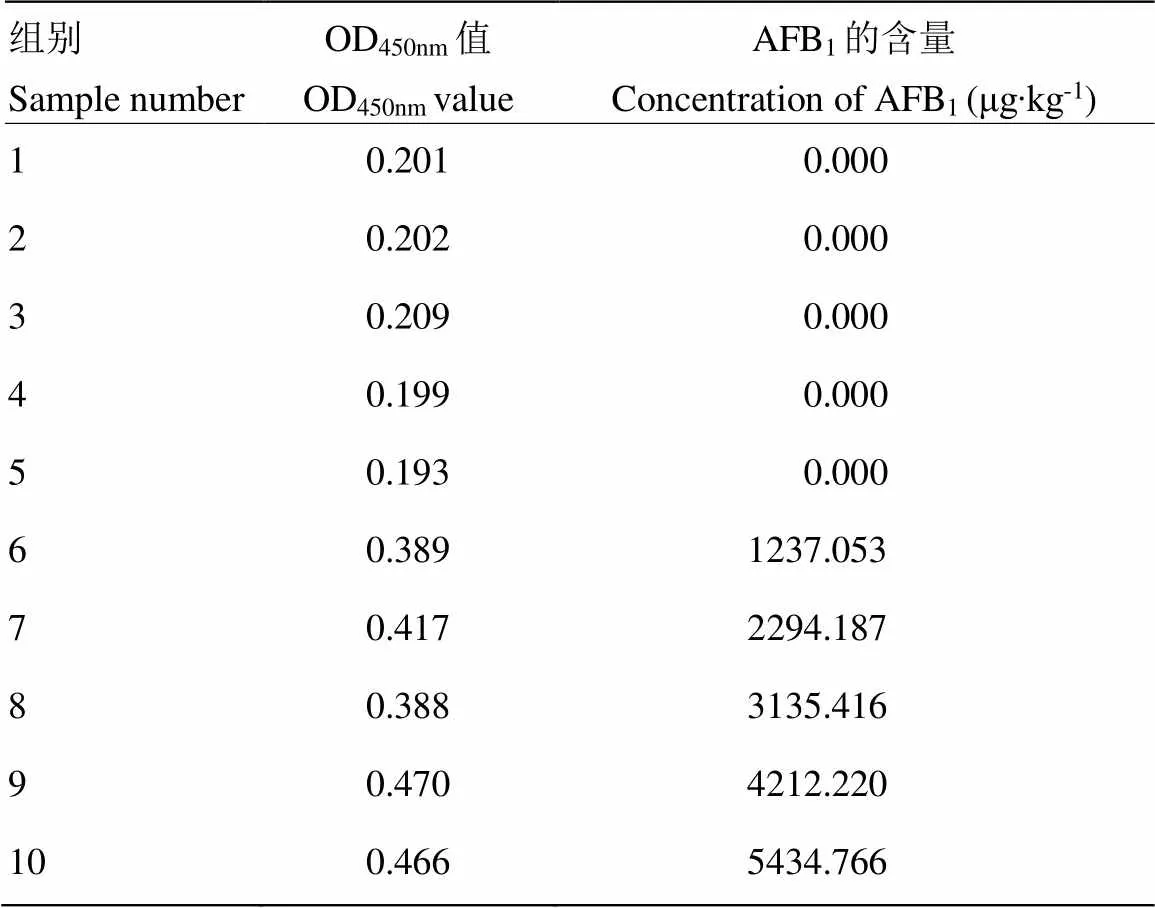
表3 ELISA检测被黄曲霉菌污染的花生

表4 板内重复性
3 讨论
黄曲霉菌侵染花生、玉米等经济作物,造成重大的经济损失,其产生的黄曲霉毒素属于I类致癌物,严重危害人和动物的健康[29-30],因此针对黄曲霉毒素以及产毒菌的检测已成为近年来的发展热点。目前,针对黄曲霉毒素的检测方法已比较成熟,如黄曲霉毒素免疫亲和检测技术,灵敏度可达0.003—0.01 μg∙kg-1[31-34],我国自主研发的黄曲霉毒素单光谱成像检测仪,灵敏度最高可达0.03 ng∙mL-1。但是目前针对黄曲霉毒素产毒菌的检测发展比较缓慢,黄曲霉菌免疫学检测方法主要是基于多抗、单抗等传统抗体建立的ELISA检测方法,传统抗体存在均一性差、特异性差、生产周期较长等缺点。笔者实验室用黄曲霉菌表面蛋白、分泌蛋白和胞内蛋白作为抗原免疫羊驼率先制备了针对黄曲霉菌的纳米抗体,具有特异性强、亲和力高、溶解度高、稳定性好等优点[35-39],为黄曲霉毒素产毒菌的检测提供了关键技术支撑。WANG等[7]建立的夹心ELISA检测方法灵敏度较低,且未对其建立的方法进行性能评估。本研究针对其不足,研究建立了大容量反应体系的纳米抗体-多抗夹心ELISA检测方法,加大抗原的用量富集黄曲霉菌标识性分子PO8蛋白以提高检测灵敏度,并优化相关理化条件,使该方法能够以低至10-1μg∙mL-1的浓度检测到黄曲霉菌,与王婷的检测限(1 μg∙mL-1)相比,灵敏度提高了10倍。并对易感染黄曲霉菌的花生、玉米进行加标回收试验,证明该方法可应用于实际农产品中黄曲霉菌的检测与分析。
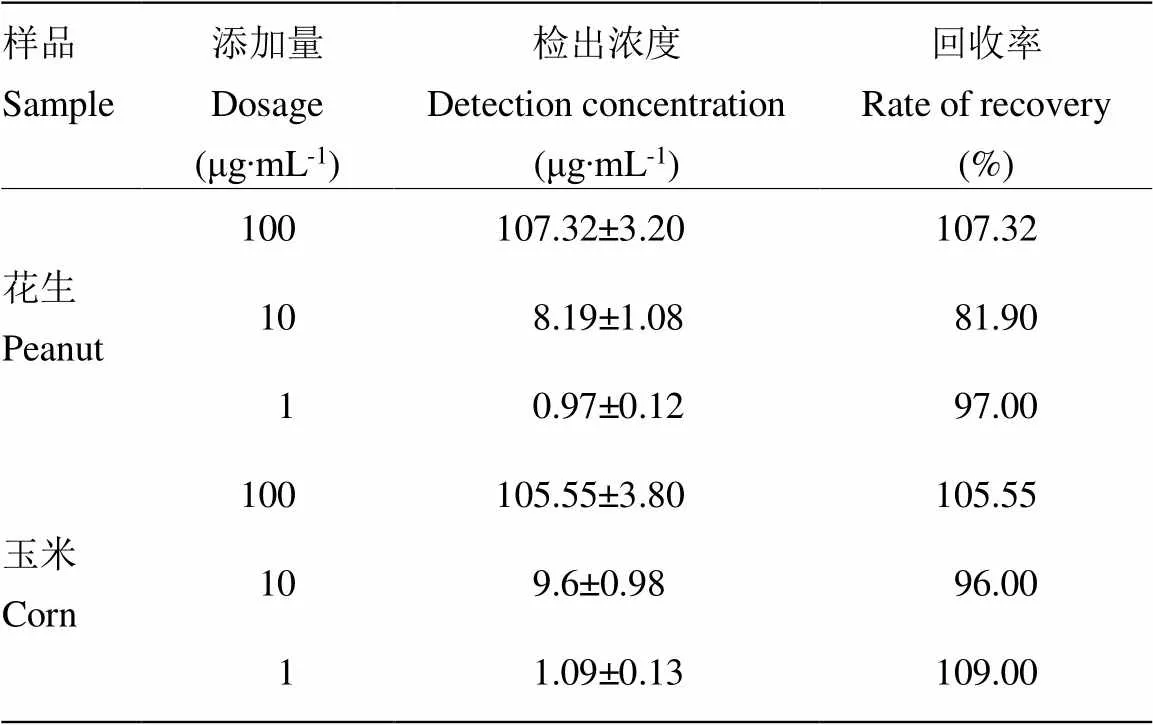
表5 添加样品回收率
结果为3 d间测定结果的平均值The result is the average value of 3 days
不同的黄曲霉菌株产毒力有差别,现有的检测方法大多需要培养黄曲霉菌若干天才能检测毒素,这样一方面浪费时间,另一方面容易产生误差,所以需要研究一种快速鉴别菌株产毒力的方法。本研究用纳米抗体作捕获抗体的灵敏度未及XUE等[27]用单链抗体作捕获抗体的灵敏度。但纳米抗体分子量(15 kD)明显小于单链抗体(25 kD),不易聚集且更加稳定[40-41],这对于利用纳米抗体建立黄曲霉分子预警技术具有重要意义。
4 结论
本研究采用黄曲霉菌干菌丝作为抗原,黄曲霉毒素产毒菌标识性分子PO8蛋白的纳米抗体作为捕获抗体,菌多抗作为检测抗体,通过增大免疫反应体系容量和优化系列反应条件,研究建立了一种大容量反应体系的夹心ELISA检测方法,对黄曲霉菌的检测限可达0.1 μg∙mL-1,灵敏度比前期报道的常规反应容量方法提高了约10倍。因此,本研究建立的检测方法具有灵敏度高、特异性强、重复性好的特点,为从源头上控制农产品黄曲霉毒素污染提供了关键方法。
[1] Cavaliere C, Foglia P, Guarino C,Nazzari M, Samperi R, Lagana A. A sensitive confirmatory method for aflatoxins in maize based on liquid chromatography ionization tandem mass spectrometry., 2007, 21: 550-556.
[2] ELLIS W O, SMITH J P, SIMPSON B K, OLDHam J H. Aflatoxins in food: Occurrence, biosynthesis, effects on organisms, detection, and methods of control., 1991, 30: 403-439.
[3] CANDISH A A G, WIBOWO M S, SMITH J E. Immunoassay identification ofusing monoclonal antibodies raised to the whole cell extracts.,1997, 11(1): 21-24.
[4] ARDIC M, KARAKAYA Y, ATASEVER M, DURMAZ H. Determination of aflatoxin B1levels in deep-red ground pepper using immunoaffinity column combined with ELISA., 2008, 46(5): 1596-1599.
[5] DING X X, LI P W, BAI Y Z, ZHOU H Y. Aflatoxin B1in post-harvest peanuts and dietary risk in China.,2012, 23(1): 143-148.
[6] 张奇, 李培武, 陈小媚, 周海燕, 印南日, 甘冬生. 黄曲霉毒素免疫检测技术研究进展. 农产品质量与安全, 2013, 63(3): 42-46.
Zang Q, Li P W, Chen X M, Zhou H Y, Yin N R, Gan D S. Advances in research on aflatoxin immunoassay., 2013, 63(3): 42-46. (in Chinese)
[7] WANG T, LI P W, ZHANG Q, ZHANG W, ZHANG Z W, WANG T, HE T. Determination ofpathogens in agricultural products by a specific nanobody-polyclonal antibody sandwich ELISA.,2017, 7(1): 4348.
[8] 于淑玲. 真菌的分子生物学鉴定方法. 邢台师范高专学报, 2002, 17(4): 64-65.
YU S L. How to discern fungi in molecule biology., 2002, 17(4): 64-65. (in Chinese)
[9] 王琢, 闫培生. 真菌毒素产生菌的分子鉴定研究进展. 中国农业科技导报, 2010, 12(5): 42-50.
WANG Z, YAN P S. Research progress on molecular identification of mycotoxin-producing fungi., 2010, 12(5): 42-50. (in Chinese)
[10] GEISEN R. Multiplex polymerase chain reaction for the detection of potential aflatoxin and stegmatocystin producing fungi., 1996, 19(3): 388-392.
[11] CRISEO G, BAGNARA A, BISIGNANO G. Differentiation of aflatoxin-producing and non-producing strains ofgroup., 2001, 33(4): 291-295.
[12] SOMASHEKAR D, RATI E R, ANAND S,ChandrashekarA. Isolation, enumeration and PCR characterization of aflatoxigenic fungi from food and feed samples in India., 2004, 21(6): 809-813.
[13] de RUITER G A, HOOPMAN T, AWVANDER L, Notermans S H W, Nout M J R. Immunochemical detection of Mucorales species in foods., 1992, 84(9): 229-234.
[14] YONG R K, COUSIN M A. Nonspecific enzyme-linked immunosorbent assay for molds in foods., 1995, 60(6): 1357-1363.
[15] TSAI G J, COUSIN M A. Enzyme-linked immunosorbent assay for detection of molds in cheese and yogurt., 1990, 73(12): 3366-3378.
[16] Van der horst M, SAMSON R A, Karman H. Comparison of two commercial kits to detect moulds by latex agglutination., 1992, 31: 241-245.
[17] PASSONE M A, ROSSO L C, CIANCIO A, ETCHEVERRY M. Detection and quantification ofsectionspp. in stored peanuts by real-time PCR of nor-1 gene, and effects of storage conditions on aflatoxin production., 2010, 138(3): 276-281.
[18] NOTERMANS S, HEUVELMAN C J, VAN EGMOND H P, PAULSCH W E, BESLING J R. Detection of mold in food by enzyme-linked immunosorbent assay.,1986, 49(10): 786-791.
[19] CROWTHER J R.. Totowa, New Jersey: Humana Press, 2009.
[20] YONG R K, COUSIN M A. Detection of moulds producing aflatoxins in maize and peanuts by an immunoassay., 2001, 65(1/2): 27-38.
[21] TSAI G J, YU S C. An enzyme-linked immunosorbent assay for the detection ofand., 1997, 60(8): 978-984.
[22] TSAI G J, YU S C. Detectingin cereals by an enzyme-linked immunosorbent assay., 1999, 50(3): 181-189.
[23] VILLAMIZAR R A, MAROTO A, RIUS F X. Rapid detection ofin rice using biofunctionalized carbon nanotube field effect transistors., 2011, 399(1): 119-126.
[24] PARK J W, SHON D H, KIM Y B. Application of an enzyme-linked immunosorbent assay for detecting mould contamination in agricultural commodities and comparison with conventional assays.,2003, 15(3/4): 159-166.
[25] CANdlish A A G, WIBOWO M S, SMITH J E. Immunoassay identification ofusing monoclonal antibodies raised to the whole cell extracts.,1997, 11(1): 21-24.
[26] Kwark B Y, SHON D H, KWON B J, KWEON C H, LEE K H. Detection ofandgenera by enzyme-linked immunosorbent assay using a monoclonal antibody., 2001, 11(1): 21-28.
[27] XUE S, LI H P, ZHANG J B, LIU J L, HU Z Q, HUANG T, Liao y c. Chicken single-chain antibody fused to alkaline phosphatase detectspathogens and their presence in natural samples by direct sandwich enzyme-linked immunosorbent assay., 2013, 85(22): 10992-10999.
[28] ZHANG C X, ZHANG Q, TANG X Q, ZHANG W. Development of an anti-ldiotypic VHH antibody and toxin-free enzyme immunoassay for ochratoxin A in cereals., 2019, 11(5): 280.
[29] RUSHING B R, SELIM M I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupation exposure, and detoxification methods., 2019, 124: 81-100.
[30] 解伟, 郭冉, 夏辉, 王小瑞, 李赵嘉, 李垚垚, 王美雪, 沈庆洲. 黄曲霉毒素B1对凡纳滨对虾幼虾肝胰腺抗氧化酶的损伤机制. 水产学报, 2017, 41(3): 448-455.
Xie W, Guo R, Xia H, Wang X R, Li Z J, L G G, Wang M X, Shen Q Z. Damage mechanism of aflatoxin B1on antioxidant enzyme in hepatopancreas of juvenile., 2017, 41(3): 448-455. (in Chinese)
[31] 马良, 李培武,张文. 高效液相色谱法对农产品中黄曲霉毒素的测定研究. 分析测试学报, 2007, 26(6): 774-778.
MA L, LI P W,ZHANG W. Determination of aflatoxins in agricultural products by high performance liquid chromatography., 2007, 26(6): 774-778. (in Chinese)
[32] 马良,张宇昊,李培武. LIF-HPCE法检测食品中的黄曲霉毒素B1. 食品科学, 2009, 30(10): 135-139.
MA L, ZHANG Y H, LI P W. Determination of aflatoxin B1 in food by laser induced Fluorescence-High performance capillary electrophoresis., 2009, 30(10): 135-139. (in Chinese)
[33] 王秀嫔,李培武,杨扬,张文,张奇,范素芳, 喻理, 王琳, 陈小媚, 李英, 姜俊. 液相色谱-三重串联四极杆质谱测定粮油中的黄曲霉毒素. 色谱, 2011, 29(6): 517-522.
WANG X P, LI P W, YANG Y, ZHANG W, ZHANG Q, FAN S F, YU L, WANG L, CHEN X M, LI Y, JIANG J. Determination of aflatoxins in cereals and oils by liquid chromatography-triple quadrupole tandem mass spectrometry., 2011, 29(6): 517-522. (in Chinese)
[34] 范素芳, 李培武,王秀嫔,丁晓霞, 张文,张奇. 高效液相色谱和高效液相色谱-离子阱质谱测定花生、玉米和大米中黄曲霉毒素方法比较. 食品科学, 2011, 32(12): 254-258.
FAN S F, LI P W, WANG X P, DING X X, ZHANG W, ZHANG Q. Comparison on determination of aflatoxins in peanut, corn and rice by liquid chromatography and liquid chromatography-tandem mass spectrometry., 2011, 32(12): 254-258. (in Chinese)
[35] MUYLDERMANS S, BARAL T N, RETAMOZZO V C, DE BAETSELIER P, DE GENST E, KINNE J, LEONHARDT H, MAGEZ S, NGUYEN V K, REVETS H. Camelid immunoglobulins and nanobody technology., 2009, 128(1-3): 178-183.
[36] NGUYEN V K, DESMYTER A, MUYLDERMANS S. Functional heavy-chain antibodies in Camelidae., 2001, 79(1): 261-296.
[37] MAASS D R, SEPULVEDA J, PERNTHANER A, SHOEMAKER C B. Alpaca () as a convenient source of recombinant camelid heavy chain antibodies (VHHs)., 2007, 324(1/2): 13-25.
[38] 潘欣, 蔡家麟, 王颖. 单域重链抗体的分子特征. 生物技术通讯, 2012(5): 741-745.
PAN X, CAI J L, WANG Y. Molecular characterization of single domain heavy chain antibody., 2012(5): 741-745. (in Chinese)
[39] BROISAT A, HERNOT S, TOCZEK J, DE VOS J, RIOU L M, MARTIN S, AHMADI M, THIELENS N, WERNERY U, CAVELIERS V, MUYLDERMANS S, LAHOUTTE T, FAGRET D, GHEZZI C, DEVOOGDT N. Nanobodies targeting mouse/human VCAM1 for the nuclear imaging of atherosclerotic lesions., 2012, 110(7): 927-937.
[40] WÖRN A, PLÜCKTHUN A. Stability engineering of antibody single- chain Fv fragments., 2001, 305(5): 989-1010.
[41] ABULROB A, SPRONG H, VAN BERGEN EN HENEGOUWEN P, STANIMIROVIC D. The blood-brain barrier transmigrating single domain antibody: mechanisms of transport and antigenic epitopes in human brain endothelial cells., 2005, 95(4): 1201-1214.
Improving the Sensitivity of ELISA by Large-capacity Reaction System of Aflatoxigenic Fungi-biomarker in Agro-products
WEI Xiao1,2,4, ZHANG Qi1,2,3, ZHANG Wen1,3,5, LI Hui1,2,4, LI PeiWu1,2,3,4,5
(1Oil Crops Research Institute, Chinese Academy of Agricultural Sciences, Wuhan 430062;2Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture, Wuhan 430062;3Key Laboratory of Detection for Mycotoxins, Ministry of Agriculture, Wuhan 430062;4Laboratory of Risk Assessment for Oilseeds Products (Wuhan) , Ministry of Agriculture, Wuhan 430062;5Quality Inspection and Test Center for Oilseeds Products, Ministry of Agriculture, Wuhan 430062)
【】In order to prevent and reduce the contamination byspecies from the source, a highly sensitive large-capacity reaction system DAS-ELISA was established, based on the biomarker PO8 protein of aflatoxigenic fungi. This study aimed to provide key technical support for pollution source monitoring. 【】In this study, the dry mycelium was used as a reference for the biomarker PO8 protein, the mycelia lysate made by high pressure homogenization was used as envelope antigen, the purified PO8-VHH was used as capture antibody, and rabbit polyclonal antibody againstwas used as detection antibody. The antigen and antibody were added to the 96-well microtiter plate at 200 μL/well, and the sandwich ELISA for the large-capacity reaction system was carried out. Based on the principle that the positive hole OD450nm≥1.0, the positive hole OD450nm/negative hole OD450nmwas higher to determine the optimal experimental conditions and to establish a standard curve. The performance of the established sandwich ELISA method was evaluated by spike-and-recovery test, repeatability test and specific test. 【】Assays were performed in the PO8-VHH (3 μg∙mL-1) coated ELISA format, in which the detection antibody was 2.5 μg∙mL-1diluted. The optimized physicochemical factors in the performance were obtained: the antibody coating condition was 4℃ overnight, the blocking reagent was 3% BSA, the blocking condition was 37℃ 2h, and the polyclonal antibody working time was 50 min. The standard curve was established under the optimal conditions, the minimum detectable limit was 0.1 μg∙mL-1. This method was specific, with no cross reaction with HBHA, FO, FV, and AO. Meanwhile, the inter-assay repetition rate was 1.5%-5.8% and intra-assay repetition rate was 0.4%-3.2%, both lower than 10%, indicating it was good repeatability. Non-aflatoxigenic fungi had lower values, close to negative value. 【】The large-capacity reaction system sandwich ELISA method established in this study could quickly and accurately detect aflatoxigenic fungi, which laid a foundation for further control of aflatoxin contamination from the source.
agro-products;;nanobody; ELISA; biomarker

2019-08-09;
2019-11-05
国家重点研发计划(2018YFC1602505)、国家自然科学基金(31801665)、湖北省技术创新专项重大项目(2018ABA081)、湖北省自然科学基金(2017CFB333)
魏晓,Tel:13163292893;E-mail:15621567212@163.com。通信作者张奇,E-mail:zhangqi01@caas.cn
(责任编辑 赵伶俐)

