病毒基因组测序驳斥阴谋论
Lancet Virological
病毒序列证明病原体并非来自研究所
科研人员正在公开分享更多患者的病毒基因组全序列,目前已有53例患者的病毒基因组全序列被共享在全球共享流感病毒数据库GISAID。研究人员正在对这些病毒基因组进行深入研究,试图了解2019-nCoV的起源,以及它如何与蝙蝠和其他物种中发现的相关病毒的家族系谱相联系。
武汉华南海鲜批发市场在2019-nCoV病毒传播中所起的作用仍不明确。但这种病毒序列,加上在市场环境中抽样检测证实存在该病毒,表明它确实在早期扩大疫情的爆发上,起到了推波助澜的作用。
2019-nCoV总共有近29000个核苷酸碱基,这些碱基保存着繁殖这种病毒的遗传指令。虽然它是许多基因以RNA形式存在的病毒之一,但科学家们将病毒基因组转换成DNA,其碱基简称为A、T、C和G,以便于研究。中国研究人员共享这些序列,使世界各地的公共卫生实验室得以开发自己的病毒诊断方法。目前,已有18个国家发现了这种病毒。
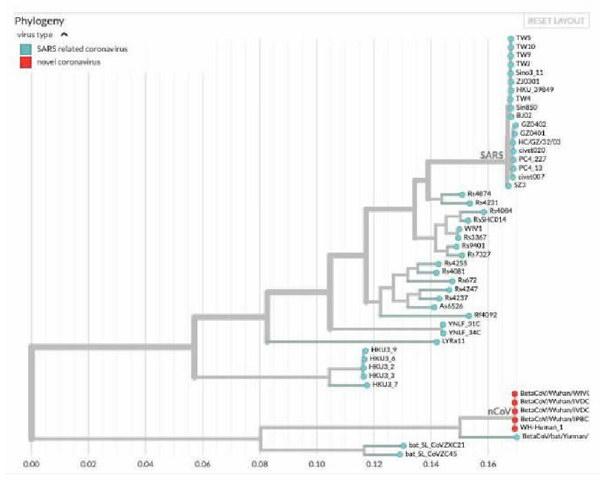
美国华盛顿大学医学系和基因组科学系副教授贝德福德分析,石正丽团队指出的蝙蝠冠状病毒序列被称为RaTG13,与2019-nCoV有近1100个核苷酸的差异
贝德福德对RaTG13和2019-nCoV的分析表明,这两种病毒在25到65年前有一个共同的祖先。这是他通过结合病毒之间核苷酸的差异和其他冠状病毒的假定突变率得出的估计,RaTG13病毒突變为2019-nCoV可能需要几十年的时间。
一种病毒在人群中传播的时间越长,就有更多的时间来发展变异,从而区分受感染人群中的病毒株。考虑到目前为止分析的2019-nCoV序列彼此之间最多有7个核苷酸的差异,这表明它是最近才进入人类体内的。
海鲜市场是否源头尚未确定
美国国家过敏和传染病研究所研究蝙蝠、骆驼和其他物种冠状病毒的病毒学家Vincent Munster说:“蝙蝠身上检测到的病毒和现在在人类身上分离出的病毒之间有一个非常大的灰色区域。”
证据表明海鲜市场在2019-nCoV的传播中起了早期作用,但它是否疫情爆发的源头仍不确定。许多最初确认的2019-nCoV病例——一份报告中第一批41个病例中有27个、另一份报告中47个病例中有26个病例都与武汉市场有关,但高达45%的病例与武汉海鲜市场无关。
关于病毒究竟是在哪里首次传染给人类,有一个可能的解释是,如果有一批近期被感染的动物在不同的市场上出售,或者一个受感染的动物贩子可能把病毒传播给不同市场的不同人。
贝德福德认为,这些早期病例可能感染了不易传播出去的病毒。他说:“只要从市场(环境采样)中提取一两个序列,就能说明有多少人畜共患病,以及它们是什么时候发生的,这将非常有帮助。”
研究小组将洞穴里的蝙蝠的粪便和身体样本送到病毒学研究所,以寻找病毒
“人工合成”经不起推敲
2月18日,Scripps研究所的著名病毒进化学家Kristian Andersen也在virological.org上发文反驳新冠病毒“人工合成”阴谋论。
作者通过对可用基因组序列数据的比较分析推导出新冠病毒的起源和早期进化方法,并提供了有关新冠病毒基因组中显著特征的观点,基于此讨论可能出现这些特征的场景要求。最重要的是,该论文分析可以提供证据表明,新冠肺炎病毒不是人工合成的。
(a)SARS-CoV-2剌突蛋白接触残基的突变。将SARS-CoV-2的刺突蛋白与最密切相关的SARS样CoV和SARS-CoV-1进行比对。在SARS-CoV-2和SARS-CoV Urbani菌株中,尖峰蛋白中与ACE2受体接触的关键残基都用蓝框标记。(b)获得多元裂解位点和O-连接的聚糖。多元裂解位点标记为灰色,三个相邻的预测的O-连接的聚糖标记为蓝色。多元裂解位点和O-连接的聚糖都是SARS-CoV-2特有的,以前在谱系B beta冠状病毒中没有见过。
论文对图中描述的α和B冠状病毒(Coronavirida家族)的基因组进行了比较,以此确定新冠病毒基因组所具有的两个明显特征。
1.基于结构模型和早期生化实验可知,新冠病毒针对的是人与ACE2(宿主细胞受体血管紧张素转化酶2)受体结合;
2.病毒在S蛋白的2个亚基S1/S2交界处有一个预测的多碱基切割位点。因此Andersen先从SARS-CoV与ACE2结合最重要的RBD(受体结合结构域)的6个氨基酸残基:Y442、L4772、N479、D480、T487、Y4911入手。
他发现:病毒的相应残基为L455、F486、S494、N501、Y505,与蝙蝠冠状病毒RaTG13相比,有5个不同。新冠病毒S蛋白中第486位残基的苯丙氨酸(F)对应于SARS-CoV Urbani株中的L472,但F486并不是计算生物学预测时该位置点最优化的氨基酸选择。
并且,病毒的RBD中几个关键氨基酸残基与计算生物学预测的最适合结合人ACE2受体的氨基酸残基也完全不同。所以Andersen认为,从病毒S蛋白结构特征来看,新冠病毒并非通过算法所预测最优化的,而更像是自然选择的。
其次,病毒第2个明显的特征是在S蛋白的2个亚基S1/S2交界处Furin蛋白酶切割位点(RRAR),除了两个碱性精氨酸和一个切割位点的丙氨酸之外,还插入了一个脯氨酸。
脯氨酸插入产生的转角结构导致Furin蛋白酶切割位点侧翼的S673、T678、S686发生添加O末端糖基化,而以前的β冠状病毒均无Furin蛋白酶切割位点。
从SARS-CoV的体外实验中可知,在S1/S2交界处突变出这样的位点,可以增强细胞一细胞融合,但并不影响病毒进入。另外3个预测的O末端糖基化潜在功能还不清楚,但值得一提的是,它们可以产生一个“黏蛋白样结构域”,该结构域可以屏蔽新冠病毒S蛋白上的潜在表位或者关键残基。
但病毒在体外培养体系中连续传代极难同时获得Furin蛋白酶切割位点和O末端糖基化。
第三个论据是病毒的宿主。新冠肺炎病毒与蝙蝠冠状病毒RaTG13非常相似,目前初步分析表明,非法进口到广东的马来穿山甲可能是新冠肺炎病毒的中间宿主。
马来穿山甲的冠状病毒在6个关键RBD残基上都与新冠肺炎病毒相同,但不同的是,马来穿山甲的病毒不具有Furin蛋白酶切割位点,这意味着新冠肺炎病毒可能存在其他中间宿主,病毒在这些宿主身上形成了Furin蛋白酶切割位点,然后才传播给了人。
而病毒要在中间宿主身上实现这种进化的话,新冠肺炎病毒的中间动物宿主必然具有极高的密度,这样自然选择才能快速发生。因此从新冠肺炎病毒的S蛋白结构特征、早期进化以及人工合成所具备的条件等方面来看,新冠肺炎病毒是自然的选择,而不是合成的。