肉桂酸对豇豆根系毒害作用的研究
王 丰 王馨悦 朱强龙 杨有新 王 强 吴才君
(江西农业大学,江西 南昌 330045)
自毒物质是一种特殊的化感物质,来自植株的根系分泌物、雨水淋溶以及残株腐解[1-2]。采用多种不同生物学方法测定发现自毒物质对植株自身的生长发育有一定抑制作用,会对作物连作造成严重障碍[3-6],这一现象及其作用机理一直受到国内外学者的广泛关注。豆类极易发生连作障碍[7],豇豆(Vigna unguiculataL.Walp.)作为重要的豆类蔬菜,在世界各地广泛种植[8-10]。随着效益农业的发展,一些蔬菜基地在产业化生产中常年连续种植豇豆,导致连作障碍问题日益突显[11-12]。分析自毒物质的作用机理有助于进一步探明连作障碍的成因,为深入研究相关克服途径提供一定的理论基础[13]。黄兴学[14]对豇豆连作土壤中自毒物质的种类和成分进行了鉴定和分析,结果表明,肉桂酸、苯乙酸、邻苯二甲酸和4-羟基苯甲酸在连作土壤中的积累是豇豆连作障碍的一个重要因素,且肉桂酸可以通过抑制RuBP 羧化酶活性来影响光合速率。肉桂酸作为豇豆的主要自毒物质之一[15],目前关于其对豇豆毒害作用的研究主要集中在地上部分,对豇豆根系影响的研究鲜有报道。因此,本试验选取2个抗性差异的豇豆品种,采用水培法,于营养液中施加一定浓度的肉桂酸,通过测定和分析其根系生理形态和生理指标的变化,探究肉桂酸对豇豆根系的影响,以期为肉桂酸及其他自毒物质对豇豆根系毒害作用的深入研究奠定理论基础。
1 材料与方法
1.1 材料
供试豇豆为连作障碍抗性品种特早30号(TZ30)和敏感品种紫秋豇6号(ZQJ6),均由华农种业有限公司提供。
1.2 仪器与设备
5810R 离心机(艾本德,德国);HI 2315 电导率仪(哈纳,意大利);UV-2600 紫外分光光度计(岛津,日本);LA2400 根系扫描仪(Regent,加拿大);SPX-50智能生化培养箱(杭州绿博仪器有限公司);KQ-500B超声波清洗器(昆山市超声仪器有限公司)。
1.3 试验方法
整个试验除发芽期均在培养室进行,光周期为14 h/10 h(day/night),温度设定25℃/20℃(day/night)。选取颗粒饱满、大小均匀的豇豆种子,温汤浸种15 min后置于28℃恒温培养箱催芽。种子发芽后放入5×10孔的穴盘育苗,培养基质为珍珠岩。豇豆长至两叶一心时选大小一致的幼苗进行水培,营养液为霍格兰改良配方[16]。豇豆长至五叶一心时分4组处理(a~d),每组2 盆,每盆15株,具体处理为:a 处理:种植TZ30,于营养液中加0.2 mmol·L-1肉桂酸,该浓度的设定与处理方法参考高旭等[17]的研究;b 处理:种植TZ30,于营养液中加相同体积的无菌水,作为对照组;c 处理:种植ZQJ6,于营养液中加0.2 mmol·L-1肉桂酸;d 处理:种植ZQJ6,于营养液中加相同体积的无菌水,作为对照组。处理36 h 取根系测定电导率、可溶性蛋白含量及抗氧化酶活性,每株为一个重复,取3个重复。处理5 d 对其表型拍照并取根系采用根系扫描仪进行扫描。电导率采用浸泡法测定[18],可溶性蛋白含量采用考马斯亮蓝G-250 染色法测定[19],超氧化物歧化酶(superoxide dismutase,SOD)采用氮蓝四唑(nitro-blue tetrazolium,NBT)法[20]测定,过氧化物酶(peroxidase,POD)采用愈创木酚法[21]测定,抗坏血酸过氧化物酶(aseorbateperoxidase,APX)采用分光光度法[22]测定。
1.4 数据分析
采用SPSS Statistics 17 进行数据分析,采用Duncan 法和LSD 法对数据进行单因素方差分析和多重比较;采用Origin 8.1 绘图。
2 结果与分析
2.1 肉桂酸处理对豇豆幼苗根系生长的影响
由图1可知,0.2 mmol·L-1肉桂酸处理后TZ30和ZQJ6 根系生长均受到了抑制,根系减小发黄。由表1可知,经0.2 mmol·L-1肉桂酸处理后,2种豇豆的总根长、总根表面积、总根体积、总根尖数均减少,说明肉桂酸对豇豆根系生长有明显抑制作用。与对照相比TZ30的总根长、总根表面积、总根体积、总根尖数分别显著减少59.99%、57.70%、55.28%、38.40%;ZQJ6的总根长、总根表面积、总根体积、总根尖数分别显著减少65.47%、62.52%、59.04%、38.67%,表明TZ30 对肉桂酸的自毒抗性强于ZQJ6。经0.2 mmol·L-1肉桂酸处理后,TZ30的平均根系直径增加6.03%,但无显著性差异(P>0.05);ZQJ6 平均根系直径显著增加9.89%(P<0.05),表明肉桂酸对豇豆根系影响主要在幼嫩根系部位,TZ30 抗性较高。
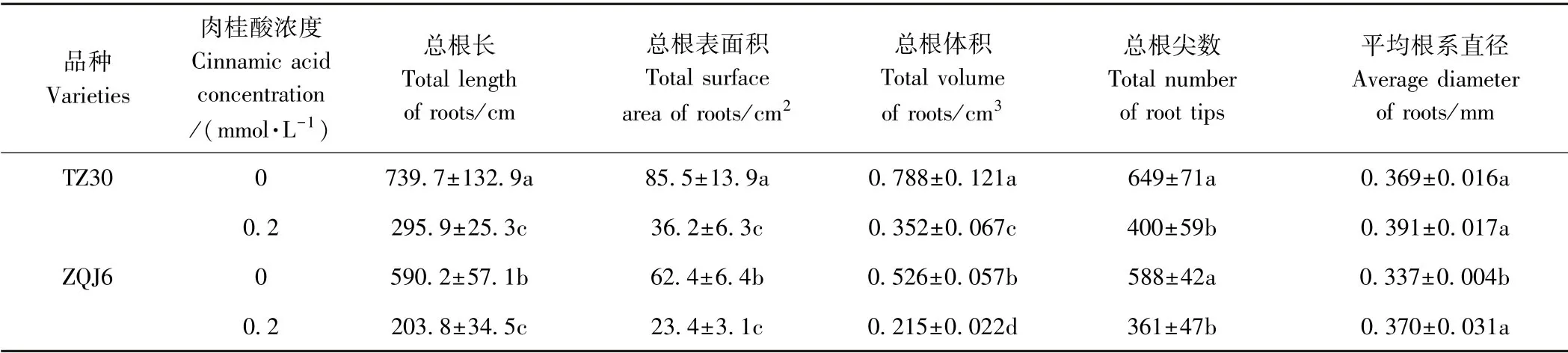
表1 肉桂酸对豇豆根系形态指标的影响Table1 Effect of cinnamic acid on morphological index of roots system of cowpea
2.2 肉桂酸处理对豇豆幼苗根系相对电导率的影响
相对电导率是反映植物质膜系统生理生化状况的重要指标之一。植物在逆境或受到其他损伤的情况下细胞膜容易破裂,膜蛋白受损而使细胞内的胞液外渗导致相对电导率增加。由图2可知,经0.2 mmol·L-1肉桂酸处理后,2种豇豆的相对电导率均增加,其中TZ30、ZQJ6的相对电导率分别较对照显著增加158.21%、131.08%(P<0.05),表明经由桂酸处理豇豆根系质膜系统受到严重破坏,且TZ30 受到的破坏更严重。
2.3 肉桂酸处理对豇豆幼苗根系可溶性蛋白含量的影响

图1 肉桂酸处理对豇豆生长的影响Fig.1 Effects of cinnamic acid treatments on growth of cowpea
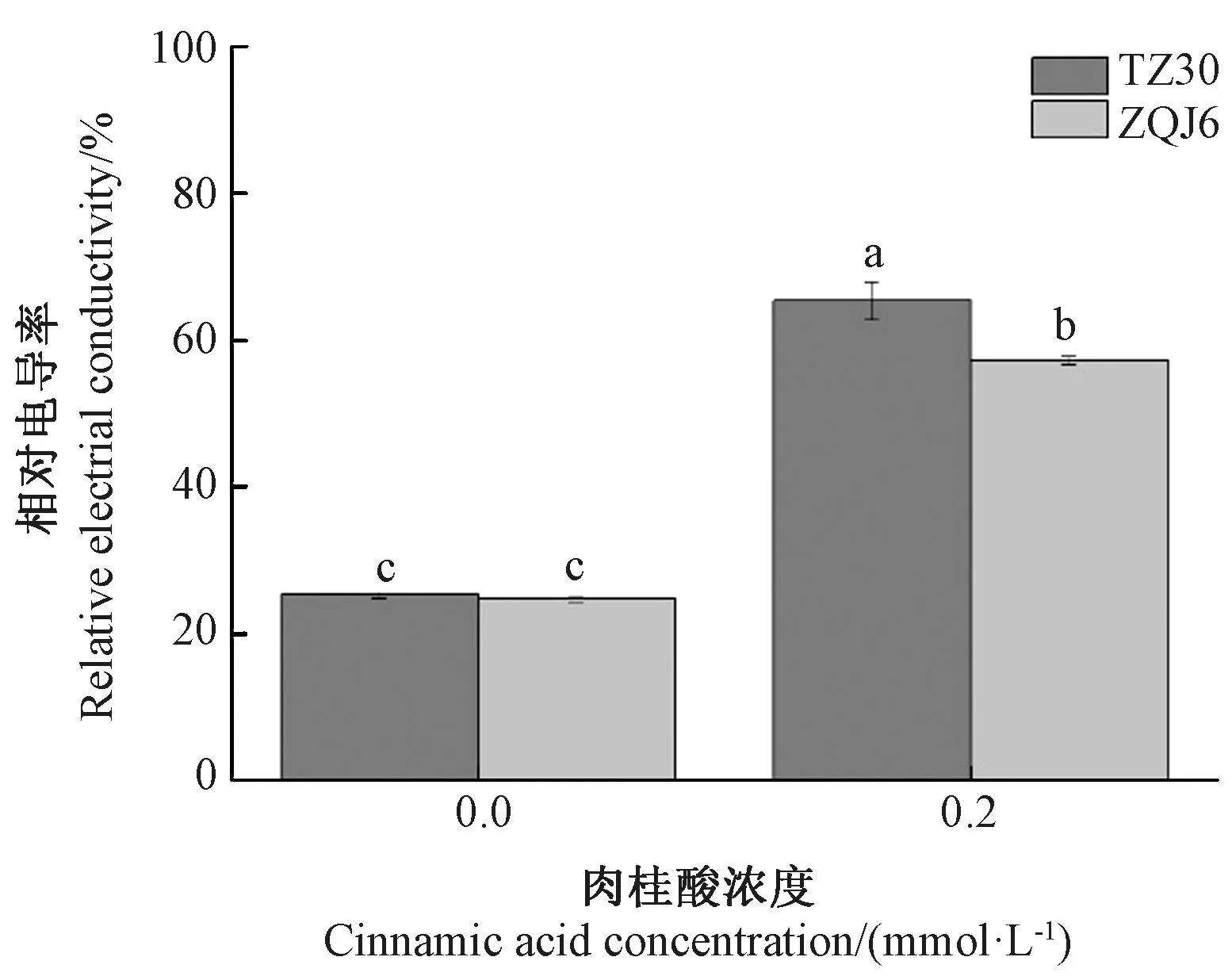
图2 肉桂酸处理对豇豆根系相对电导率的影响Fig.2 Effects of cinnamic acid treatments on relative electrical conductivity in roots of cowpea
可溶性蛋白是重要的渗透调节物质和营养物质,其含量增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用。由图3可知,经0.2 mmol·L-1肉桂酸处理后,2种豇豆的可溶性蛋白含量均降低。TZ30、ZQJ6的可溶性蛋白含量分别降低了58.60%、43.73%,均与对照差异显著(P<0.05),表明经肉桂酸处理豇豆根系细胞结构受到严重破坏,且TZ30 受到的破坏更严重。

图3 肉桂酸处理对豇豆根系可溶性蛋白的影响Fig.3 Effects of cinnamic acid treatments on soluble protein content in roots of cowpea
2.4 肉桂酸处理对豇豆幼苗根系抗氧化酶活性影响
由图4可知,经0.2 mmol·L-1肉桂酸处理后,TZ30和ZQJ6的SOD、POD和APX 活性均升高,其中TZ30的SOD、POD和APX 活性分别增加124.30%、85.85%和47.48%,与对照差异显著(P<0.05);ZQJ6的SOD活性增加32.93%,与对照无显著性差异(P>0.05),POD和APX 活性分别增加50.79%和36.88%,与对照差异显著(P<0.05),表明豇豆可以通过提高抗氧化酶的活性来抵抗肉桂酸的自毒作用,且TZ30 对肉桂酸的自毒抗性强于ZQJ6。
3 讨论
豇豆作为我国重要的蔬菜作物[23-25],连作障碍是制约豇豆产业发展的突出问题,而自毒作用是豇豆连作障碍的主要原因之一[26]。探究豇豆自毒物质的毒害作用和机理对克服豇豆连作障碍具有重要意义。有研究表明自毒物质首先会作用于豇豆根系[14]。本试验采用的水培法,相对于土培,能直观地显示出自毒物质肉桂酸对豇豆根系的毒害作用,根系取样方便完整,便于进行更深入的研究。
黄兴学[14]研究发现,大田环境下肉桂酸会抑制连作豇豆的生长发育,影响豇豆的单株产量、株数及总产量,且肉桂酸对豇豆的自毒作用首先作用于根系,然而其研究主要集中在地上部分和根际土。本试验进一步研究发现,经0.2 mmol·L-1肉桂酸处理后,TZ30和ZQJ6 根系生长均受到明显抑制,2个品种的总根长、总根表面积、总根体积、总根尖数均显著降低,说明肉桂酸对豇豆根系生长有明显的抑制作用。在肉桂酸对豇豆根系生长的影响中,TZ30的总根长、总根表面积、总根体积、总根尖数的降幅均小于ZQJ6,说明TZ30 对肉桂酸的自毒抗性强于ZQJ6。肉桂酸处理后,2种豇豆的平均根系直径均表现为增加趋势,其中TZ30 与对照无显著性差异,ZQJ6 差异显著,说明TZ30 抗性较高,且表明肉桂酸对豇豆根系影响主要在幼嫩根系部位。

图4 肉桂酸处理对豇豆根系抗氧化酶活性的影响Fig.4 Effects of cinnamic acid treatments on antioxidant enzyme activity in roots of cowpea
植物细胞膜对维持细胞的微环境和正常代谢起着重要作用,当植物受到逆境胁迫时,细胞膜遭到破坏,膜透性增大,从而使细胞内的电解质外渗,相对电导率增大[27-28]。植物体内的可溶性蛋白大多数是参与各种代谢的酶类,其含量是植物体总代谢水平的一个重要指标[29]。逆境胁迫下可溶性蛋白的合成受到抑制,且分解加速[30]。本试验结果表明,经肉桂酸处理后,2种豇豆的相对电导率均显著增加,可溶性蛋白含量均显著下降,说明2种豇豆的根系细胞结构均受到了明显损坏,其中TZ30 相对电导率增加更多,可溶性蛋白含量下降更多,说明经肉桂酸处理后,TZ30的细胞结构受到的破坏更严重。
豇豆可以通过提高自身抗氧化酶系统的活性来抵抗逆境胁迫。杜世章等[31]研究表明,豇豆幼苗通过提高抗氧化酶系统活性来抵抗NaCl的胁迫作用。于力[32]研究表明豇豆通过提高抗氧化酶活性来抵抗铝胁迫作用。肉桂酸对豇豆的毒害作用和逆境胁迫有共通之处,在自毒物质作用下,植物体内直接或间接形成过量的活性氧自由基,其对细胞大分子物质如膜系统、蛋白质、脂类和核酸等具有很强的破坏作用,使得植物生长受阻,此时在植物体内会有酶促防御系统及非酶机制来清除体内多余的自由基,该防御系统实际上是一个抗氧化系统,通过提高抗氧化酶活性,来加强植物的抗氧化作用,从而提高其对逆境的抗性,减轻自由基毒害[33]。SOD、POD和APX是植物体内抗氧化防御体系中重要的保护酶类[34]。本研究表明,经肉桂酸处理后,2种豇豆的3种酶活性均显著升高,说明豇豆也通过提高抗氧化酶的活性来抵抗肉桂酸的自毒作用。在TZ30 细胞结构受损更严重的情况下,其SOD、POD和APX 活性均较ZQJ6 提高更多,说明TZ30 对肉桂酸的自毒抗性强于ZQJ6。
4 结论
本研究结果表明,自毒物质肉桂酸阻碍豇豆的根系生长。主要表现为:肉桂酸显著降低了豇豆根系的总根长、总根表面积、总根体积、总根尖数,对豇豆根系的破坏首先集中在幼嫩根系。肉桂酸会破坏豇豆根系细胞质膜的完整性,降低根系可溶性蛋白的含量,提高抗氧化酶活性。但对2种抗性不同的豇豆(TZ30和ZQJ6)根系的生长有着不同程度的影响,这些差异表明TZ30 较ZQJ6 表现出更高的自毒作用抗性,这些差异还可以用来检测鉴定豇豆对肉桂酸等自毒物质的抗性,辅助豇豆育种中选育耐连作障碍的优良品种。后续可进行基因层面研究,为肉桂酸等自毒物质对豇豆根系的毒害作用的深入研究奠定理论基础。

