黑龙江地区芍药红斑病病原鉴定及室内药剂筛选1)
陈悦 翟亚娟 刘丽玲 冯玉娟 孙于淼白庆荣
(吉林农业大学,长春,130118) (辽源市农业科学院) (长春海关技术中心) (黑河市爱辉区气象局) (吉林农业大学)
芍药(PaeonialactifloraPall.)属毛茛目、毛茛科芍药属多年生草本植物,花朵艳丽,被人们誉为“花仙”和“花相”,且被列为“十大名花”之一,又被称为“五月花神”,其根部又是常用的药材。芍药的观赏价值与药用价值一直以来都备受关注[1]。近几年来,在东北各地区发展药用植物种植产业力度不断增大,尤其是药用芍药的种植面积也在不断扩大,但在其引种栽培、广泛种植及中药材的贮存运输过程中,往往遭受到各种病害的危害,严重影响药材品质。2017年,黑龙江芍药主产区大范围发生芍药红斑病害,发病地区达98%,已成为威胁芍药栽培的主要病害。目前迫切需要对芍药红斑病的病原进行鉴定,并进行室内药剂筛选,为该病害诊断和防治提供依据和资料。
1 材料与方法
1.1 材料
供试芍药红斑病标本采自黑龙江省哈尔滨、大庆、齐齐哈尔和黑河市。
1.2 方法
芍药红斑病症状描述:观察各地区芍药红斑病的典型症状,记录发病特点,并拍照保存。
病原菌的分离:将采集的病叶用清水冲洗干净,剪取病健交界处的病害组织若干块,大小为0.3 cm×0.3 cm,先放到体积分数70%酒精中消毒1 min,再放到体积分数0.1%氯化汞中消毒0.5 min,之后再用无菌水反复冲洗3次,待组织块吹干,放置于PDA平板培养基上,每皿放4块,在恒温培养箱内25 ℃培养[2]。
致病性测定:将病原菌在PDA培养基上纯化培养10~14 d,待病原菌产生分生孢子后,将其用无菌水洗下,配置成浓度为106个·mL-1的孢子悬液。用灭菌的喷雾器将配置好的孢子悬液喷洒到已消毒的健康植株叶片上,对照植株上喷无菌水,每个处理重复3次,套上透明塑料袋保湿培养3 d后,逐日观察发病情况[3]。发病后对植株病组织再进行分离,比较与其最初分离到的病原菌是否一致。
病原菌鉴定:将纯化的菌株移至PDA平板中央,25 ℃恒温培养,观察病原菌的生长状况和菌落形态,并用显微镜来观察孢子形态,测量孢子大小,拍照并记录。用CTAB法[4-5]提取菌株DNA。以ITS4/ITS5(5′-TCCTCCGCTTATTGATATGC-3′/5′-GGAAGTAAAAGTCGTAACAAGG-3′)为引物进行PCR扩增[6],扩增产物送至生工生物工程(上海)股份有限公司进行测序,将测序所得的rDNA-ITS序列递交GenBank,并与GenBank中核酸数据库(http://www.ncbi.nlm.nih.gov/blast/)中的ITS区相关序列进行同源性比较。
室内药剂筛选:供试菌株M-1,由吉林农业大学植物保护学院植物病理实验室分离鉴定并保存。试验选用化学农药共计11种,分别为体积分数25%吡唑醚菌酯EC、质量分数50%醚菌酯WG(巴斯夫(中国)有限公司);质量分数5%亚胺唑WP(北兴化学工业株式会社);250 g·mL-1苯醚甲环唑EC、250 g·L-1嘧菌酯SC(先正达作物保护有限公司);质量分数50%多菌灵WP(江苏蓝丰生物化工股份有限公司);体积分数40%氟硅唑EC(广东中讯农科股份有限公司);体积分数45%咪鲜胺ME(深圳诺普信农化股份有限公司);质量分数80%代森锰锌WP(利民化工股份有限公司);430 g·L-1戊唑醇SC(拜耳作物科学有限公司);质量分数40%腈菌唑WP(运城绿康实业有限公司)。
试验采用孢子萌发法分别比较病原菌孢子对不同质量浓度的不同种类药剂的敏感性。将9 mL定量WA培养基置于三角瓶中,灭菌。将不同药剂配制成1×104mg·L-1的原液依次梯度稀释成1×103、1×102、1×10、1.0、1×10-1mg·L-1。用移液枪分别吸取各浓度药剂1.0 mL,分别打入三角瓶中,混匀后倒入平板。各个药剂处理重复3次。以等量的无菌水代替药剂作为空白对照。取在PDA培养基上培养7 d的病原菌,用无菌水配置成孢子悬液(106个·mL-1),吸取0.1 mL于平板上,用玻璃三角涂布器涂抹均匀。置于恒温培养箱中25 ℃培养,根据预试验结果,18 h后进行观察。以芽管长度超过孢子最大直径长度的一半作为该孢子萌发的标准[7]。当对照平板上孢子萌发率达到90%以上时,将所有平板放置4 ℃冷藏,终止平板内孢子的萌发,之后对该药剂不同质量浓度下的孢子萌发率进行统计,计算孢子萌发抑制率[8-9]。
孢子萌发抑制率=((对照孢子萌发数-处理孢子萌发数)/对照孢子萌发数)×100%[10]。
2 结果与分析
2.1 芍药红斑病的症状
发病初期叶片上出现紫红色小斑点(图1A),后扩展成不规则大斑,病斑不受叶脉限制,可连片生长,叶正面为暗紫红色,叶背面为褐色,后期病斑中间成焦枯状,多数可见轮纹,严重时整个叶片焦枯死亡。雨后空气潮湿,叶背面会产生墨绿色霉层,即为病原菌的分生孢子梗和分生孢子。病原菌也可侵染茎秆(图1B),初期产生红色不规则小斑点,后期扩展可连片,病斑处轻微凹陷。

图1 芍药红斑病的发病症状
2.2 标本来源及病原菌的分离
对2017年采自黑龙江地区的芍药红斑病标本进行分离培养,得到6个地区117个真菌菌落,其中杂菌菌落为16个,疑似病原菌菌落为101个,详见表1。
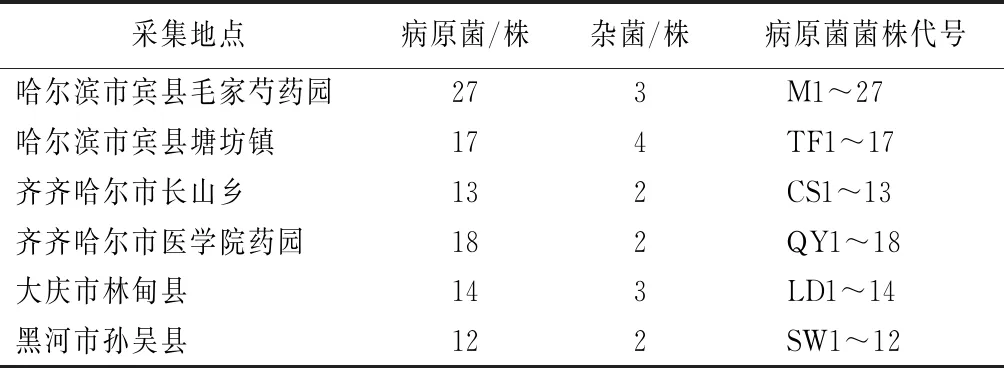
表1 芍药红斑病病原菌分离结果
2.3 芍药红斑病的致病性
对代表菌株M-1、TF-1、CS-1、QY-1、LD-1、SW-1的致病性观察结果(图2)表明:接种10 d后,植物发病症状与田间自然发病症状相同,对照组健康无发病症状。对发病部位进行病菌的再分离,得到的病原菌与田间发病叶片上分离得到的病原菌一致。根据柯赫氏法则可证明该病原菌为芍药红斑病的致病菌。
2.4 芍药红斑病病原菌的鉴定
2.4.1 形态学和培养特性
将纯化菌株置于PDA平板培养基中央,在25 ℃条件下培养。3 d后,菌丝开始生长,逐渐形成墨绿色毛毡状菌落,菌落颜色随生长而不断加深,菌落生长速度缓慢,10 d菌落直径仅达20.0 mm(图3A、B)。显微镜下观察,分生孢子梗无色至浅褐色,具1~6个分隔,(3.4~5.9)μm×(89.2~165.8)μm,平均为4.3 μm×131.4 μm;分生孢子链生,大小差异较大,圆柱形、卵圆形或柠檬形,浅褐色,表面光滑,(3.2~6.2)μm×(5.3~13.4)μm,平均为4.6 μm×8.8 μm(图3C-E)。
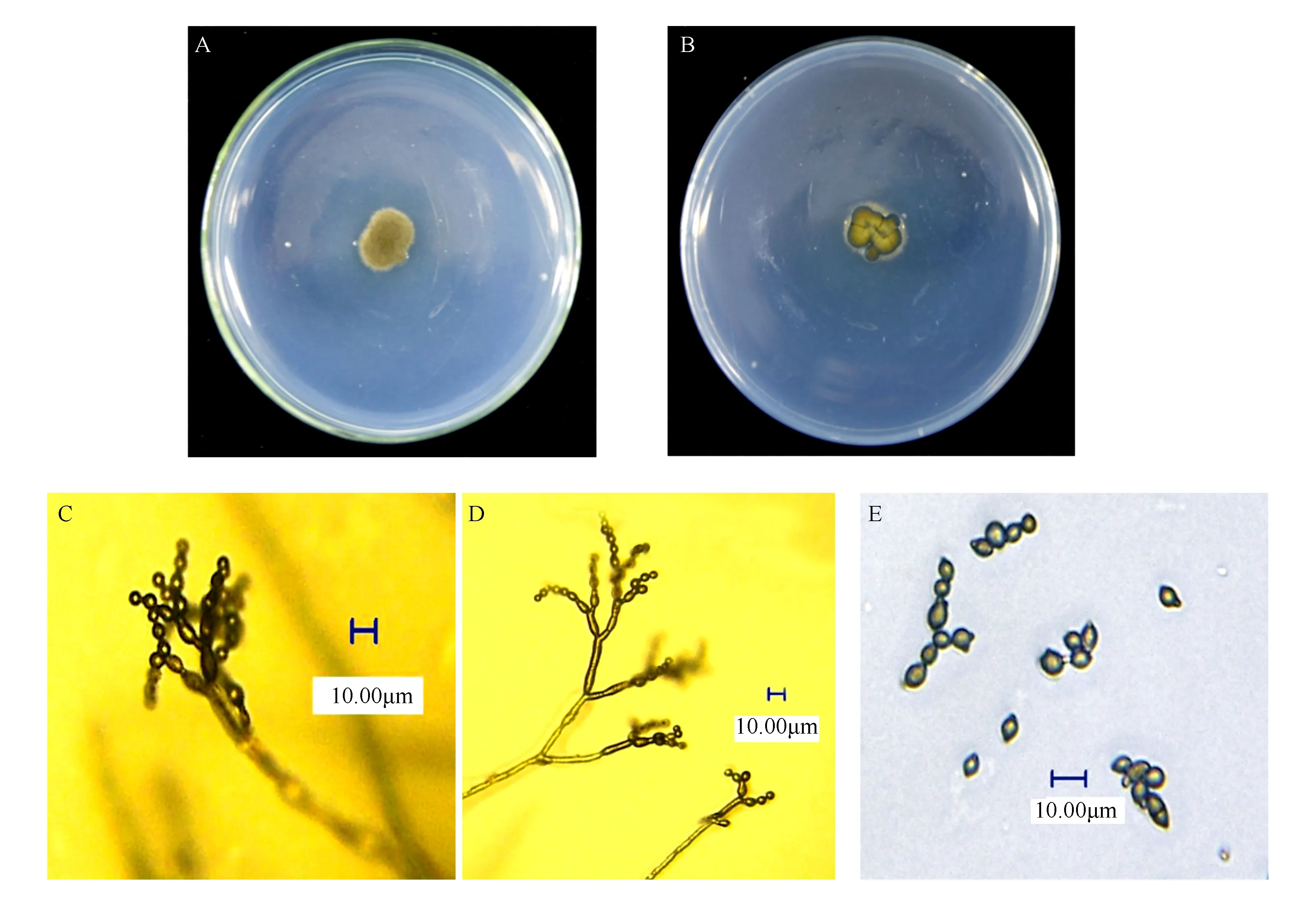
A、B.菌落在PDA上的培养特征(A.正面;B.背面);C、D.分生孢子链;E.分生孢子。
2.4.2 rDNA-ITS序列
利用真菌特异性引物ITS4/ITS5对代表菌株进行PCR扩增。扩增出1条约600 bp的片段。经生物公司测序结果为628 bp的核苷酸序列,GenBank提交后的登录号为MH119050。将测序结果与GenBank中已有的相关序列进行同源性比对,结果表明,与登录号EU009455的菌株Graphiopsischlorocephala同源性达100%。结合形态学特征和培养特性[11],鉴定芍药红斑病的病原菌为Dichocladosporiumchlorocephalum(有性态:Graphiopsischlorocephala)。
2.5 室内药剂筛选
由表2可知,所选的11种杀菌剂对病原菌的孢子萌发均有抑制作用。病原菌对体积分数25%吡唑醚菌酯EC的敏感性最好,其EC50<0.1 mg·L-1;对质量分数80%代森锰锌WP的敏感性较好,0.1 mg·L-1
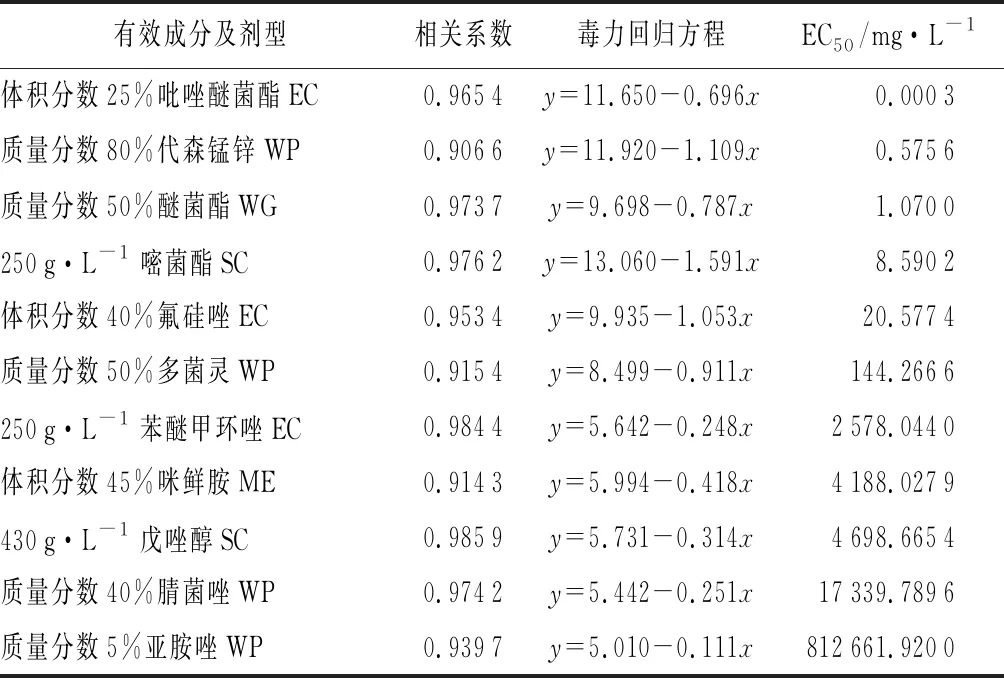
表2 芍药红斑病病原菌孢子萌发对11种杀菌剂的敏感性
3 结论与讨论
本试验对黑龙江地区芍药红斑病的症状进行了描述,对红斑病病菌进行了分离、纯化及致病性测定,再分离得到的结果进一步证实所获得的分离物为该病害的致病菌。结合病原形态学特征、培养学性状以及rDNA-ITS序列分析测定结果,确定其致病菌为Dichocladosporiumchlorocephalum。
1983年蓝莹等对南京各公园芍药红斑病进行了调查,通过病原菌分离纯化和接种试验确定该病由CladosporiumpaeoniaePass.引起[12]。在2014年李丽等对山东菏泽与泰安两地的芍药红斑病进行了病原鉴定试验,最终确定山东的芍药红斑是由Alternariaalternata和A.tenuissima复合侵染所引起的[13]。这表明在不同地区、不同的气候条件下某些病害的致病菌可能存在一定的差异。
Dichocladosporiumchlorocephalum菌丝生长速度缓慢,10 d菌落直径仅有20.0 mm。采用菌丝生长速率法进行药剂敏感性研究,费时费力且不科学,因此本试验采用孢子萌发法对病原菌进行了药剂敏感性测定。结果表明,该病原菌对体积分数25%吡唑醚菌酯EC、质量分数70%代森锰锌WP、质量分数50%醚菌酯WG、250 g·L-1嘧菌酯SC敏感性较高,EC50<10 mg·L-1。这为该病害的防治提供了一些备选杀菌剂,并为药剂的轮换使用和延缓抗药性奠定基础。因未进行田间试验,田间防效还有待进一步考证。

