琥珀酸脱氢酶缺陷型肾癌1 例
林 昊,李浩然,谭万龙
南方医科大学南方医院 泌尿外科,广东广州 510515
琥珀酸脱氢酶(succinate dehydrogenase,SDH)缺陷型肾癌是2016 版WHO 肾肿瘤分类收录的一种新的肾细胞癌亚型,最早于2004 年提出,2012年国际泌尿病理协会将SDH 缺陷相关肾细胞肿瘤收录为暂定的肾细胞癌亚型[1-3]。SDH 缺陷型肾癌发病率极低,占所有肾癌的0.05% ~ 0.2%[1]。学界对其认识较少,现将我科2019 年7 月收治的1 例SDH 缺陷型肾癌患者诊治过程报告如下。

图 1 29岁女性患者术前CT影像 A:平扫呈等密度,密度欠均匀,内见斑点; B、C: 静脉期及肾实质期正常肾明显强化; D: 增强扫描后动脉期病灶明显不均匀强化
1 病例资料患者,女,29 岁,因“体检发现右肾占位3 d”于2019 年7 月3 日入我院。患者于3 d 前在当地医院行泌尿系超声检查时提示右肾等回声占位结节(3.7 cm×3.5 cm),遂至我院就诊。患者自发病以来无腰痛、血尿等不适。入院后行双肾增强CT(图1)示:右肾下极一类圆形占位性病变,边界欠清,突出于肾外生长,大小约4.1 cm×3.9 cm×3.8 cm,平扫成等密度,密度欠均匀,内见斑点、小斑片状更低密度影及稍高密度影,增强扫描后动脉期病灶不均匀强化,静脉期及肾实质期正常肾明显强化,病灶与正常肾对比明显。考虑患者为右肾癌,于2019 年7 月4 日行3D 后腹腔镜下右肾部分切除术,将肿物完整切除,大体标本(图2):类圆形肿物,包膜完整,与周围分界清,切面呈灰白、灰红色,实性,质中,局部见出血。病理(图3)示:组织内见瘤细胞排列成腺管状,推挤性生长,可见正常肾小管穿插其间;瘤细胞体积大,轮廓清楚,胞质大部分嗜酸性,小部分空亮,核小圆形,位于边缘或中央,染色质絮状,核仁不清,核分裂象罕见,间质纤维增生伴炎细胞浸润,免疫组化:SDH-B(-)。术后送肿瘤组织行基因检测,基于送检样本的基因变异结果提示,可能的临床获益药物有帕博利单抗、纳武利尤单抗、阿特朱单抗、特瑞普利单抗、信迪利单抗、卡瑞立珠单抗等。患者术后恢复顺利出院,术后3 个月至门诊复查平扫CT(图4)示:右肾癌术后改变。

图 2 大体标本(已切开):类圆形肿物,包膜完整,与周围分界清,切面呈灰白、灰红色,实性,质中,局部见出血

图 3 术后病理HE染色(×400):组织内见瘤细胞排列成腺管状,推挤性生长,可见正常肾小管穿插其间;瘤细胞体积大,轮廓清楚,胞质大部分嗜酸性,小部分空亮,核小圆形,位于边缘或中央,染色质絮状,核仁不清,核分裂象罕见,间质纤维增生伴炎细胞浸润
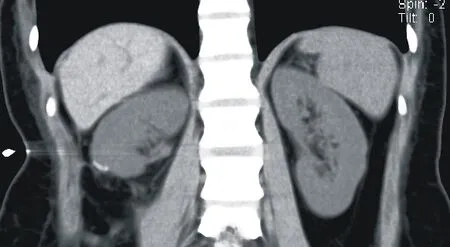
图 4 术后3个月患者右肾癌术后改变
2 讨论SDH 是包含4 个 亚基(SDHA、SHDB、SDHC、SDHD)的酶复合体,也被称作线粒体复合体Ⅱ,是三羧酸循环和电子呼吸链传递途径中的关键酶[4]。SDHB 基因突变者罹患肾细胞癌的风险为14%[5-6]。SDH 缺陷型肾癌占所有肾癌的0.05% ~0.2%[7]。发病年龄略低于一般的肾癌。国外报道SDH 缺陷型肾癌平均发病为38 ~ 40 岁,男性略多于女性,男女发病率比约为1.8 ∶1[5,7-8]。SDH 缺陷型肾癌肉眼观下大致为实性,边界清楚,包膜完整,有时可见囊性改变,切面为灰红、灰褐色,可伴有出血,30%左右的病例发生双侧肾肿瘤[5]。本例患者肿瘤发生于右侧肾。和其他类型肾细胞癌相比,SDH 缺陷型肾癌在镜下表现相似,肿瘤有清晰的边界和分叶,肿瘤细胞排列在实性癌巢或小管中,常可见囊性改变,并常含嗜酸性液体[9]。最显著的组织学特征是细胞质空泡或内含物的存在,电镜下可见线粒体增大。一些肿瘤细胞展现去分化特征,如明显的核仁、肉瘤样改变或凝固型坏死。因此,寻找经典的低级别形态学表现的细胞或细胞质内包涵体可以帮助诊断[7-8]。
SDH 缺陷型肾癌主要需与肾嗜酸细胞瘤、嫌色细胞癌等相鉴别,组织形态学及免疫组化证实SDH 蛋白表达的缺失,或基因检测证实SDH 基因突变为确诊SDH 缺陷型RCC 的最佳手段[9]。对于SDH 缺陷型RCC,建议早期手术干预。具有典型低级别细胞核的SDH 缺陷型RCC 的转移风险较低,约为11%,通常仅行保留肾单位的手术治疗[10]。而部分表现出高级别核型、肉瘤样改变或凝固性坏死的肿瘤,可能具有高转移风险(70%),需行根治性肾切除术[11]。在发生转移的病例中,分子靶向药物可选择VEGF 途径抑制剂、哺乳动物雷帕霉素或酪氨酸激酶抑制剂等[9,12-13]。本例患者术前CT 显示平扫成等密度,密度欠均匀,内见斑点、小斑片状更低密度影及稍高密度影,增强扫描后动脉期病灶不均匀强化,考虑为恶性肿瘤。但肿瘤突出肾外,大小适中,增强扫描见肿瘤与正常肾对比明显,未侵犯集合系统,未突破肾脂肪囊、肾筋膜,同时考虑患者年纪较轻,遂手术方式选择保留肾单位的部分切除术,术后予定期随访。
鉴于SDH 缺陷型RCC 患者发生相关肿瘤的风险升高,建议在对患者进行随访时应注意针对嗜铬细胞瘤、副神经节瘤、胃肠道间质瘤、垂体腺瘤等进行必要筛查。Gill 等[7]曾报道27 例SDH 缺陷型肾癌队列,发现其中有4 例(15%)同时患有SDH 缺陷型胃肠间质瘤,有4 例(15%)除患肾肿瘤外,还患有副神经节瘤。在该研究中,5 例的一级亲属患有肾癌,5 例的一级亲属和2 例的二级亲属与嗜铬细胞瘤/副神经节瘤相关,1 例一级亲属与SDH 缺陷型胃肠间质瘤相关。因此,SDH 缺陷型肾癌患者的亲属在必要时也应纳入监测。
总体上,SDH 缺陷型肾癌由于发病率低,尚无大型的随访队列研究报道。因此其临床及病理特点,以及各种缺陷型肾癌之间组织学、基因学及预后的差异仍需进一步总结分析。

